MR弥散加权成像在延迟期强化的肝脏恶性肿瘤与肝血管瘤鉴别诊断中的应用
白若冰,郭启勇,石 喻,卢再鸣,杨京川,孙宝海
(1.中国医科大学附属盛京医院放射科,辽宁 沈阳 110004;2.Philips公司大中华区磁共振培训部,上海 200233)
延迟期强化是典型肝脏血管瘤的主要强化特征,但是,部分恶性肿瘤,如胆管细胞癌及部分原发性肝癌,在强化方式上也表现为延迟期强化,这些延迟期强化的肿瘤在影像诊断实际工作中很容易被误诊为血管瘤。
MR弥散加权成像(DWI)在显示疾病的敏感性以及诊断和鉴别诊断方面具有重要的价值。近年来,随着平面回波成像(EPI)等快速序列的应用及硬件的发展,DWI在肝脏疾病的研究方面亦显示出良好的前景[1-2],尤其已经有很多实验证实肝脏DWI技术在鉴别肝脏占位性病变良恶性方面有良好的应用价值[3-9]。本研究主要对延迟期明显强化的肝细胞癌、胆管细胞癌进行DWI,对其表观弥散系数(ADC)值进行测量,并与肝血管瘤进行比较,旨在探讨MR DWI在延迟期明显强化的肝脏恶性占位与肝血管瘤鉴别诊断中的应用价值。
1 资料与方法
1.1 一般资料
本研究收集2009年7月~2010年1月在我院就诊的肝脏占位性病变,且病变延迟期强化的病例共32例。其中包括肝细胞癌9例,胆管细胞癌12例,肝血管瘤11例。其中肝细胞癌经手术证实5例,其余经其他影像检查结合临床随访证实,12例胆管细胞癌均经病理证实。11例肝血管瘤1例经病理证实,其余经超声、CT、MR平扫及动态增强、DSA等综合影像分析确诊,部分病例经随访证实。
延迟期强化病灶定义为肝脏多期动态增强扫描显示病灶延迟期强化程度高于动脉期。如果病灶较大且血供明显不均匀,则按照上述条件将同一病灶内的延迟强化区纳入研究范围。
1.2 MRI扫描
所有病例扫描采用Philips Gyroscan Intera 1.5T超导型磁共振机,6通道体部相控表面线圈,扫描序列包括常规轴位T1WI、T2WI和脂肪抑制T2WI。动态增强扫描造影剂为Gd-DTPA,注量为15ml,肘静脉快速推注,注射后延迟5~10s开始动脉期图像采集,采用 THRIVE 序列(TR/TE:251.3ms/4.9ms)进行全肝扫描,层厚6.5mm,采集1次,每个动态扫描时间为15s,在一次屏气状态下完成1次动态扫描,1min后行门脉期图像采集,3~5min行延迟期图像采集。
DWI采用单次激发平面回波成像序列(single shot SE-EPI),相位编码为前-后方向。扫描参数为:TE 80ms;TR 3000ms; 层厚 5.0mm;FOV 300mm×300mm;矩阵 192×128;激励次数(NSA)3 次;使用呼吸门控技术进行自由呼吸扫描,时间为1分44秒,于扫描野上方与下方各加一个预饱和带,以消除肺部气体、胃肠道气体及心脏搏动、胃肠蠕动对图像质量的影响。b值采用2个:b=0和500s/mm2。扫描后由扫描仪自带软件产生ADC图。
1.3 图像分析与处理
DWI扫描所得图像由两名高年资放射科医师(执业年龄大于5年)背靠背评价,主要评价在b=500s/mm2图像上肝脏占位性病变信号的高低,如果病灶DWI信号为高低混杂,则作为高信号病灶处理。当两位医师意见不一致时,由第三人作补充评价,以多数人意见作为最终评价结果。
利用后处理得到的ADC图划定感兴趣区(ROI)进行ADC值测量,ROI大小设定为200像素左右,测量时尽可能避开血管和胆管走行的位置,在病灶显示的最大层面选取3个ROI并将测得的数值取平均值,小的病灶只测量1~2个ROI,测量大的病灶尽量避免测量病灶中心部位。
1.4 统计学处理
采用SPSS16.0软件包对图像分析及处理所得到的计量及计数数据进行处理。对不同肝脏占位性病变b=500s/mm2时的图像信号高低的评价结果进行χ2检验,以P<0.05作为有显著性差异。所有病灶的ADC 值用均数±标准差()表示,肝细胞癌、胆管细胞癌及肝血管瘤病例的ADC值之间两两进行均数比较t检验进行分析,以P<0.05为具有统计学意义。
2 结果
所有病灶的b=500s/mm2时图像的信号高低结果如表1所示,χ2检验结果为本实验所研究的这3种肝脏占位性病变当b=500s/mm2图像信号高低没有显著性差异(χ2=1.30,P>0.05)。
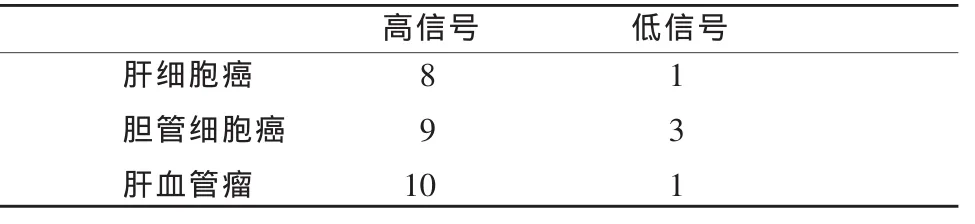
表1 不同肝脏占位性病变b=500s/mm2图像的信号强度评价
所有病例ADC值测量结果如图1所示。肝细胞癌病例 ADC 值[(1.28±0.46)mm2/s]和胆管细胞癌病例 ADC 值[(1.61±0.38)mm2/s]均显著低于肝血管瘤患者[(2.85±0.89)mm2/s](t=4.780,P=0.000;t=3.7025,P=0.001)。而肝细胞癌病例与胆管细胞癌病例的ADC 值没有显著性差异(t=1.8008,P=0.088)。各组病变ADC值比较结果及部分病例的图像见图1~5。

图1 延迟期强化肝脏占位性病变的ADC值比较。Figure 1.Comparison between ADC values of different liver masses enhanced in delayed phase on contrast-enhanced MRI.
3 讨论
肝脏占位的MR动态增强形式和程度受到病变的组织类型、组织结构及血供情况的共同影响。其中肝血管瘤由于其组织形态特点,其典型强化方式为延迟期强化,但是延迟期强化的肝脏占位不仅仅包括肝血管瘤,还包括肝脏的一些常见的恶性肿瘤。
由于血供主要来自肝动脉,所以肝细胞癌典型
的强化方式为速升速降型,占全部病例的60%。但部分恶性度较低的肝细胞癌由于其血供来自门静脉,所以在门脉期与延迟期其强化程度并未下降,对于这样的肝细胞癌,Yamashita等[10]认为仅依据多期动态增强扫描作定性诊断显然不够。
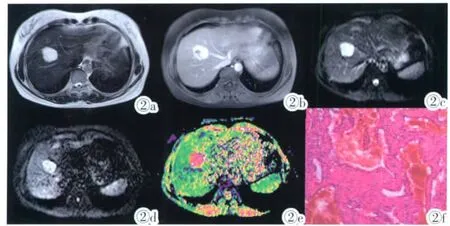
图 2 肝右叶血管瘤。图2a:T2/SPIR病灶呈高信号;图2b:延迟期病灶强化范围增大,向中心填充;图2c:DWI图像(b=0s/mm2)病灶呈高信号;图 2d:DWI图像(b=500s/mm2)病灶呈高信号;图2e:ADC图病灶呈高信号;图2f:病理提示病灶为肝血管瘤。Figure 2.Cavernous hemangioma in right lobe of liver.Figure 2a:T2/SPIR image the intensity is high.Figure 2b:The enhancement range increased and the contrast medium filled toward to the center of the lesion in delayed phase.Figure 2c:The signal intensity of lesion is high on DWI(b=0s/mm2).Figure 2d:The signal intensity of lesion is high on DWI(b=500s/mm2).Figure 2e:The ADC value of the lesion is high.Figure 2f:Pathological report:cavernous hemangioma.

图3 肝右叶肝细胞癌的多时相MRI扫描。图3a:T2/SPIR病灶呈稍高信号;图3b:动脉期病灶未见强化;图3c:门脉期病灶边缘可见强化;图3d:延迟期病灶强化范围增大。该病例临床诊断为肝血管瘤。Figure 3.Multi-phase MRI scan of primary hepatocellular carcinoma in right lobe of liver.Figure 3a:T2/SPIR image the intensity is medium high.Figure 3b:The lesion did not enhance in arterial phase.Figure 3c:The enhancement range located in the peripheral of the lesion in portal phase.

图4 肝右叶肝细胞癌的DWI图像。图 4a:DWI图像(b=0s/mm2)病灶呈稍高信号;图 4b:DWI图像(b=500s/mm2)病灶呈高信号;图4c:ADC图病灶呈低信号;图4d:病理提示病灶为肝细胞癌。Figure 4.DWI of primary hepatocellular carcinoma in right lobe of liver.Figure 4a:The signal intensity of lesion is medium high on DWI(b=0s/mm2).Figure 4b:The signal intensity of lesion is high on DWI(b=500s/mm2).Figure 4c:The ADC value of the lesion is low.Figure 4d:Pathological report:hepatocellular carcinoma.
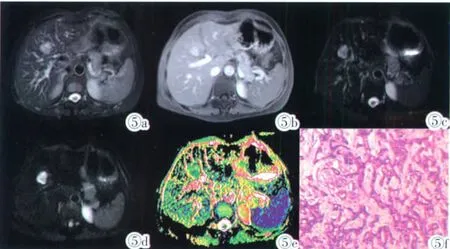
图5 肝右叶肝内胆管细胞癌。图 5a:T2/SPIR病灶呈稍高信号;图5b:延迟期病灶强化范围增大,该病例临床诊断为肝血管瘤;图5c:DWI图像(b=0s/mm2)病灶呈稍高信号;图 5d:DWI图像(b=500s/mm2) 病灶呈高信号;图5e:ADC图病灶呈低信号;图5f:病理提示病灶为肝内胆管细胞癌。Figure 5.Cholangiocarcinoma in right lobe of liver.Figure 5a:T2/SPIR image the intensity is medium high.Figure 5b:The enhancement range of the lesion increased in delayed phase,and the lesion was clinically diagnosed as cavernous hemangioma.Figure 5c:The signal intensity of lesion is medium high on DWI(b=0s/mm2).Figure 5d:The signal intensity of lesion is high on DWI(b=500s/mm2).Figure 5e:The ADC value of the lesion was low.Figure 5f:Pathological report:cholangiocarcinoma.
胆管细胞癌病理特征为肿瘤含有丰富的纤维间质和黏液。而MRI造影所用的Gd-DTPA为细胞外间隙造影剂,其经血管进入纤维间质内及从纤维间质经血管清除都较慢,所以肝内胆管细胞癌门脉期和延迟期都会有进一步强化[11]。显然,仅靠强化方式,很难将其与常见的肝血管瘤分开。
弥散是指分子因热运动所致的布朗运动,通常这种运动是任意和无规律的。MR DWI是将宏观流动相位位移成像原理应用于微观分子水平的成像方法。活体组织的弥散系数值受到许多微循环因素影响,如体液的流动、细胞的渗透性和温度、毛细血管灌注、细胞膜通透性的方向等[6,12]。目前的研究认为,在判定肝脏占位的良恶性方面,肝脏DWI检查有很高的敏感性和特异性[13-14]。
我们研究发现,虽然原发性肝细胞癌和胆管细胞癌的ADC值与肝血管瘤有显著性差异,在DWI上这3种占位多数都呈现高信号,而且其信号高低与占位的性质无关,这可能是由于虽然其水分子弥散状况有差异,但血管瘤的b0图像信号非常高,因此由于T2透射效应,它们的DWI均显示为高信号。由此,我们认为仅仅依靠DWI的信号高低是不足以区分这3种肿瘤的,必须基于ADC图进行定量分析。
在我们的研究中,无论是肝细胞癌还是胆管细胞癌,其ADC值都显著低于肝血管瘤。一般认为,肝脏血管瘤主要由液体成分组成,而肝脏恶性肿瘤的成分为分化差的实性肿瘤组织,自由水相对较少,其分子运动明显受限,因此ADC值明显低于肝血管瘤。基于我们研究的结果,我们认为,DWI在鉴别这些难于通过强化方式区分的肿瘤的良恶性方面可能有比较好的作用。
我们的研究还显示,病理类型完全不同的肝细胞癌和胆管细胞癌的ADC值并无显著性差异。关于肝细胞癌和胆管细胞癌ADC值孰高孰低,目前尚无定论[15-17]。在我们的研究中肝细胞癌和胆管细胞癌的ADC值未见显著差异的原因可能是由于虽然理论上DWI可以探测到细胞的渗透性、毛细血管灌注及细胞膜通透性方向等病灶性质的特点,但是这些差异可能并不大,超出了现有由于设备的探测能力,或者被目前阶段DWI研究无法克服的生理性噪声,如呼吸、心跳、大血管搏动、温度等掩盖,从而无法测出。
我们的实验采用了b值500s/mm2,理论上更大的b值可能使DWI研究对于水分子弥散状况差异的测定更加敏感。但随着b值的增大,化学位移伪影、磁敏感伪影等各种伪影增多,图像易变形,同时,高b值需要较长的TE值,而正常肝脏的T2值较短,约为50ms,部分肝脏病变的T2值亦较短,长TE会使信噪比下降,严重影响图像质量。随着b值的升高,肝脏弥散图像质量显著下降已经被很多实验所证实[18-20]。基于以往的肝脏MR DWI研究结果[21-22],考虑到提高图像质量及减小图像变形以便精确勾画感兴趣区,因此本研究应用b值500s/mm2。
我们的研究还存在许多局限性,比如样本数有限,使得统计效力受到了影响,此外,比较少见的延迟期强化肝脏占位由于难以收集足够的样本,而未被列入研究,导致研究的病种也仅仅局限于3种,这都在一定程度上可能对研究结果造成影响。我们没有强调年龄的匹配,这也可能对ADC值的计算造成一定的影响。
总之,我们的研究结果表明,对于延迟期强化的肝脏占位,DWI成像虽然难于定性诊断其病理类型,但在鉴别诊断恶性肿瘤与肝血管瘤方面,依然有较高的应用价值,可以作为常规序列的有益补充。
[1]Chow LC,Bammer R,Moseley ME,et al.Single breath-hold diffusion-weighted imaging of the abdomen[J].J Magn Reson Imaging,2003,18(3):377-382.
[2]Boulanger Y,Amara M,Lepanto L,et al.Diffusion-weighted MR imaging of the liver of hepatitis C patients[J].NMR Biomed,2003,16(3):132-136.
[3]Muller MF,Prasad P,Siewert B,et al.Abdominal diffusion mapping with use of a whole-body echo-planar system[J].Radiology,1994,190(2):475-478.
[4]Namimoto T,Yamashita Y,Sumi S,et al.Focal liver masses:characterization with diffusion-weighted echo-planar MR imaging[J].Radiology,1997,204(3):739-744.
[5]徐海波,孔祥泉,肖学宏,等.扩散加权平面回波成像在肝占位性病变中的应用探讨[J]. 中华放射学杂志,1999,33(11):766-768.
[6]Yamada I,Aung W,Himeno Y,et al.Diffusion coefficients in abdominal organs and hepatic lesions:evaluation with intravoxel incoherent motion echo-planar MR imaging[J].Radiology,1999,210(3):617-623.
[7]Taouli B,Vilgrain V,Dumont E,et al.Evaluation of liver diffusion isotropy and characterization of focal hepatic lesions with two single-shot echo-planar MR imaging sequences:prospective study in 66 patients[J].Radiology,2003,226(1):71-78.
[8]Thoeny HC,De Keyzer F.Extracranial applications of diffusion weighted magnetic resonance imaging[J].Eur Radiol,2007,17(6):1385-1393.
[9]Taouli B,Koh D.Diffusion-weighted MR imaging of the liver[J].Radiology,2010,254(1):47-66.
[10]Yamashita Y,Fan ZM,Yamamoto H,et al.Spin-echo and dynamic gadolinium-enhanced FLASH MR imaging of hepatocellular carcinoma:correlation with histopathologic findings[J].J Magn Reson Imaging,1994,4(1):83-90.
[11]Maetani Y,Itoh K,Watanabe C,et al.MR imaging of intrahepatic cholangiocarcinoma with pathologic correlation [J].AJR,2001,176(6):1499-1507.
[12]袁友红.肝脏磁共振扩散成像及进展 [J].实用放射学杂志,2003,19(10):945-948.
[13]Gourtsoyianni S,Papanikolaou N,Yarmenitis S,et al.Respiratory gated diffusion-weighted imaging of the liver:value of apparent diffusion coefficient measurements in the differentiation between most commonly encountered benign and malignant focal liver lesions[J].Eur Radiol,2008,18(3):486-492.
[14]Parikh T,Drew SJ,Lee VS,et al.Focal liver lesion detection and characterization with diffusion-weighted MR imaging:comparison with standard breath-hold T2-weighted imaging[J].Radiology,2008,246(3):812-822.
[15]于德新,李传福,张晓明,等.3.0T磁共振弥散成像对肝脏恶性局灶性病变诊断的价值[J].山东大学学报(医学版),2006,44(5):496-500.
[16]郑晓林,徐辉雄,吕明德,等.扩散加权MRI定性诊断肝脏局灶性病变的研究[J]. 中华放射学杂志,2005,39(2):173-176.
[17]Koike N,Cho A,Nasu K,et al.Role of diffusion-weighted magnetic resonance imaging in the differential diagnosis of focal hepatic lesions[J].World J Gastroenterol,2009,15(46):5805-5812.
[18]Kim T,Murakami T,Takahashi S,et al.Diffusion-weighted single-shot echoplanar MR imaging for liver disease[J].AJR,1999,173(2):393-398.
[19]Jones DK,Basser PJ.“Squashing peanuts and smashing pumpkins”:how noise distorts diffusion-weighted MR data[J].Magn Reson Med,2004,52(5):979-993.
[20]Goshima S,Kanematsu M,Kondo H,et al.Diffusion-weighted imaging of the liver:optimizing b value for the detection and characterization of benign and malignant hepatic lesions[J].J Magn Reson Imaging,2008,28(3):691-697.
[21]OlsenØ E,Sebire NJ.Apparent diffusion coefficient maps of pediatric mass lesions with free-breathing diffusion-weighted magnetic resonance:feasibility study[J].Acta Radiol,2006,47(2):198-204.
[22]Razek AA,Abdalla A,Omran E,et al.Diagnosis and quantification of hepatic fibrosis in children with diffusion weighted MR imaging[J].Eur J Radiol,2011,78(1):129-134.

