Fe(CN/Fe(CN体系阳极过程的电化学Peltier热
杨中发,方正,王少芬,张正华
杨中发1,方正1,王少芬2,张正华1
(1.中南大学 化学化工学院,湖南 长沙,410083;2.长沙理工大学 化学与生物工程学院,湖南 长沙,410077)
采用热电化学方法测定电极反应电化学Peltier热。实验中将高灵敏度热敏电阻紧贴于工作电极表面,结合SRC−100溶解−反应量热仪与电化学工作站组装成高精度热电化学测试系统,其控温精度达±0.001 K。运用该测试系统分别对5个不同浓度等物质的量比的Fe(CN)63−/Fe(CN)64−体系阳极过程进行恒电流极化,得到该电极反应电极电势和温度变化与时间的关系曲线,运用热电化学方程,得到298.15K时Fe(CN)63−/Fe(CN)64−体系阳极过程电化学Peltier热,分别为41.51 kJ/mol (0.075 mol/L),43.48 kJ/mol(0.10 mol/L),46.95 kJ/mol(0.15 mol/L),50.77 kJ/mol(0.20 mol/L)和54.81 kJ/mol(0.25 mol/L),由此获得该温度下的标准氢电极反应在绝对标度下的熵变。
热电化学;Peltier热;标准氢电极;Fe(CN)63−/ Fe(CN)64−体系
热电化学方法是将热化学与电化学相结合的一种物理化学研究方法。它在测量电极过程电信号的同时研究其热效应,通过搜集测量过程中电压−电流−热流−时间四维信息,并基于热电化学基本原理分析实验数据,可获得比单纯热力学或电化学分析方法更全面的信息。电化学Peltier热是指电荷可逆通过电极与溶液界面时产生的热效应。目前已有不少学者对电化学Peltier热及其测量方法进行了研究[1−6]。使用测温元件测量电极表面温度变化,能得到电极反应瞬时热效应,并易于测试单个电极反应的热效应,但目前还没有一套能独立承担测温的热电测试系统。以往电化学Peltier热的测试方法,由于温度控制和数据采集处理困难等问题,不便使用[7−12]。本文作者采用自组装的控温达0.001 K的高精度恒温环境热电化学测试系统,对 5个不同浓度下 Fe(CN)63−/Fe(CN)64−体系阳极过程进行测试,运用热电化学数据处理方法得到各电极过程电化学 Peltier热和绝对标度下标准氢电极反应的熵变。
1 实验原理
在相同温度压强下,设任何一个电极反应在现行标度下的电极电势为φ(vs.SHE,Standard hydrogen electrode),即以标准氢电极作为标准电极所得的电极电势。绝对标度下电极电势为φ*,二者关系为[13]:ΔL*可以分别为绝对标度下的吉布斯自由能ΔG*,熵变ΔS*和焓变ΔH*;则ΔL对应分别为现行标度下的吉布斯自由能ΔG,熵变ΔS和焓变ΔH;z为电子转移数。


电极反应过程中电化学Peltier热规定为[14]:其中:Π为电化学Peltier热;ΔS*为绝对标度下熵变;T为热力学温度。当i→0时,电极过程为可逆过程,电化学Peltier热为电极过程可逆热效应。
根椐热力学定律,在绝对标度下有:


2 实验与数据处理方法
实验装置与文献[13]中的相同, 为自组装热电化学工作站。它由 CHI660B型电化学工作站(上海辰华仪器公司生产)和SRC−100溶解反应量热仪(武汉大学化学与分子科学学院热化学实验室生产)组成。采用自制U型电解槽以保持电解液与水浴本体的热传导,确保反应过程中电解液温度稳定。将高灵敏度热敏电阻(MF−54型80 kΩ武汉海创电子有限公司生产)直接贴在铂电极背面,并用环氧树脂固定制成工作电极,以检测电极反应过程中瞬时热效应;辅助电极为铂电极,参比电极为饱和甘汞电电极。与量热仪配套的超级恒温槽能提供稳定的恒温环境,控温精度可长时间保持在−1×10−3~1×10−3K 范围内。将工作电极中热敏电阻连接在溶解反应量热仪上,与仪器中另外3个精密电阻组成惠斯通电桥,电极反应过程中产生的热效应通过惠斯通电桥转变为电势信号输出。实验测得输出电势信号与温度变化关系为:ΔV(mV)=170.2ΔT−0.006 9。当阳极有电流通过时,电极表面温度变化、电流和电极电势同时分别由量热仪和电化学工作站记录。
利用温度的变化确定热量Q,通过电流和电极电势确定We′。数据处理方法如下:

试剂为分析纯 K3Fe(CN)6(天津化学试剂研究所生产)和 K4Fe(CN)6(湘中精细化学品厂生产),采用电导率≤0.5 μS/cm 的去离子水将 K3Fe(CN)6和K4Fe(CN)6按物质的量1:1配制成不同浓度溶液,并加入1 mol/L的KCl作支持电解质。
3 实验结果与分析

实验控制温度为298.15 K,分别对不同浓度溶液进行恒电流扫描,扫描时间为120 s,得到各浓度下电极电势和温度变化引起的电信号变化对时间的关系曲线。其中 0.025 mol/L 溶液的φ(vs.SHE)−t和 ΔV−t关系曲线如图1所示。曲线积分采用数据处理软件自动完成,各浓度体系的实验数据及k,Π=(Q)i→0,ΔH0(c)和We=(We′)i→0见表1。从表1中可以得到不同浓度的Fe(CN/Fe(CN体系阳极 Peltier热分别为 41.51 kJ/mol(0.075 mol/L),43.48 kJ/mo(0.10 mol/L),46.95 kJ/mol(0.15 mol/L),50.77 kJ/mol(0.20 mol/L)和 54.81 kJ/mol(0.25 mol/L)。不同浓度时ΔH0(c)对浓度c关系如图2所示。当外推到浓度为零时,有ΔH0(c)(c→0)=−80.358 kJ/mol,由 ΔH(c→0)[15]及式(8)计算得到ΔS*(H+/H2)为 86.91 J/(K·mol)。与文献[13]和文献[16]中得到的绝对标度下标准氢电极反应熵变值非常接近。
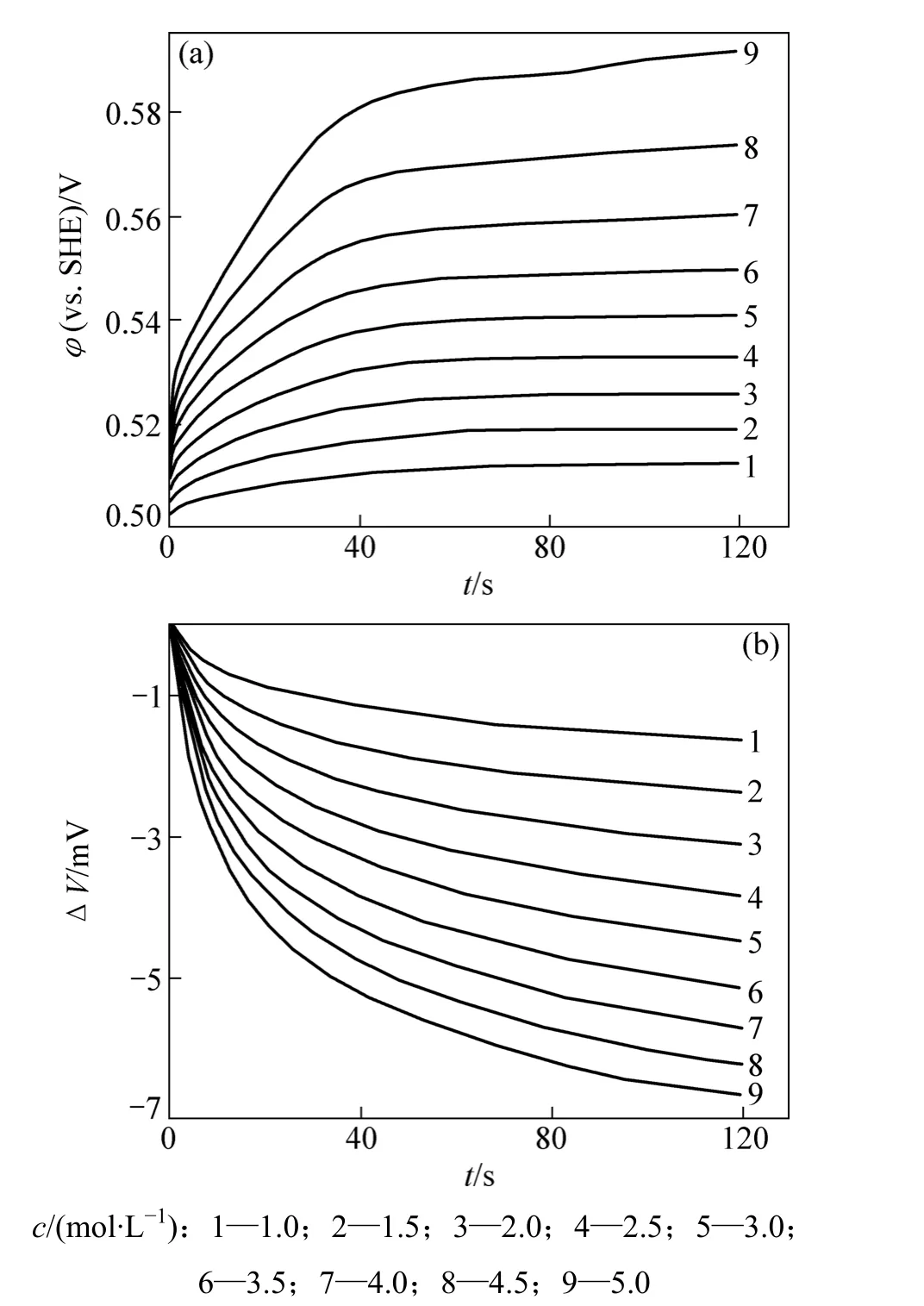
图 1 0.25 mol/LFe(CN/Fe(CN体系 φ(vs. SHE)−t和ΔV−t关系曲线Fig.1 Curves of φ(vs. SHE) vs t and ΔV vs t for 0.25 mol/L Fe(CN/Fe(CN system

图2 Fe(CN/Fe(CN)体系ΔH0(c)与浓度c的关系Fig.2 Relationship between ΔH0(c) and concentration c for Fe(CNFe(CNsystem
表1 不同浓度下 Fe(CN/Fe(CN体系实验数据Table 1 Experimental results for Fe(CNFe(CN at various concentrations
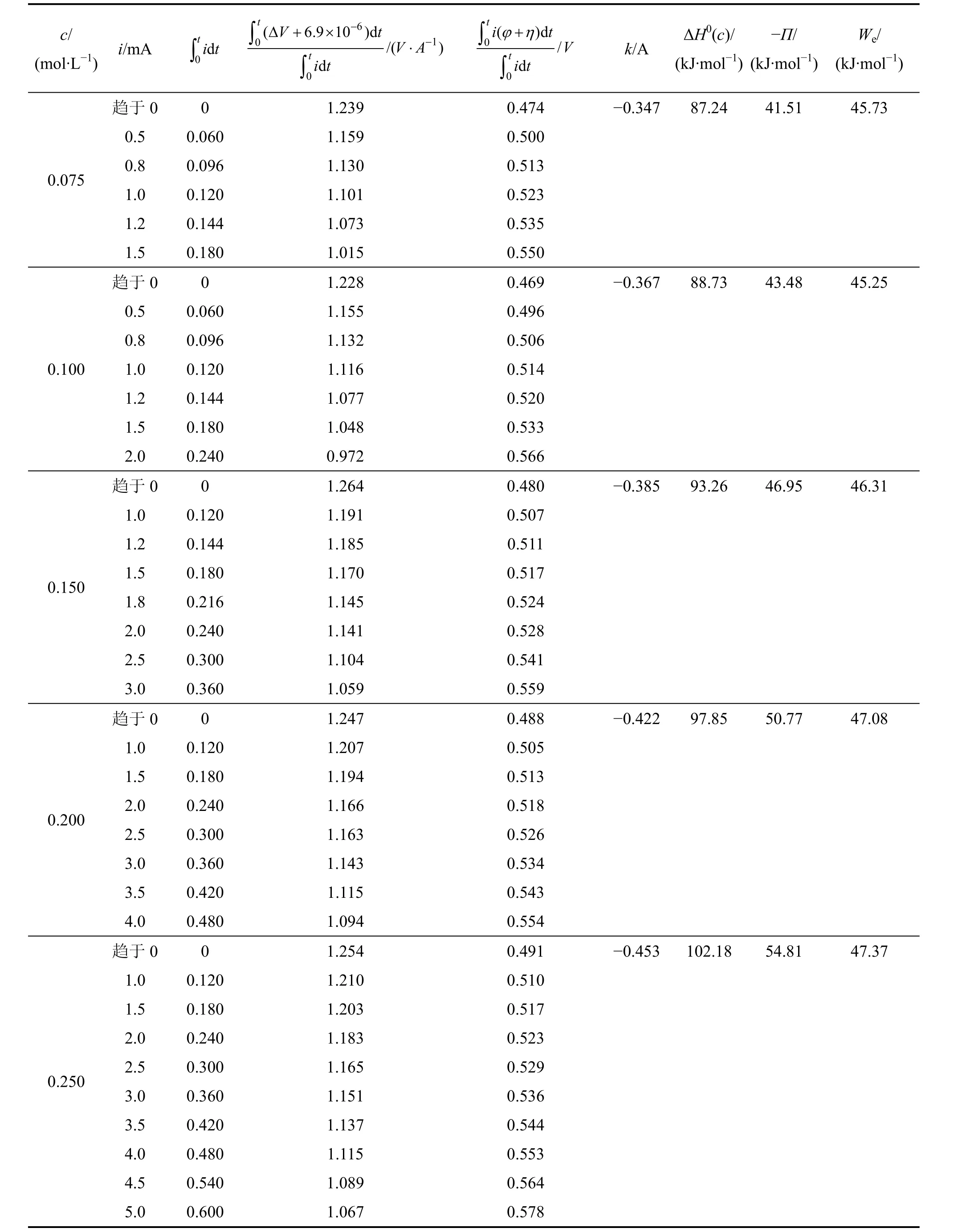
表1 不同浓度下 Fe(CN/Fe(CN体系实验数据Table 1 Experimental results for Fe(CNFe(CN at various concentrations
注:表中 6.9×10−6来自实验确定的 ΔV(mV)=170.2ΔT−0.006 9。
c/(m o l·L−1) i/m A ∫t i t0 d∫t −6 0 V −1( 6.9 1 0 )d/( )d Δ+ × ⋅∫t 0 t V A i t 0.0 7 5趋于0 0.5 0.8 1.0 1.2 1.5 0 0.0 6 0 0.0 9 6 0.1 2 0 0.1 4 4 0.1 8 0 1.2 3 9 1.1 5 9 1.1 3 0 1.1 0 1 1.0 7 3 1.0 1 5 0.1 0 0趋于0 0.5 0.8 1.0 1.2 1.5 2.0 0 0.0 6 0 0.0 9 6 0.1 2 0 0.1 4 4 0.1 8 0 0.2 4 0 1.2 2 8 1.1 5 5 1.1 3 2 1.1 1 6 1.0 7 7 1.0 4 8 0.9 7 2 0.1 5 0趋于0 1.0 1.2 1.5 1.8 2.0 2.5 3.0 0 0.1 2 0 0.1 4 4 0.1 8 0 0.2 1 6 0.2 4 0 0.3 0 0 0.3 6 0 1.2 6 4 1.1 9 1 1.1 8 5 1.1 7 0 1.1 4 5 1.1 4 1 1.1 0 4 1.0 5 9 0.2 0 0趋于0 1.0 1.5 2.0 2.5 3.0 3.5 4.0 0 0.1 2 0 0.1 8 0 0.2 4 0 0.3 0 0 0.3 6 0 0.4 2 0 0.4 8 0 1.2 4 7 1.2 0 7 1.1 9 4 1.1 6 6 1.1 6 3 1.1 4 3 1.1 1 5 1.0 9 4 0.2 5 0趋于0 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 0 0.1 2 0 0.1 8 0 0.2 4 0 0.3 0 0 0.3 6 0 0.4 2 0 0.4 8 0 0.5 4 0 0.6 0 0 1.2 5 4 1.2 1 0 1.2 0 3 1.1 8 3 1.1 6 5 1.1 5 1 1.1 3 7 1.1 1 5 1.0 8 9 1.0 6 7 0.4 6 9 0.4 9 6 0.5 0 6 0.5 1 4 0.5 2 0 0.5 3 3 0.5 6 6−0.3 6 7 8 8.7 3 4 3.4 8 4 5.2 5 0.4 8 0 0.5 0 7 0.5 1 1 0.5 1 7 0.5 2 4 0.5 2 8 0.5 4 1 0.5 5 9−0.3 8 5 9 3.2 6 4 6.9 5 4 6.3 1 0.4 8 8 0.5 0 5 0.5 1 3 0.5 1 8 0.5 2 6 0.5 3 4 0.5 4 3 0.5 5 4−0.4 2 2 9 7.8 5 5 0.7 7 4 7.0 8 0.4 9 1 0.5 1 0 0.5 1 7 0.5 2 3 0.5 2 9 0.5 3 6 0.5 4 4 0.5 5 3 0.5 6 4 0.5 7 8−0.4 5 3 1 0 2.1 8 5 4.8 1 4 7.3 7∫t 0 ϕ+η it V i t( )d/d∫t 0 k/A Δ H0(c)/(k J·m o l−1)−Π/(k J·m o l−1)We/(k J·m o l−1)0.4 7 4 0.5 0 0 0.5 1 3 0.5 2 3 0.5 3 5 0.5 5 0−0.3 4 7 8 7.2 4 4 1.5 1 4 5.7 3
4 结论
(1) 将热电化学方法用于测定 Fe(CN)63−/Fe(CN)64−体系电极反应电化学 Peltier热。结合SRC-100溶解反应量热仪与电化学工作站自组装成高精度热电化学测试系统。
(2)测定了 5个不同浓度下等物质的量比的Fe(CN)63−/Fe(CN)64−体系阳极过程热和电功,采用外推法得到这些浓度下 Fe(CN)63−/Fe(CN)64−体系阳极过程Peltier热,分别为41.51 kJ/mol(0.075 mOl/L),43.48 kJ/mol(0.10 mol/L),46.95 kJ/mol(0.15 mol/L),50.77 kJ/mol(0.20 mol/L)和 54.81 kJ/mol(0.25 mol/L)。
(3) 在298.15 K时标准氢电极反应在绝对标度下的熵变 ΔS*(H+/H2)为 86.91 J/(K·mol)。
[1]Maeda Y, Kumagai K. Electrochemical Peltier in the polypyrrole-electrolyte system[J]. Thermochimica Acta, 1995,267: 139−148.
[2]Decker F, Fracastoro-decker M, Cella N, et al. Acoustic detection of the electrochemical Peltier effect[J]. Electrochim Acta, 1990,35(1): 25−26.
[3]Reita T. The electrochemical Peltier effect observed with electrode reactions of Fe(Ⅱ)/Fe(Ⅲ) redox couples at a gold electrode[J]. J Electroanal Chem,1975, 65(1): 263−273.
[4]Boudeville P. Thermometric determination of electrochemical Peltier heat (thermal effect associated with electron transfer) of some redox couples[J]. Inorg Chim Acta, 1994, 226(1/2): 69−78.
[5]Hironori N, Toshiyuki N, Yasuhiko I. The single electrode Peltier heats of Li/Li+, H2/H+and Li+/Pd-Li couples in molten LiCI-KCI systems[J]. Electrchim Acta, 2004, 49(27): 4987−4991.
[6]Jung D H, Moon I K, Jeong Y H. Peltier AC calorimeter[J].Thermochimica Acta, 2002, 391(1/2):7−12.
[7]Reita T. An experimental study of the electrochemical Peltier heat[J]. J Electroanal Chem, 1973, 45(3): 500−503.
[8]ZHANG Hong-zhong, ZHANG Pin-ming, FANG Zheng.Coupling microcalorimeter with electrchemical instruments for thermoelectrochemical research[J]. Thermochimica Acta, 1997,303: 11−15.
[9]Boudeville P, Tallec A. Electrochemistry and calorimetry IV:Determination of electrochemical Peltier heat[J]. Thermochim Acta, 1988, 126(15): 221−234.
[10]WANG Hui-xiang, WANG Dian-zuo, LI Bai-dan, et al.Improved methods to determine the electrochemical Peltier heat using a thermistor(1): Improved heat-sensor electrodes and lumped-heat-capacity analysis[J]. J Electronal Chem, 1995,392(1):13−19.
[11]JIANG Zhi-yu, ZHANG Jie, DONG Liang-jun, et al Determination of the entropy chang of the electrode reaction by an AC electrochemical-thermal method[J]. J Electroanal Chem,1999, 469(1): 1−10.
[12]YU Hua-guang, Liu Yi, TAN Zhi-cheng, et al. A solution reaction isoperibol calorimeter and standard molar enthpies of formation of Ln(hp)2Ac (Ln=La,pr)[J]. Thermochim Acta, 2003,401(15): 217−224.
[13]FANG Zheng, WANG Shao-fen, ZHANG Zheng-hua, et al. The electrochemical Peltier heat of the standard hydrogen electrode reaction[J]. Thermochimica Acta, 2008, 473(1/2): 40−44.
[14]FANG Zheng, ZHANG Quan-ru, ZHANG Heng-zhong.Thermoelectrochemisty and its application to metallurgical research[J]. J Mater Sci Technol, 2001, 17(1): 20−24.
[15]Dean J A. LANGE’S handbook of chemistry thirteenth edition[M]. New York:McGraw-Hill Book Company, 1985:1481−1482.
[16]黄子卿. 电解质溶液理论导论[M]. 北京: 科学出版社 1983:53−54.HUANG Zi-qing. Introduction to theory of electrolyte solution[M]. Beijing: Science Press, 1983: 53−54.
(编辑 张曾荣)
Electrochemical Peltier heats of anodic process for Fe(CN/Fe(CNsystem
YANG Zhong-fa1, FANG Zheng1, WANG Shao-fen2, ZHANG Zheng-hua1
(1. School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China;2. School of Chemistry and Biology Engineering, Changsha University of Science and Technology, Changsha 410077, China)
The thermo-electrochemical technique was applied to study the electrochemical Peltier heat of electrode reaction. In this experiment, a precision system for thermo-electrochemical measurements with controlled temperature of±0.001 K was set up, which consists of SRC−100 solution isoperibol calorimeter and an electrochemical workstation. A thermo-sensitive resistor was directly attached to the surface of working electrode to measure the change in potential signal due to temperature change of electrode. The curves of the electrode potential and temperature change against time for equal molar ratio of Fe(CN)63−/Fe(CN)64−couple with 5 sets of different concentrations were obtained under the condition of various constant-current polarizations. Using the thermo-electrochemical method for data-processing, the electrochemical Peltier heat of anodic process of Fe(CN)63−/Fe(CN)64−couple under various concentrations at 298.15 K are determined as 41.51 kJ/mol (0.075 mol/L), 43.48 kJ/mol (0.10 mol/L),46.95 kJ/mol(0.15 mol/L),50.77 kJ/mol(0.20 mol/L)and 54.81 kJ/mol(0.25 mol/L),respectively. The entropy change derived from these Peltier heat for the standard hydrogen electrode on absolute scale at this temperature is also given.
thermo-electrochemistry; Peltier heat; standard hydrogen electrode; Fe(CN)63−/Fe(CN)64−system
O642.3;O646
A
1672−7207(2011)02−0312−05
2009−12−07;
2010−03−05
国家自然科学基金资助项目(50874119)
方正(1944−),男,安徽桐城人,教授,博士生导师,从事冶金热力学、热电化学等研究;电话:0731-88660356;E-mail:zfang@csu.edu.cn

