一株Cr(Ⅵ)还原菌的鉴定及其还原特性
柴立元,曾娟,苏艳蓉,杨志辉,杨卫春
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
一株Cr(Ⅵ)还原菌的鉴定及其还原特性
柴立元,曾娟,苏艳蓉,杨志辉,杨卫春
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
从长沙铬盐厂区的被污染土壤中分离获得一株具高效还原高浓度 Cr(Ⅵ)的细菌,利用 PCR扩增获得该菌16S rDNA部分序列,经测序和比对确定菌株为Pannonibactersp.。研究该菌株的生理特性、培养条件以及还原六价铬的最佳条件。研究结果表明,该菌为革兰氏阴性菌,显微镜下观察为短杆状,好氧;该菌在pH为9,温度为30 ℃时生长最好;pH为8,30 ℃时六价铬还原效果最佳;16 h内可将质量浓度为300 mg/L的Cr(Ⅵ)还原90%以上。
微生物;六价铬;还原;16S rDNA
铬污染的处理被认为是世界性难题,但采用微生物治理铬污染潜力巨大。目前,国内外对微生物还原Cr(Ⅵ)进行了很多研究。如 Flavio等[1]将Bacillussp.ES29菌体细胞和胞内提取物应用于生物反应器,取得较好的铬还原效果。Wang等[2]对Enterobacter cloacae菌的还原特性和还原酶进行了研究,发现该菌的铬还原酶位于菌质膜上,还原铬需氧气。可还原Cr(Ⅵ)的细菌种属多样,例如:无色杆菌Achromobactersp.CH-1[3−5]、芽孢杆菌Bacillus sphaericus[1]、脱硫弧菌Desulfovibrio vulgaris[6]、肠杆菌Enterobacter cloacae[2]、假单胞菌Pseudomonas aeruginosa[7]和微球菌等。本文作者从长沙铬盐厂区的被污染土壤中分离获得一株能还原Cr(Ⅵ)的细菌,经分子生物学鉴定后确定该细菌的属级分类,并研究该菌的生理学特征和还原Cr(Ⅵ)能力,确定该菌最佳的生长和还原 Cr(Ⅵ)的条件。
1 材料与方法
1.1 菌种
1号菌种为从铬污染土壤中分离获得的一株菌种,能高效还原高浓度Cr (Ⅵ)细菌,其形态特征和生理生化现象与现有文献报道的菌种不同,命名为P。
2 号菌种为Achromobactersp.CH-1[3−4],是从长沙铬盐厂铬渣堆场分离得到的一株细菌,能耐受六价铬并能还原六价铬质量浓度为1.5 g/L。
3号菌种为E.coliK12,系上海生物工程公司提供的一株对六价铬无耐受和还原能力的细菌。
1.2 培养基
筛选菌株用培养基 1[8]:蛋白胨质量浓度为 10 g/L,硫酸镁(MgSO4·7H2O)为 2 g/L,亚硫酸钠为 0.5 g/L,硫酸亚铁(FeSO4·7H2O)为 0.5 g/L,乳酸为 0.4 g/L,硫代乙醇酸钠为0.5 g/L。
筛选菌株用培养基2[9]:氯化钠质量浓度为2 g/L,硫酸镁(MgSO4·7H2O)为0.6 g/L,醋酸钠为2 g/L,碳酸钙为3 g/L。
筛选菌株用培养基3[10]:蛋白胨质量浓度为1 g/L,氯化钠为 1 g/L,酵母浸膏为 0.5 g/L,葡萄糖为0.01 g/L。
筛选菌株用培养基 4[11]:氯化铵质量浓度为 1.0 g/L,硫酸镁(MgSO4·7H2O)为 0.2 g/L,硫酸亚铁(FeSO4·7H2O)为 0.001 g/L,二水合氯化钙为 0.001 g/L,醋酸钠为5 g/L,酵母浸膏为0.5 g/L,磷酸氢二钾为0.5 g/L。
筛选菌株用培养基5[12]:蛋白胨质量浓度为5 g/L,酵母浸膏为2.5 g/L,氯化钠为2.5 g/L,一水合葡萄糖为0.5 g/L。
筛选菌株用培养基 6[13]:蛋白胨质量浓度为 10 g/L,硫酸镁(MgSO4·7H2O)为 2 g/L,硫酸亚铁(FeSO4·7H2O)为0.5 g/L,硫酸钠为0.5 g/L,乳酸钠为6 mL,维生素C为7.5 g/L,琉基乙酸钠为7.5 g/L。
筛选菌株用培养基7[14]:乳酸钠质量浓度为4 g/L,酵母浸膏为4 g/L,氯化钠为2 g/L。
筛选菌株用培养基8:酒石酸钠质量浓度为3 g/L,酵母浸膏为4 g/L,氯化钠为2 g/L。
筛选菌株用培养基 9:柠檬酸三钠质量浓度为 3 g/L,酵母浸膏为4 g/L,氯化钠为2 g/L。
筛选菌株用培养基10:乙酸钠质量浓度为3 g/L,酵母浸膏为4 g/L,氯化钠为2 g/L。
筛选菌株用培养基11:乳糖质量浓度为3 g/L,酵母浸膏为4 g/L,氯化钠为2 g/L。
筛选菌株用培养基12:乙酸铵质量浓度为3 g/L,酵母浸膏为4 g/L,氯化钠为2 g/L。
筛选菌株用培养基13:乙醇铵质量浓度为3 g/L,酵母浸膏为4 g/L,氯化钠为2 g/L。
筛选菌株用培养基14:乳酸质量浓度为3 g/L,酵母浸膏为4 g/L,氯化钠为2 g/L。
对上述 14种培养基,分别加入重铬酸钾至一定Cr(Ⅵ)质量浓度,并添加质量分数为1.5%的琼脂,配置成固体筛选平板。
1.3 细菌培养和驯化
将菌株以 2%的接种量接种于含一定 Cr(Ⅵ)的培养基中,以120 r/min转速搅拌,于30 ℃恒温培养至稳定期后传代。细菌浓度用600 nm处吸光度表示[12],Cr(Ⅵ)质量浓度采用二苯碳酸二肼分光光度法进行分析[14]。
1.4 不同初始pH、温度及溶解氧条件下的菌珠培养
以2%接种量将菌株接种于Cr(Ⅵ)质量浓度为300 mg/L,pH 分别为7,8,9,10和11的选定培养基中,转速为120 r/min,于30 ℃恒温培养10 h,检测细菌浓度和剩余Cr(Ⅵ)质量浓度。
以2%接种量将菌株接种于Cr(Ⅵ)质量浓度为300 mg/L,pH 为 8的培养基中,于 25,30,40,50和65 ℃,在转速为120 r/min时,分别培养10 h,检测细菌浓度和剩余Cr(Ⅵ)质量浓度。
以 2%的接种量将菌株接种于 Cr(Ⅵ)的质量浓度为300 mg/L,pH为8的液体培养基中,分别在厌氧和好氧条件下,于30 ℃恒温振荡培养20 h,观察菌株生长情况,监测细菌质量浓度。
以上实验每个处理3次。
1.5 16S rDNA部分片段的PCR扩增、测序
1.5.1 菌落PCR扩增 16S rDNA
从固体平板上挑取少量单克隆菌落,用solutionⅡ[15]溶液(10% SDS 10ul,40% NaOH 2ul,一级无菌水 88ul)裂解菌体,裂解液稀释后作为模板,引物为细菌 16S rDNA聚合酶链式反应(PCR)通用引物[10](27F,1492R),使用TIANGEN公司生产的 Taq mix进行扩增。
PCR系统为:10×Taq聚合酶缓冲液5 μL,MgCl2(25 mmol) 4 μL,dNTP(5mmol) 3 μL,引物 1 μL,模板 DNA 3 μL,Taq酶(10000U/ml) 0.5 μL,重蒸水33.5 μL。
PCR程序为:于95 ℃变性5 min,于94 ℃退火1 min,53 ℃退火 30 s,于 72 ℃延伸 90 s,循环 30 次;于72 ℃保温10 min;于4 ℃ 保存。
1.5.2 序列分析
PCR产物的测序由上海生物工程有限公司完成。测序得到的菌株 16S rDNA部分片段的序列与NCBI(美国国立生物技术信息中心)中的核酸数据库序列进行Blast比对分析。
2 结果
2.1 菌株P形态、功能鉴定
在培养基上生长的菌株 P,菌落表面光滑,边缘整齐,中间微隆起。在含Cr(Ⅵ)的培养基上生长时,菌落呈蓝灰色,且菌落周围的培养基由亮黄色转为淡黄色。蓝灰色是Cr(OH)3的特征颜色,而培养基中除K2Cr2O7外,未添加其他金属离子,据此初步判断菌株P将亮黄色 Cr(Ⅵ)还原成蓝灰色Cr(OH)3。经革兰氏染色 ,菌株P为革兰氏阴性菌,短杆状。

图1 铬还原菌P菌落形态Fig.1 Colony shape of chromate-reducing bacterium P
2.2 菌株分子生物学鉴定
利用细菌16S rDNA 通用引物用PCR的方法扩增菌株P16S rDNA部分片段,PCR产物测序获得该片段序列,然后与NCBI的核酸数据库进行Blast序列比对,结果见表1。

表1 菌株P 16S rDNA序列比对结果Table 1 Analysis of partial 16S rDNA sequence of strain P
由表1可知:菌株P与Pannonibactersp.序列同源性达到 100%,据此可以确定菌株 P属于Pannonibacter.sp。目前还没有关于Pannonibacter属的细菌具有六价铬还原或六价铬耐受能力的报道。
2.3 菌株P Cr(Ⅵ)还原培养基的选择及驯化
参考国内外在研究耐Cr(Ⅵ)和还原 Cr(Ⅵ)细菌时使用的培养基,选用14种不同培养基,分别加入Cr(Ⅵ)终浓度为300 mg/L的重铬酸钾作为铬源,接种菌株P,并以课题组前期研究发现的六价铬还原细菌Achromobactersp.CH-1[3−4]作为正对照,E.coliK12 作为负对照,同时培养。接种后48 h,菌株P在筛选用培养基8上,生长速度较其他13种培养基的生长速度都快,且在该种培养基上生长时对Cr(Ⅵ)还原情况良好,使培养基由黄绿色变成蓝灰色,由此确定该培养基为最适宜培养基,并进行后续实验。正对照Achromobactersp.CH-1在筛选用培养基7上,其生长和Cr(Ⅵ)还原速度较其他培养基上快,使培养基由黄绿色变成蓝灰色,而负对照E.coliK12在各种含铬培养基上均不生长。经过在 Cr(Ⅵ)浓度不断递增的培养基中驯化,菌株 P能还原六价铬质量浓度达到900 mg/L。
2.4 初始pH值对细菌P的生长及Cr(Ⅵ)还原能力的影响
预试实验表明,菌株P在碱性环境生长情况明显优于酸性环境。因此选择初始pH为中性和碱性条件,检测细菌生长及其对六价铬的还原效果,结果见图2。

图2 不同初始pH值对菌株P生长及其Cr(Ⅵ)还原的影响Fig.2 Effect of initial pH value on growth and Cr(Ⅵ)reduction activity of bacterium P
从图2可以看出:当初始pH为7~9时,菌体吸光度随着pH升高而升高;当pH超过9时,菌体吸光度随 pH升高急剧下降;当初始 pH为 8 时,Cr(Ⅵ)的还原率最高,达60%以上;初始pH高于或低于8,菌株的六价铬还原能力都有所下降;当pH为10时,还原率仅为6.64%。而在pH<7的酸性环境下,菌株P可以生长,但 Cr(Ⅵ)基本未被还原。可见该细菌还原Cr(Ⅵ)的最适初始pH为8;生长的最适pH为9。目前报道的六价铬还原菌,大部分适合在中性pH条件下生长,如Eenterobactr[2]和Ochrobactrumsp.[16];少数以间接方式还原六价铬的化能自养菌在酸性条件下生长,如Thiobacillus ferrooxidans[17]和Shakoori等分离的铬还原菌CMB-Cr1 (ATCC 700729)[10]。像菌株P一样嗜碱性铬的还原菌不多见,菌株P是继本课题组分离得到CH-1之后的又一株Cr(Ⅵ)还原细菌。
2.5 温度对细菌P的生长及Cr(Ⅵ)还原能力的影响
利用初始pH8的培养基8,在不同温度下培养细菌P,检测温度对其生长及六价铬还原能力的影响,结果如图3所示。

图3 温度对菌株P生长及其Cr(Ⅵ)还原的影响Fig.3 Effect of temperature on growth and Cr(Ⅵ) reduction activity of bacterium P
图3表明:细菌P在温度为25~40 ℃生长情况良好,当温度高于50 ℃时,该细菌基本不能生长;菌株P的生长及其还原 Cr(Ⅵ)的能力均受温度的影响;细菌P在25~40 ℃之间对Cr(Ⅵ)具有一定的还原率;30℃时,Cr(Ⅵ)还原率最高,达80%以上;温度高于50 ℃,菌株几乎不能还原六价铬。目前报道的六价铬还原菌绝大多数属于中温菌,还原的最佳温度为30~35 ℃[4,16−17]。菌株 P 生长和还原 Cr(Ⅵ)的最适温度均为30 ℃,也属于中温菌。
2.6 溶解氧对细菌P生长的影响
目前所分离的铬还原菌中,好氧、厌氧及兼性菌均有报道[12,18]。对细菌P,在厌氧和好氧条件下,于30 ℃培养20 h,发现它在厌氧条件下不能生长,结果如图4所示。因此 菌株P为好氧细菌。
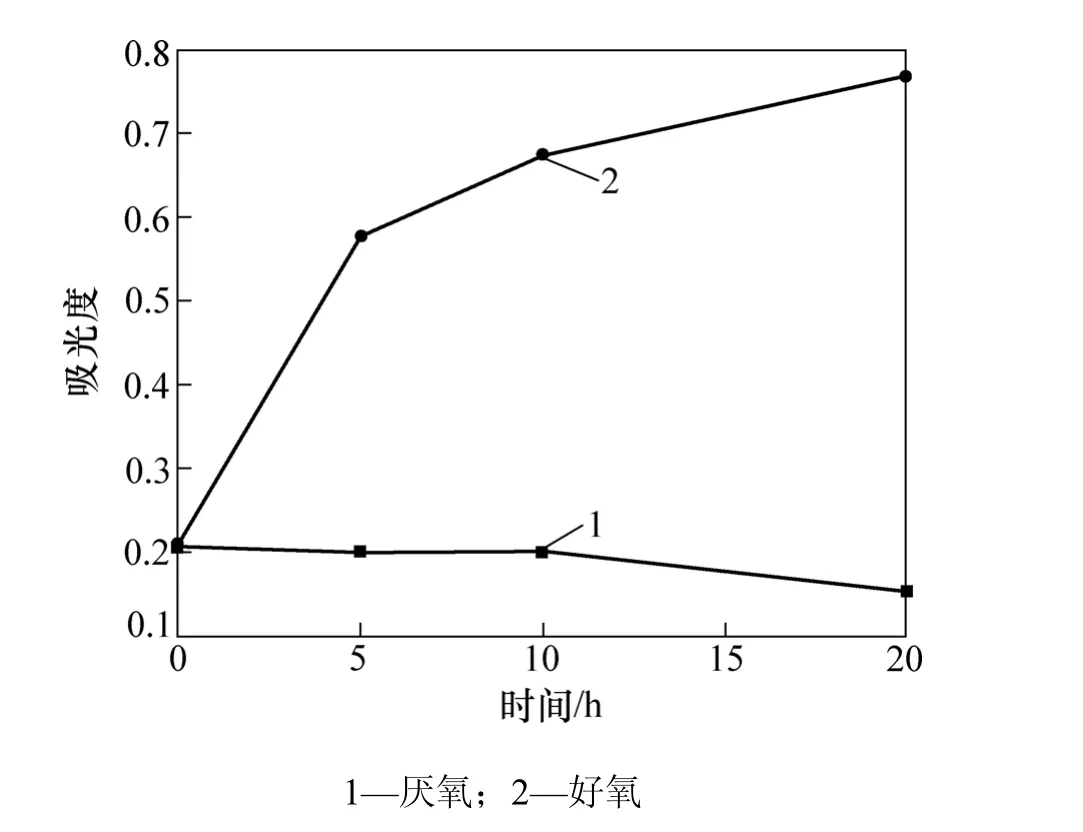
图4 菌株P在厌氧和好氧条件下的生长情况Fig.4 Growth of strain P in anaerobic and aerobic condition
2.7 细菌P的生长曲线及其六价铬的还原曲线
在最适六价铬还原条件下培养菌株 P,检测其六价铬还原与生长之间的关系。图5所示为菌株P的生长与六价铬还原随时间的变化规律。

图5 菌株P生长曲线与其生长过程中的Cr(Ⅵ)还原率Fig.5 Growth curves of strain P and corresponding Cr(Ⅵ)reduction activity
六价铬的还原过程基本与菌株的生长过程相耦合,在前8 h的生长延滞期,细菌对Cr(Ⅵ)的还原速度非常缓慢,还原率<5%;进入对数生长期时,六价铬的还原速度明显加快;16 h后,Cr(Ⅵ)还原率>90%。当细菌生长进入稳定期时,Cr(Ⅵ)的去除率达 95%以上。可见:细菌P在其初级代谢阶段已完成对Cr(Ⅵ)的还原。
3 结论
(1) 从铬渣堆场分离得到具有六价铬还原能力的细菌属于Pannonibacter.sp,在含Cr(Ⅵ)固体培养基上生长菌落呈蓝灰色,显示其六价铬还原能力命名为P。
(2)Pannonibacter.sp P在16 h内能还原90%的300 mg/L Cr(Ⅵ)。
(3) 菌株 P在 25~40 ℃生长良好并具有较高的Cr(Ⅵ)还原效率,30 ℃时还原Cr(Ⅵ)的效果最佳。
(4) 菌株P于30 ℃,pH为7~9时均能还原Cr(Ⅵ),当pH为8时,还原能力最佳。对比国内外已发现的铬还原菌,还原六价铬质量浓度达300 mg/L的菌株较少。本研究发现菌株P的生长温度和pH条件适中,将该菌应用于治理碱性含Cr(Ⅵ)废水和开发铬渣的生物治理技术具有很大的潜力。
[1]Flavio A O C, Benedict C O, Fatima M B, et al. Hexavalent chromium reduction by immobilized cells and the cell-free extract ofBacillussp. ES 29[J]. Bioremediation Journal, 2004,8(1): 23−30.
[2]Wang P C, Tsukasa M, Kiyoshi T, et al. Membrane-associated chromate reductase activity fromEnterobacter cloacae[J]. J Bacteriol, 1990, 172(3): 1670−1672.
[3]Michael A I, Kafui N, Nosa O E. The leaching of chromium from cement-based waste form via a predominantly biological mechanism[J]. Advances in Environmental Research, 2004, 8(3):483−491.
[4]MA Ze-min, ZHU Wen-jie, LONG Huai-zhong, et al. Chromate reduction by resting cells ofAchromobactersp. Ch-1 under aerobic conditions[J]. Process Biochem, 2007, 42(6):1028−1032.
[5]ZHU Wen-jie, YANG Zhi-hui, MA Ze-min, et al. Reduction of high concentrations of chromate byAchromobactersp. CRB1 isolated from Changsha, China[J]. World Journal of Microbiology and Biotechnology, 2008, 24(7): 991−996.
[6]Humphries A C, Macaskie L E. Reduction of Cr(Ⅵ) byDesulfovibrio vulgarisandMicrobacteriumsp.[J].Biotechnology Letters, 2002, 24(15): 1261−1267.
[7]Canguli A, Tripathi A K. Bioremediation of toxic chromium from electroplating effluent by chromate-reducingPseudomonas aeruginosaA2Chr in two bioreactors[J]. Appl Mcrobiol Biotechnol, 2002, 58(3): 416−420.
[8]申如香, 瞿建国, 张晓旗, 等.微生物法处理冷轧含铬(Ⅵ)废水的试验研究[J]. 上海化工, 2001(1): 4−7.SHEN Ru-xiang, QU Jian-guo, ZHANG Xiao-qi, et al.Experimental study on microbial treatment of wastewater containing chromium(Ⅵ) from cold rolling[J]. Shanghai Chemistry Indurstry, 2001(1): 4−7.
[9]Fujii E, Toda K, Ohtake H. Bacterial reduction of toxic hexavalent chromium using a fed-batch culture ofEnterobacter cloacaestrain HO1[J]. Fermentation and Bioengineering, 1990,60(5): 365−367.
[10]Shakoori A R, Makhdoom M, Haq R U. Hexavalent chromium reduction by a dichromate-resistant gram-positive bacterium isolated from effluents of tanneries[J]. Appl Microbiol Biotechnol 2000, 53(3): 348−351.
[11]Radar U, Ahmed N, Beswick A J, et al. Reduction of chromate by microorganisms isolated from metal contaminated sites of Karachi[J]. Pakistan Biotechnology Letters, 2000, 22(10):829−836.
[12]Carlo V, Luciana G N. Characterization of cultivable heterotrophic bacterial communities in Cr-polluted and unpolluted soils using Biology and ARDRA approaches[J]. Appl Soil Ecol, 2004, 5: 1−12.
[13]赵晓红, 张敏, 李福德. SRV菌去除电镀废水中铜的研究[J].中国环境科学, 1996, 16(4): 288−292.
ZHAO Xiao-hong, ZHANG Min, LI Fu-de. Research of copper removal from electroplating wastewater by SRV bacteria[J].China Enviromental Science, 1996, 16(4): 288−292.
[14]Michael A I, Kafui N, Nosa O E. The leaching of chromium from cement-based waste form via a predominantly biological mechanism[J]. Advances in Environmental Research, 2004, 8:483−491.
[15]Ausubel F M, Brent R, Kingston R E, 等. 精编分子生物学实验指南[M]. 4版. 马学军, 舒跃龙, 颜子颖, 等译. 北京: 科学出版社, 2005: 658−661.
Ausubel F M, Brent R, Kingston R E, et al. Short Protocols in Molecular Biology[M]. 4th ed. MA Xue-jun, SHU Yiao-long,YAN Zi-ying, et al, trans. Beijing: Science Press, 2005:658−661.
[16]Urvashi T, Datta M. Reduction of toxic chromium and partial localization of chromium reductase activity in bacterial isolate DM1[J]. World J Microb Biot, 2005, 21(6/7): 891−899.
[17]QuiIntana M, Curutchet G, Donati E. Factors affecting chromium(Ⅵ) byThiobacillusferrooxidans[J]. Biochem Eng J,2001, 9(1): 11−15.
[18]朱文杰.Achromobactersp.CRB1菌还原铬(Ⅵ)的机理及其在铬渣解毒中的应用[D]. 长沙: 中南大学冶金科学与工程学院,2007: 40−48.
ZHU Wen-jie. Mechanism of Cr(Ⅵ) Reduction withAchromobactersp.CRB1 and its application in detoxification of chromite or processing residue[D]. Changsha: Central South University. School of Metallurgical Science and Engineering,2007: 40−48.
(编辑 张曾荣)
Identification and characteristics of a Cr (Ⅵ) reducing strainPannonibactersp. P
CHAI Li-yuan, ZENG Juan, SU Yan-rong, YANG Zhi-hui, YANG Wei-chun
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
One bacterium which can reduce high concentration of Cr(Ⅵ) was isolated from the soil seriously contaminated by chromium-containing slag in Changsha chromate factory. The bacterium was Gram-negative and short rod when observed using a microscope. The partial 16S rDNA sequence indicats that this strain isPannonibacte sp, and is an aerobic bacterium with the optimal growth at pH 8 under 30 ℃ and the optimal Cr(Ⅵ) reduction at pH 9.0 under 30℃. Under the optimal conditions, more than 90% of 300 mg / L Cr (Ⅵ) is reduced by strain P in 16 h.
bacterium; hexavalent chromium; reduction; 16S rDNA
Q89;X703
A
1672−7207(2011)02−0300−05
2009−12−11;
2010−03−06
国家水体污染控制与治理科技重大专项(2009ZX07212-001-01);国家杰出青年科学基金资助项目(50925417);国家自然科学基金重点资助项目(50830301)
杨卫春(1982−),女,湖南湘乡人,博士,从事废水废渣治理研究;电话:0731-88830875;E-mail:yang220222000@yahoo.com.cn

