VEGF对兔骨髓细胞分化形成破骨细胞的诱导作用
孙 华,宋开茂,王 敏,王小琼
(1.解放军兰州军区疗养院第二疗养区口腔科,陕西西安 710600;
2.解放军273医院口腔科,新疆 库尔勒841000
3.西安建筑科技大学医院口腔科,陕西西安 710055)
VEGF对兔骨髓细胞分化形成破骨细胞的诱导作用
孙 华1,宋开茂2,王 敏1,王小琼3
(1.解放军兰州军区疗养院第二疗养区口腔科,陕西西安 710600;
2.解放军273医院口腔科,新疆 库尔勒841000
3.西安建筑科技大学医院口腔科,陕西西安 710055)
目的:观察血管内皮生长因子(VEGF)对兔骨髓细胞分化为破骨细胞的诱导作用。方法:应用终未浓度为5 ng/mL的人重组rhVEGF体外诱导培养兔骨髓细胞,并与骨片共同培养,分别于诱导培养后3、6、9d用抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色进行破骨细胞鉴定计数和骨片吸收陷窝数目的统计。结果:诱导培养3d,实验组与对照组的破骨细胞数和骨吸收陷窝数无显著性差异(P>0.05),而随着诱导培养时间延长,实验组两者的数量明显增加,在诱导培养6d和9d时,均明显高于对照组,差异有统计学意义(P<0.05)。结论:VEGF具有体外诱导骨髓细胞形成破骨细胞的作用。
人重组血管内皮生长因子;兔;破骨细胞
[牙体牙髓牙周病学杂志,2011,21(1):11]
[Chinese Journal of Conservativedentistry,2011,21(1):11]
血管内皮生长因子(vascular endothelialgrowth factor,VEGF)是主要的血管形成因子,又是骨生长因子,与骨代谢关系密切。VEGF是近年来研究较多的细胞因子,其在骨代谢过程中协调着骨细胞的消长、细胞外基质的改建及骨形成、骨吸收间的关系[1-3]。然而至今,VEGF对破骨细胞形成及功能的作用未见报道。本实验通过体外诱导形成破骨细胞进一步了解VEGF的作用。
1 材料和方法
1.1 主要材料和设备
新生兔(第四军医大学实验动物中心)。
α-MEM培养基(Gibco,美国);胎牛血清(浙江金华);rhVEGF(北京中杉 );甲苯胺蓝 (sigma公司);Leica 1600硬组织切片机(徕卡仪器有限公司,瑞士);YMT-Z倒置显微镜(Olympus,日本)。
1.2 方法
1.2.1 骨磨片的制备
取新鲜小牛皮质骨,手锯修成1.4 cm×1.4 cm大小,用100目砂纸打磨光滑后,在Leica硬组织切片机上切成30 μm厚度的薄片,梯度乙醇脱水,超声水浴清洗10 min×3次,自然干燥,铅笔标记正反面后,放入24孔板中,γ-射线照射消毒后备用。将1.0 cm×1.0 cm大小的细胞爬片(盖玻片)超声震荡洗涤后浸入硫酸-重铬酸钾清洁液中过夜,充分水洗擦干,高压灭菌,放入24孔板中备用。
1.2.2 兔骨髓破骨细胞诱导培养
新生兔断颈处死后,置于750 mL/L的乙醇溶液中浸泡5 min,无菌条件下分离股骨、胫骨。超净工作台内剪断长骨两骺端,暴露骨髓腔,用10 mL一次性注射器抽取含100 mL/L胎牛血清的α-MEM培养液冲洗骨髓腔。收集全部冲洗液,筛网滤过,1 000 r/min离心弃部分上清液,吹打均匀,重悬于含100 mL/L胎牛血清的α-MEM培养液中,光镜下调整单核细胞密度为1.5×107/mL。将细胞悬液分别接种于放置有细胞爬片以及骨片的24孔培养板(每孔 0.5 mL),在 37℃、50 mL/L CO2、饱和湿度下培养2 h,半量换液。第3天,弃原培养液,分别将置有骨片和细胞爬片的培养孔各随机分为实验组和对照组,每组18孔。实验组加入含 rhVEGF终未浓度为 5 ng/mL、胎牛血清100 mL/L的α-MEM培养液;对照组加入不含rh-VEGF的 α-MEM培养液(含100 mL/L胎牛血清),继续培养,共培养9d,每48 h换液1次,并始终维持实验组rhVEGF浓度不变。
1.2.3 抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色
分别于诱导培养第3、6、9天,实验组、对照组各取出6张细胞爬片,PBS冲洗后,用25 mL/L戊二醛4℃固定30 min,放入孵育液内(0.1 mol/L醋酸缓冲液18 mL,六偶氮副品红1 mL,萘酚AS-BI磷酸盐20 mg,酒石酸钾钠50 mmol),37℃孵育30 min,取出细胞爬片,蒸馏水冲洗,中性树胶封片,倒置显微镜观察。TRAP染色阳性的多核细胞(2个或2个以上核)为破骨细胞并进行计数和照像。
1.2.4 各组骨片上的吸收陷窝观察
分别于诱导培养第3、6、9天,实验组、对照组各取出6枚骨片,25 mL/L戊二醛固定30 min,1g/L甲苯胺蓝硼酸盐溶液染色2 min。然后置于0.25 mol/L的氨水中超声振荡2 min以去除附着的细胞,再用上述染液复染5 min,丙酮脱水,室温干燥,光镜下观察并进行吸收陷窝计数和照像。
1.3 统计学分析
采用SPSS10.0统计学软件对数据进行方差分析,两两比较用q检验,检验水准α=0.05。
2 结果
2.1 体外诱导培养后破骨细胞形成情况
TRAP染色后,倒置显微镜下可见破骨细胞胞浆呈酒红色阳性染色,多核,主要位于细胞中央且未染色,类似于煎蛋样(图1),实验组诱导培养第3天,破骨细胞数与对照组无显著性差异(P>0.05)。诱导培养第5天,镜下可见相邻单核细胞胞突起融合现象,可见少量多核细胞开始形成。诱导培养第6天以后,多核细胞大量出现。细胞形态呈圆形、多角形或规则形,边缘不整齐,突起较多,胞体较大,核数目2或2以上不等。实验组破骨细胞数在第6天和第9天两个时间点均明显多于对照组(P<0.05),组内相比第6天和第9天相比无显著性差异(P>0.05),但均明显高于第3天(P<0.05)。对照组随着培养的进行,破骨细胞数量并未增加,而后期逐渐减少(表1)。
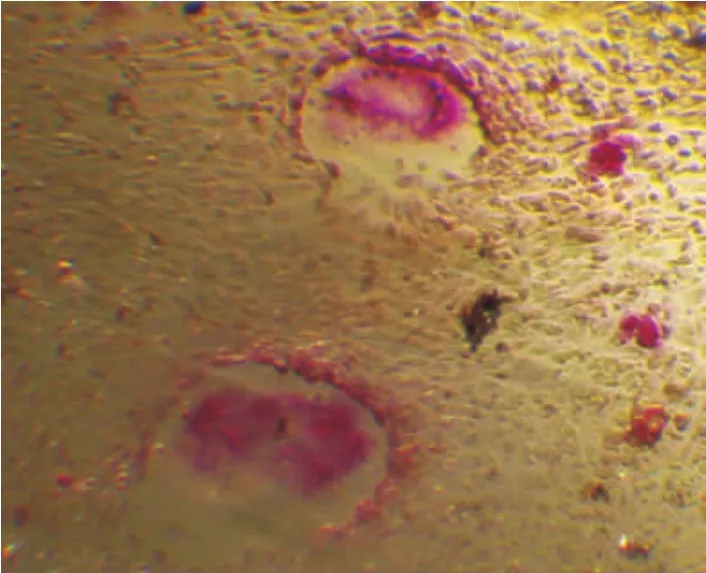
图1 破骨细胞TRAP染色阳性,细胞呈油煎鸡蛋样,胞浆酒红色(200×)
2.2 骨片共同培养时吸收陷窝出现情况
破骨细胞及其吸收骨质后所形成的骨吸收陷窝经甲苯胺蓝染色后呈深蓝色,直径大小不一,多为单个圆形或椭圆形,少数为不规则形,边界不整齐(图2)。诱导培养3d时,实验组和对照组骨吸收陷窝数无显著差异(P>0.05),随着诱导培养时间延长,实验组骨吸收陷窝数逐渐增多,在6d和9d两时间均明显高于对照组(P<0.05),但组内相比,6d和9d无显著性差异(P>0.05)。对照组随培养时间延长,骨吸收陷窝数无明显增加(表1)。
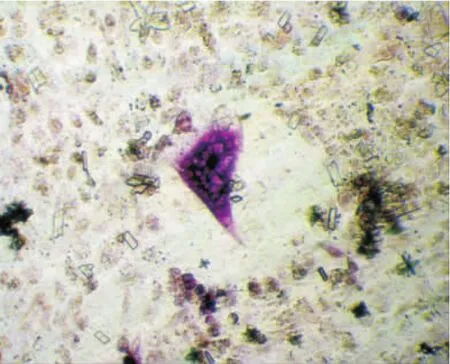
图2 破骨细胞及骨吸收陷窝经甲苯胺蓝染色后呈深蓝色(200×)
表1 rhVEGF诱导培养后破骨细胞和骨吸收陷窝形成情况(n=6,±s)

表1 rhVEGF诱导培养后破骨细胞和骨吸收陷窝形成情况(n=6,±s)
*相同时间点实验组与对照组相比P<0.05;不同字母为各组不同时间点相比P <0.05
培养时间(d)破骨细胞数 骨吸收陷窝数对照组 实验组3 8.79 ±2.86A 8.56 ±2.79A 2.05 ±0.15A 2.15 ±0.07对照组 实验组A 6 10.92 ±3.18A 18.16 ±3.05*B 2.71 ±0.82A 6.64 ±1.82*B 9 8.85 ±0.17A 21.24 ±3.88*B 2.34 ±0.13A 7.15 ±2.03*B
3 讨论
破骨细胞是骨组织中的多核巨细胞,其来源于造血干细胞中的粒细胞-巨噬细胞集落(GMCFU)形成单位。在适宜的刺激下,干细胞(stem cell)分化成具有破骨细胞表型的单核细胞(monocyte),进而融合为成熟的多核破骨细胞,参与骨吸收过程[1]。
近年来研究发现,血管内皮生长因子(VEGF)在骨代谢过程中具有协调骨细胞的消长、细胞外基质的改建、骨形成和骨吸收等作用。体外在破骨细胞培养中加入VEGF后,破骨细胞的数量增多、功能增强。Qian Zhang等[2]研究证实VEGF可促进破骨细胞分化、成熟,维持骨髓功能,且达到类似于巨噬细胞集落刺激因子(M-CSF)起的作用。有学者将人重组血管内皮生长因子(rhVEGF)局部注射于正畸牙周围牙龈,发现注射组比对照组牙周破骨细胞计数明显增多,且破骨细胞数目与注射rhVEGF的剂量成正比。之后,其又进行anti-VEGF多克隆抗体的实验,将anti-VEGF注射于正畸牙周围牙龈,发现牙周破骨细胞计数明显减少,牙的移动和复发受到抑制,从反面证实了VEGF的作用[3]。
为进一步探讨VEGF对破骨细胞及功能的影响,本实验采用rhVEGF体外诱导培养骨髓基质细胞,观察其促进破骨细胞形成和功能的作用。结果显示,在培养液中加入5 ng/mL浓度的rhVEGF,破骨细胞的数量明显增多且骨吸收功能增强。分析原因可能是:骨髓单个核细胞主要为单核细胞和巨噬细胞,而破骨细胞及其前体细胞膜上具有VEGF受体(VEGFR1和VEGFR2),加入VEGF后,VEGF与VEGFR1结合使局部黏附激酶(FAK)中的酪氨酸磷酸化,激活破骨细胞的胞外基质.整和素FAK的信号传导通道,促进其不断增殖,趋化,并募集前体细胞,最终融合形成破骨细胞[4-5]。另一方面,VEGF还可诱导骨髓基质细胞向破骨细胞分化。在实验初期可观察到少量破骨细胞,随着诱导培养时间延长,到第6天时破骨细胞大量增多,与骨片共同培养所形成的骨吸陷窝数亦相应的增加。也证实VEGF的诱导作用。
[1]Patrick Ross F,Angela MC.Nothing but skin and bone[J].J Clin Invest,2006,15:116.
[2]Zhang Q,Guo R.VEGF-C.a lymphaticgrowth factor,is a RANKL targetgene in osteoclasts that enhances osteoclastic bone resorption through an autocrine mechanism[J].J Biolog Chem,2008,283:13491-13499.
[3]Kohno S,Kaku M,Kawata T,et al.Neutralizing effects of an anti-vascular endothelialgrowth factor antibody on tooth movement[J].Angle Orthod,2005,75(5):797 -804.
[4]Aldridge SE,Lennard TWJ,Williams JR,et al.Vascular endothelialgrowth factor receptors in osteoclastdifferentiation and function[J].Biochem Biophys Rese Commun,2005,335(3):793-798.
[5]Mayer H,Bertram H,Lindenmaier W,et al.Vascular endothelialgrowth factor(VEGF-A)expression in human mesenchymal stem cells:autocrine and paracrine role on osteoblastic and endothelialdifferentiation[J].J Cell Biochem,2005,95(4):827-839.
Effect of VEGF on osteoclasts formation from bone marrow cells in rabbit
SUN Hua*,SONG Kai-mao,WANG Min,WANG Xiao-qiong
(*Department of Stomatology,Lin Tong Sanatorium of Lanzhou Military Region,Xi'an 710600,China)
AIM:To observe the inducing effect of recombinant human vascular endothelialgrowth factor(rhVEGF)on osteoclastsdifferentiation from rabbit bone marrow cells.METHODS:Rabbit bone marrow cells were harvested and cultured in the presence or absence of 5ng/mL rhVEGF.Onday 3,6 and 9,the cells were stained with tartrate-resistant acid phosphatase(TRAP)and bone absorption lacunas were counted.RESULTS:Onday 3 after rh-VEGF induction,nodifference was found in the number of TRAP-positive cells and absorption lacunas(P >0.05).However,the number of TRAP-positive cells and absorption lacuna were significantly increased onday 6 andday 9 post-rhVEGF induction.CONCLUSION:VEGF can induce osteoclastsdifferentiation in vitro.
rhVEGF;rabbit;osteoclast
R780.2
A
1005-2593(2011)01-0011-03
2010-03-17;
2010-07-09
孙华(1974-),女,汉族,陕西人。硕士,主治医师

