TNF-α对小鼠脑微血管内皮细胞RhoA活性的影响*
邓小鹿, 彭 镜, 何 芳, 杨丽芬, 吴丽文, 尹 飞
(中南大学湘雅医院儿科,湖南长沙410008)
肿瘤坏死因子 α(tumor necrosis factor α,TNF - α)主要由单核细胞和巨细胞产生,在介导中枢神经系统感染的炎症过程中起着重要作用。本实验室前期研究证实,感染性脑水肿大鼠脑组织的TNF-α含量明显增高,与脑水肿的严重程度呈正相关[1];Rho激酶抑制剂Y-27632可以减轻TNF-α导致的脑微血管内皮细胞通透性增高[2]。同时,已有研究显示RhoA/Rho激酶信号通路是调控内皮细胞屏障功能的重要环节,其中RhoA的活性由Rho鸟嘌呤核苷酸交换因子(Rho guanine nucleotide exchange factors, RhoGEFs)催 化。p115RhoGEF是第一个被发现联系G蛋白偶联受体和Rho家族的RhoGEFs,介导多种刺激因素如凝血酶、溶血凝脂酸、血栓素-2对RhoA的活化[3]。因此,我们认为p115RhoGEF可能也参与了TNF-α对RhoA的调控,而目前未见相关文献报道。本研究检测了TNF-α刺激小鼠脑微血管内皮细胞不同时点RhoA活性和蛋白表达水平,并通过siRNA抑制p115RhoGEF表达,探讨其在TNF-α对RhoA活性调控中的作用。
材料和方法
1 材料
小鼠脑微血管内皮细胞株bEnd.3由美国芝加哥大学章坚教授馈赠,RhoA活性检测试剂盒购自Cytoskeleton,DMEM高糖培养基购自Thermo,胎牛血清(fetal bovine serum,FBS)购自杭州四季青公司,重组人TNF-α购自Sigma,兔抗RhoA单克隆抗体购自CST,山羊抗p115RhoGEF多克隆抗体和HRP标记的羊抗兔IgG购自Santa Cruz,p115RhoGEF siRNA由上海吉凯基因技术有限公司合成。其余生化试剂为国产分析纯试剂或进口分装。
2 方法
2.1 细胞培养 应用 DMEM(含 10%FBS)培养液,在37℃、5%CO2培养箱条件下培养bEnd.3细胞,每3 d按1∶2的比例传代,每日于倒置相差显微镜下观察细胞形态与生长状态,1-2 d更换1次培养液。
2.2 siRNA转染 参考文献[4]合成p115RhoGEF siRNA。合成引物序列如下:正义链5'-CAUACCAUCUCUACCGACGtt-3';反义链5'-CGUCGGUAGAGAUGGUAUGtt-3'。采用 Invitrogen公司的Lipofectamine 2000将p115RhoGEF siRNA转染bEnd.3细胞,无活性的nsRNA作为对照。转染72 h后,利用Western blotting验证siRNA抑制p115RhoGEF蛋白合成的效果。
2.3 RhoA活性和表达分析及分组 将bEnd.3细胞分为正常对照组和TNF-α刺激组。去血清培养24 h,加入TNF-α(10 μg/L)刺激,在 10、30、60 min 利用 pull- down 法检测RhoA活性,得到TNF-α作用与RhoA活化的时效关系。取RhoA活化最明显的时点,bEnd.3细胞转染p115RhoGEF siRNA和nsRNA,检测TNF-α刺激后RhoA的活性变化。Pull-down法操作步骤依照Cytoskeleton提供的RhoA活性测定试剂盒说明书进行。Western blotting检测RhoA-GTP的表达,RhoA-GTP/总RhoA的比值代表RhoA活性。
将bEnd.3细胞分为正常对照组和TNF-α刺激组。去血清培养24h,分为1、3、6、12、24 h 组,加入 TNF - α(10 μg/L)进行预处理后收集各组总蛋白,Western blotting检测RhoA蛋白表达变化。
2.4 Western blotting 每孔加样品总蛋白量30 μg行SDSPAGE电泳分离及转膜,Ⅰ抗工作效价为1∶500,ECL化学发光法显影,Quantity One图像分析系统进行显影条带灰度值分析。
3 统计学处理
结 果
1 Pull-down检测TNF-α对bEnd.3细胞RhoA活性的影响
与对照组相比,bEnd.3细胞RhoA活性在TNF-α处理10 min无明显变化;30 min明显增高达到高峰(P<0.01),60 min稍下降但仍高于对照组(P<0.05),见图1。

Figure 1.Activation of RhoA by TNF-α.The bEnd.3 cells were incubated in the presence of TNF - α (10 μg/L)for the indicated time.A:RhoA activation was determined by pull-down assay.The RhoA -GTP pulled down from lysates was detected by Western blotting using a specific anti-RhoA antibody.The total amount of RhoA in cell lysates was used as a control for the comparison of RhoA activity.B:quantitation of pulldown experiments.±s.n=3.*P<0.05.**P<0.01 vs control.图1 Pull-down检测TNF-α对bEnd.3细胞RhoA活性的影响
2 Western blotting检测TNF-α对bEnd.3细胞RhoA蛋白表达的影响
RhoA总蛋白表达在TNF-α刺激12和24h上调,与对照组之间的差异显著(P<0.05),见图2。
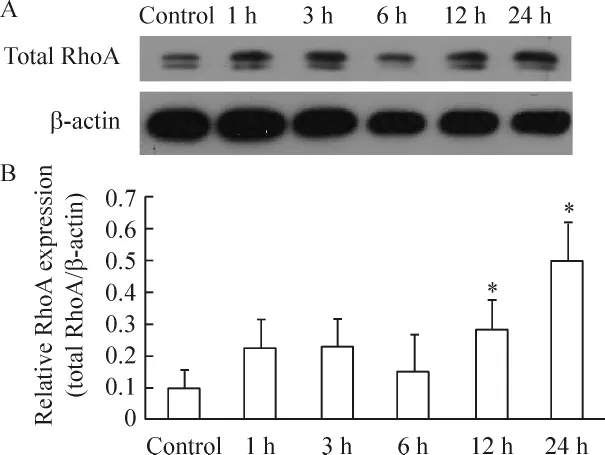
Figure 2.Time-course changes in the upregulation of RhoA protein induced by TNF - α (10 μg/L).The bEnd.3 cells were incubated in the presence of TNF-α(10 μg/L)for the indicated time points.A:total proteins were assayed for RhoA by Western blotting.The β -actin in cell lysates was used as a control.B:the expression levels of RhoA were summarized.±s.n=3.*P <0.05 vs control.图2 TNF-α对bEnd.3细胞RhoA蛋白表达量的影响
3 Western blotting鉴 定 siRNA 对 bEnd.3细 胞p115RhoGEF表达的抑制效果
与对照组相比,转染 p115RhoGEF siRNA的细胞p115RhoGEF的表达明显减少(P<0.01),分析显示其蛋白条带灰度值较对照组降低约91%,见图3。

Figure 3.Suppression of endogenous p115RhoGEF protein by siRNA.A:the bEnd.3 cells were transiently transfected with active siRNA against p115RhoGEF(siRNA)or the non-silencing RNA(nsRNA)and the protein lysates prepared at 72 h.Total proteins were assayed for p115RhoGEF by Western blotting.The β- actin in cell lysates was used as a control.B:the expression levels of p115RhoGEF were summarized.±s.n=3.**P <0.01 vs nsRNA.图3 siRNA对p115RhoGEF蛋白表达的影响
4 Pull-down检测p115RhoGEF siRNA对TNF-α刺激后RhoA活性改变的影响
TNF-α作用30 min后p115RhoGEF siRNA组RhoA有部分活化,但较对照组明显降低(P<0.05),分析显示其蛋白条带灰度值较对照组降低约51%,见图4。
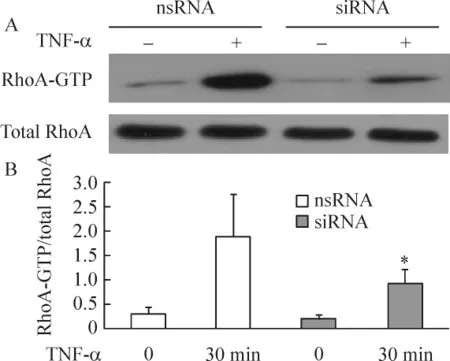
Figure 4.Effect of p115RhoGEF siRNA on TNF-α stimulated RhoA activation.A:p115RhoGEF siRNA or nsRNA were transfected into bEnd.3 cells and TNF - α -stimulated RhoA activation was measured by pulldown assay;B:quantitation of pull-down experiments.±s.n=3.*P<0.05 vs nsRNA.图4 p115RhoGEF siRNA对TNF-α刺激后RhoA活性改变的影响
讨 论
TNF-α是介导炎症、感染和其它内环境改变的重要起始因子,可直接损伤内皮细胞,导致应力纤维形成和细胞收缩。小G蛋白的Rho家族,由Rho、Rac和Cdc42三个亚家族组成,是一类能结合GTP的蛋白质,并能通过其下游效应蛋白介导多种生物功能包括细胞骨架形成、黏附、增殖和转录。近年研究表明,多种炎症介质和细胞因子均能激活Rho/Rho激酶途径,使肌球蛋白轻链磷酸化、肌动-肌球蛋白交联增加、F-actin骨架重组和应力纤维生成,导致内皮细胞收缩[5];Rho激酶抑制剂Y-27632可以抑制肿瘤细胞游走过程中引起的血管內皮单细胞层电阻下降[6]。为探讨TNF-α对脑微血管内皮细胞RhoA的调控,本实验观察了TNF-α处理bEn.d3细胞后RhoA的活性和表达变化,证实TNF-α(10 μg/L)诱导RhoA活性增高,RhoA-GTP表达在刺激后30min和60min明显增加,30min达到高峰,同时,总RhoA蛋白在TNF-α刺激后12 h和24 h上调,与在支气管平滑肌细胞的研究结果一致[7]。我们的结果表明RhoA参与了TNF-α介导脑微血管内皮细胞内信号传递过程,RhoA的活性和表达增加可能是TNF-α损伤内皮细胞屏障功能的机制之一。
然而,TNF-α激活RhoA的具体机制仍不明确。RhoA的活化依赖GEFs催化GDP向GTP转化,说明GEFs在RhoA活化的信号转导中发挥关键作用。p115RhoGEF是1996年由Hart等[8]发现的特异活化RhoA的GEF;G蛋白α亚单位12/13(Gα12/13)转导激动剂(如凝血酶和溶血凝脂酸)的信号,通过提高p115RhoGEF的GEF活性来激活RhoA。同时,Holinstat等[9]在外周血管内皮细胞的研究中,发现凝血酶诱导的RhoA活化和随之的细胞骨架重组需要Gα12/13与蛋白激酶Cα(PKCα)共同对p115RhoGEF的激活。上述研究提示p115RhoGEF参与了外界刺激对RhoA活化的调控,而TNF-α活化RhoA是否受p115RhoGEF调控尚未见报道。我们使用RNA干扰技术成功抑制了p115RhoGEF表达,在此基础上予TNF-α刺激,30 min后RhoA活化较对照组明显降低,提示抑制p115RhoGEF可以部分阻止TNF-α对RhoA的激活,证实p115RhoGEF参与了TNF-α对RhoA活化的调控。
综上所述,TNF-α可以诱导小鼠脑微血管内皮细胞RhoA活性增加和表达上调,在一定程度上揭示了TNF-α损伤内皮细胞的机制。
[1]尹 飞,杨于嘉,虞佩兰,等.大鼠百日咳菌液脑水肿脑组织肿瘤坏死因子-α变化[J].中国当代儿科杂志,2000,2(2):82-85.
[2]彭 镜,尹 飞,曾卫民,等.肿瘤坏死因子对体外血脑屏障模型通透性的影响[J].中国组织工程研究与临床康复,2007,11(36):7286 -7289.
[3]Harenberg A,Girkontaite I,Giehl K,et al.The Lsc Rho-GEF mediates signaling from thromboxane A2to actin polymerization and apoptosis in thymocytes[J].Eur J Immunol,2005,35(6):1977 -1986.
[4]Wang Q,Liu M,Kozasa T,et al.Thrombin and lysophosphatidic acid receptors utilize distinct rhoGEFs in prostate cancer cells[J].J Biol Chem,2004,279(28):28831-28834.
[5]Wettschureck N,Offermanns S.Rho/Rho-kinase mediated signaling in physiology and pathophysiology[J].J Mol Med,2002,80(10):629-638.
[6]辛 华,郑雅娟,韩振国,等.内皮细胞Rho及Rho激酶在肉瘤细胞向血管外游走过程中的作用[J].中国病理生理杂志,2004,20(6):950-953.
[7]Hunter I, Nixon GF. Spatial compartmentalization of tumor necrosis factor(TNF)receptor 1-dependent signaling pathways in human airway smooth muscle cells[J].J Biol Chem,2006,281(45):34705-34715.
[8]Hart MJ,Sharma S,elMasry N,et al.Identification of a novel guanine nucleotide exchange factor for the Rho GTPase[J].J Biol Chem,1996,271(41):25452 -25458.
[9]Holinstat M,Mehta D,Kozasa T,et al.Protein kinase Ca -induced p115RhoGEF phosphorylation signals endothelial cytoskeletal rearrangement[J].J Biol Chem,2003,278(31):28793-28798.

