参麻益智汤对拟阿尔海默病模型小鼠的治疗作用及其机制研究*
赵彦儒, 戚仁斌, 王华东, 张 晶, 陆大祥
(暨南大学医学院病理生理学系,暨南大学脑科学研究所,国家中药管理局三级科研实验室,广东广州510632)
阿尔茨海默病(Alzheimer disease,AD)是一种以进行性认知功能障碍和记忆损害为特征的神经退行性疾病,是老年人中最常见的一种痴呆类型,已经成为仅次于心脑血管、肿瘤之后的又一严重威胁老年人生命健康的疾病。中药复方制剂主要从补益气血、补肾添精、健脾益肾、活血化瘀、清浊化痰等方面对AD进行治疗。自拟中药复方参麻益智汤(Shenma Yizhi decoction,SYD)由丹参、天麻、杜仲、枸杞、五味子和甘草6味中药组成,其中丹参有活血化瘀的功效,天麻有安神定志、化痰开窍的功效,杜仲、枸杞和五味子有滋养肝肾的功效,甘草有益气养血的功效[1]。本实验运用D-半乳糖造成小鼠的亚急性衰老,来模拟AD发病的老年危险因素,同时灌胃三氯化铝(AlCl3)制备AD模型小鼠[2],初步研究了不同剂量的SYD对拟AD模型小鼠的防治作用及其机制。
材料和方法
1 材料
1.1 动物 雄性昆明种小鼠120只,SPF级,体重(20±2)g,2-3月龄,由广东省医学实验动物中心提供,合格证号为2008A022。
1.2 药品及主要试剂 SYD水溶液:含丹参、天麻、杜仲、枸杞、五味子和甘草6味中药的水煎剂,购于暨南大学附属第一医院中药房。制备:以药物总体积的8倍量水浸泡45 min,煎沸以后改温火煎1 h,取煎液;继用药物体积5倍量水,先后再煎2次;合并3次煎液;滤过,滤液用温火浓缩至药液浓度为0.8g/L(生药量)。无菌条件装瓶,置4℃冰箱备用。实验时用双蒸水稀释成不同浓度(低、中、高剂量质量浓度分别为2、4、8 mg·kg-1·d-1),依据《中药药理学》[3]中的方法确定。Trizol试剂购于 TaKaRa,逆转录试剂盒购于 Promega,SYBR® Premix Ex TaqTM荧光定量试剂盒购于 TaKaRa。Caspase-3Ⅰ抗购于Sigma,SA1022兔IgG试剂盒购于武汉博士德生物技术有限公司。SOD试剂盒和MDA试剂盒均购于南京建成生物工程研究所。
1.3 主要仪器 Morris水迷宫视频追踪程控系统(成都泰盟生物科技有限公司);ULTRA-TURRAX T8型组织匀浆机(IKA),低温高速冷冻离心机(Eppendorf),多功能全波长酶标仪(Tecan),梯度 PCR仪(PerkinElmer),Opticon 2型荧光实时定量PCR仪(MJ Research),正立电动荧光图像显微镜(Leica)。
2 方法
2.1 动物分组 运用Morris水迷宫将动物分组:平台置于西北象限的正中,在任一入水点将动物背向平台放入池中,自由游泳60 s使其适应环境。然后分别从东西南北4个入水点将动物放入池中,记录其游上平台所需时间(逃避潜伏期),让动物在平台上休息15 s再进行下1次实验。淘汰4次均没有找到平台的动物,将余下动物以潜伏期成绩按随机区组方法分为6组:空白对照组、AD模型组、SYD低、中、高剂量组(2、4、8 mg·kg-1·d-1)和维生素 E 组(vitamine E,VE,10 mg·kg-1·d-1),每组 20 只。
2.2 AD小鼠模型的建立和给药方法 模型组和给药组腹腔注射D -半乳糖60 mg·kg-1·d-1(生理盐水配制)和灌胃三氯化铝5 mg·kg-1·d-1(双蒸水配置),连续90 d,空白对照组腹腔注射等量的生理盐水和灌胃等量的双蒸水。SYD低、中、高剂量治疗组从第51 d开始灌胃相应剂量的SYD,VE组灌胃 VE 10 mg·kg-1·d-1,连续 40 d。
2.3 行为学实验 -Morris水迷宫测试[4]
①定位航行实验 反映动物的学习能力,连续4 d,且在水池周围放置固定参照物,分别从水池东南西北4个入水点将小鼠背向平台放入水池,电脑记录小鼠找到并爬上平台所需的时间,即逃避潜伏期。60 s内找不到平台者,将其引导上平台。每游完1次让小鼠在平台上休息至少15 s。
②空间探索实验 反映动物的记忆能力,第5 d。撤走池内平台,将小鼠从原平台相对的位置背向平台放入池中,通过系统记录并分析小鼠在60 s内的游泳轨迹,计算小鼠经过平台所在位置的次数和在平台象限游泳的时间。
2.4 海马SOD活性和MDA含量检测 小鼠水迷宫测试结束后,每组随机取出10只小鼠,迅速断头取脑,在冰面上分离两侧海马组织,按1∶10质量比加入生理盐水,在冰浴下匀浆30 s,匀浆液在4℃、3 500 r/min离心10 min,吸取上清于-20℃冰冻备用,隔天按试剂盒要求测定SOD活性和MDA含量,采用BCA蛋白测定试剂盒测定脑组织蛋白含量。
2.5 海马bax和bcl-2 mRNA含量的检测
①引物的设计与合成 根据GenBank的序列,采用分子生物学分析软件Primer 5.0设计小鼠以下基因引物,由TaKaRa合成。bax(产物长度为165bp)上游引物 5'- CAGGATGCGTCCACCAAGAA - 3',下游引物 5'- GTTGAAGTTGCCATCAGCAAACA -3';bcl-2(产物长度为151 bp)上游引物5'-TCGCCCTGTGGATGACTGAG -3',下游引物 5'- AGGCTGAGCAGGGTCTTCAGAG -3';GAPDH(产物长度为 275 bp)上游引物 5'- TCACCACCATGGAGAAGGC - 3',下游引物 5'- GCTAAGCAGTTGGTGGTGCA -3'。
②海马RNA样品的制备 小鼠水迷宫测试结束后,每组随机取5只小鼠,按Trizol试剂说明书所提供的方法,提取海马总 RNA,吸取2 μL RNA溶液,滴入微量酶标仪,读取其在A260/A280处的比值及浓度。
③逆转录 取约2 μg RNA作为模板进行后续的逆转录。反应完毕所得cDNA,置于-20℃保存。
④荧光实时定量PCR检测 取正常对照组的cDNA进行10倍梯度稀释后,得到标准品浓度梯度(1∶10、1∶100、1∶1 000)。反应体系 20 μL 中包括:模板 cDNA 1 μL,上、下游引物各 0.4 μL,蒸馏水 8.2 μL,SYBR Green I 10 μL。设置反应程序如下:95℃预变性10 s,95℃ 5 s,60 ℃ 10 s,72 ℃ 10 s,重复 40 个循环。在72℃10 s收集荧光信号,循环结束后执行熔解曲线程序。各梯度浓度的相对标准品均设3个平行管,反应完毕荧光定量分析软件自动绘制扩增曲线以及熔解曲线,通过熔解曲线分析产物的特异性。然后计算各组基因表达的相对变化。
2.6 海马caspase-3免疫组织化学染色
①组织取材 水迷宫测试结束后,将余下小鼠经腹腔注射1%的戊巴比妥钠(80 mg/kg),待其昏迷后打开胸腔暴露心脏,用医用10 mL注射器,从左心室插注射针,于心尖偏上处较好,深约1 cm,待心脏略胀时用大头针挑破右心耳;先后将生理盐水10-20 mL,4%多聚甲醛10-20 mL缓慢注入,至肝脏发白即可停止。注毕取出大脑,放入4%多聚甲醛溶液后固定备用。
②组织处理 取各组小鼠脑组织,置于真空组织脱水仪中梯度乙醇脱水以及二甲苯透明,石蜡包埋,石蜡切片机冠状连续切片,切片厚度6 μm。切片放入60℃烤箱烤12 h。
③海马组织caspase-3免疫组化染色 切片常规脱蜡入水;蒸馏水新鲜配制3%H2O2,室温封闭10 min以灭活内源酶;抗原微波热修复;滴加5%BSA封闭液,室温20 min,甩去多余液体;加入Ⅰ抗即caspase-3抗体(1∶100)4℃过夜;PBS冲洗,5 min×3次;滴加生物素化II抗,37℃20 min,PBS冲洗,5min×3次;滴加链霉素化亲和素试剂,37℃20 min,PBS冲洗,5 min×3次;DAB显色:1 mL蒸馏水加DAB显色试剂A、B、C各1滴,根据观察显色程度及时终止显色;常规脱水,二甲苯透明后中性树脂封片。阴性对照为用正常血清代替Ⅰ抗,其余步骤同上。
④细胞计数 用图像分析系统采集图像,进行海马CA1、CA3和DG区caspase-3阳性细胞计数,以海马细胞胞浆棕黄色颗粒状着色为阳性细胞,每张切片随机取3个视野,计数阳性细胞数,并计算阳性细胞的百分比,并以其均值代表该区阳性细胞表达百分比。
3 统计学处理
用SPSS 13.0对实验数据进行统计学处理,数据均用均数±标准差(±s)表示。水迷宫学习成绩数据采用重复测量的方差分析,其余数据均采用单因素方差分析。
结 果
1 Morris水迷宫测试结果
1.1 学习成绩 由表1可见,随着训练天数的增加各组小鼠的逃避潜伏期逐渐缩短,与正常对照组比较,AD模型组小鼠在第3 d和第4 d逃避潜伏期明显延长,差异显著(P<0.01)。与AD模型组相比,中剂量SYD组小鼠在第3 d和第4 d逃避潜伏期均缩短,差异显著(P<0.05);VE组在第3 d的逃避潜伏期明显缩短,差异显著(P<0.01);低和高剂量的SYD组逃避潜伏期差异无显著(P>0.05)。以上结果提示AD模型组造模成功,中剂量SYD和VE可以改善AD模型组小鼠的学习障碍,而低和高剂量SYD改善效果不明显。
表1 SYD对各组小鼠在Morris水迷宫中连续4 d的逃避潜伏期比较Table 1.Effects of SYD on escape latency in 4 consecutive days in place navigation test among all groups(s.±s.n=20)

表1 SYD对各组小鼠在Morris水迷宫中连续4 d的逃避潜伏期比较Table 1.Effects of SYD on escape latency in 4 consecutive days in place navigation test among all groups(s.±s.n=20)
▲▲P <0.01 vs control;*P <0.05,**P <0.01 vs AD model.
Group 1 d 2 d 3 d 4 d Control 45.53 ±14.01 38.12 ±11.30 27.06 ±10.8216.24 ± 9.49 AD 46.80 ±11.70 37.80 ±10.30 36.75 ± 9.61▲▲ 25.70 ± 8.13▲▲AD+2 mg·kg-1·d-1SYD 44.19 ±11.88 37.63 ±10.56 36.56 ±12.06 20.06 ±10.31 AD+4 mg·kg-1·d-1SYD 44.06 ±11.47 35.00 ± 9.66 27.69 ± 8.82* 18.06 ± 9.15*AD+8 mg·kg-1·d-1SYD 41.06 ±10.88 37.12 ± 8.82 31.76 ±10.41 22.06 ±12.92 AD+VE 41.26 ±12.30 33.58 ±13.37 26.70 ±10.99**19.47 ± 9.09
1.2 记忆成绩 由表2可见,与正常对照比较,AD模型组小鼠第5 d在目标象限停留时间缩短(P<0.05),穿越平台次数减少,差异显著(P<0.01)。与AD模型组相比,低、中剂量SYD组目标象限停留时间延长,差异显著(P <0.01,P <0.05);高剂量的SYD组目标象限停留时间和穿越平台次数均无显著差异(P>0.05);VE组穿越平台次数增多,差异显著(P<0.05)。以上结果提示AD模型组造模成功,低、中剂量SYD和VE在一定程度上能改善AD模型组小鼠的记忆障碍,高剂量SYD改善效果不明显。
表2 SYD对空间探索实验中各组小鼠在平台象限时间和经过平台次数的影响Table 2.Effects of SYD on staying time at platform area and frequency acrossed the platform in spatial probe test in mice(±s.n=20)
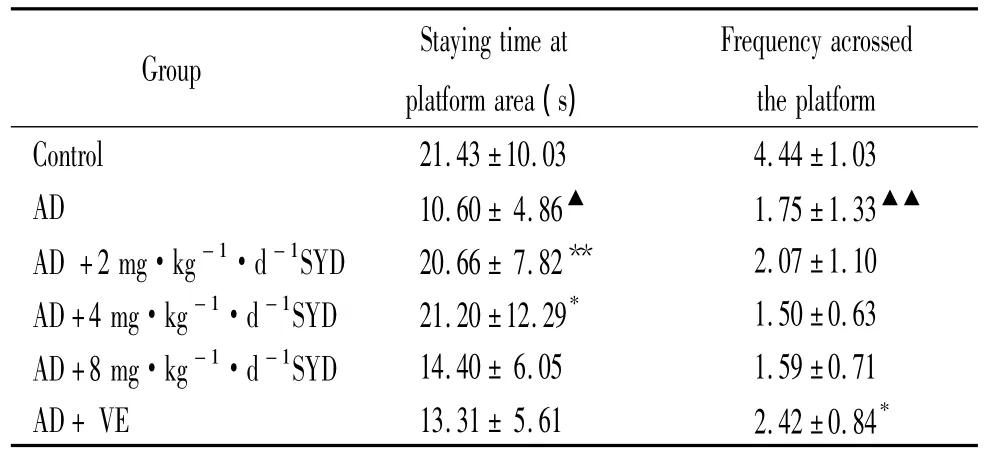
表2 SYD对空间探索实验中各组小鼠在平台象限时间和经过平台次数的影响Table 2.Effects of SYD on staying time at platform area and frequency acrossed the platform in spatial probe test in mice(±s.n=20)
▲P <0.05,▲▲P <0.01 vs control;*P <0.05,**P <0.01 vs AD model.
Group Staying time at platform area(s)Frequency acrossed the platform Control 21.43 ±10.03 4.44±1.03 AD 10.60±4.86▲ 1.75±1.33▲▲AD+2 mg·kg-1·d-1SYD 20.66±7.82** 2.07±1.10 AD+4 mg·kg-1·d-1SYD 21.20±12.29* 1.50±0.63 AD+8 mg·kg-1·d-1SYD 14.40±6.05 1.59±0.71 AD+VE 13.31±5.61 2.42±0.84*
2 海马组织SOD活性和MDA含量的结果
与正常对照组比较,AD模型组MDA含量显著升高(P<0.01),SOD活性无明显变化(P>0.05)。与AD模型组相比,中、高剂量SYD组SOD活性升高(P<0.05),MDA含量降低(P<0.05);VE组SOD活性显著升高(P<0.01),MDA含量降低(P<0.05);低剂量SYD组效果不显著(P>0.05),见表3。
表3 各组小鼠海马组织SOD活性和MDA含量的比较Table 3.Comparison of the SOD activity and the MDA content in hippocampus of mice among all groups(±s.n=10)
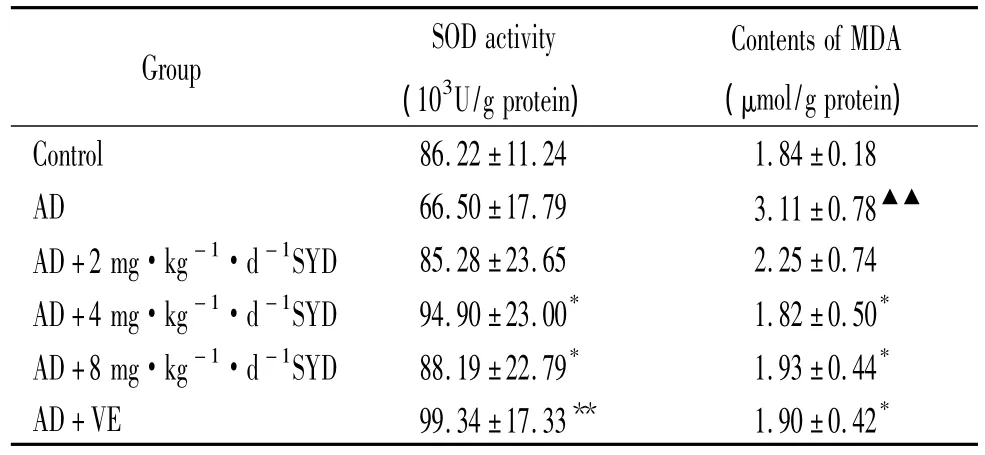
表3 各组小鼠海马组织SOD活性和MDA含量的比较Table 3.Comparison of the SOD activity and the MDA content in hippocampus of mice among all groups(±s.n=10)
▲▲P <0.01 vs control;*P <0.05,**P <0.01 vs AD model.
Group SOD activity(103U/g protein)Contents of MDA(μmol/g protein)Control 86.22 ±11.24 1.84±0.18 AD 66.50 ±17.79 3.11±0.78▲▲AD+2 mg·kg-1·d-1SYD 85.28±23.65 2.25±0.74 AD+4 mg·kg-1·d-1SYD 94.90±23.00* 1.82±0.50*AD+8 mg·kg-1·d-1SYD 88.19±22.79* 1.93±0.44*AD+VE 99.34 ±17.33** 1.90±0.42*
3 海马bax和bcl-2 mRNA表达的结果
3.1 荧光实时定量PCR方法观察SYD对AD模型小鼠海马bax mRNA表达的影响 将AD模型组小鼠海马bax mRNA表达设为100%,其它各组与之相比:正常对照组、中剂量 SYD组和 VE组海马 bax mRNA均表达降低,表达量分别为 AD模型组的(31.0±2.8)%、(69.0±6.4)%和(62.2±4.7)%,差异显著(P<0.01);高剂量SYD组与AD模型组相比,海马bax mRNA表达也降低,表达量为AD模型组的(81.2 ±5.9)%,差异显著(P <0.05),见图 1。
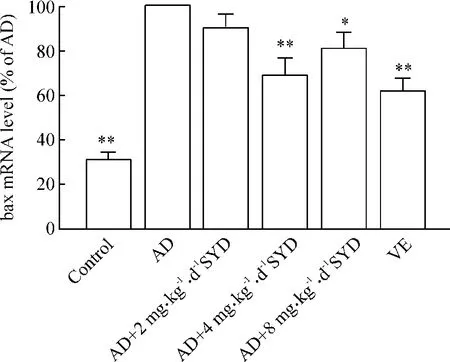
Figure 1.Effects of SYD on the expression of bax mRNA in hippocampus among all groups.±s.n=5.*P<0.05,**P <0.01 vs AD.图1SYD对各组小鼠海马脑组织中bax mRNA表达的影响
3.2 荧光实时定量PCR方法观察SYD对AD模型小鼠海马bcl-2 mRNA表达的影响 将正常对照组小鼠海马bcl-2 mRNA表达设为100%,AD模型组与之相比,bcl-2 mRNA表达降低,表达量为正常对照组的(67.8 ±5.9)%,差异显著(P <0.01);其余各组与AD模型组相比差异无显著(P>0.05),见图2。
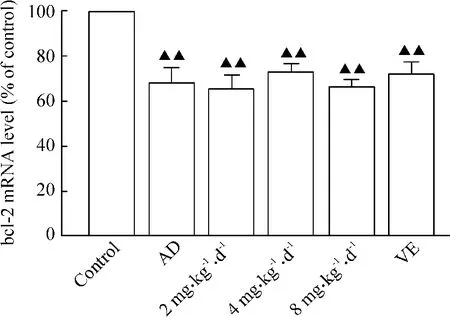
Figure 2.Effects of SYD on the expression of bcl-2 mRNA in hippocampus among all groups.±s.n=5.▲▲P<0.01 vs control.图2 SYD对各组小鼠海马脑组织中bcl-2 mRNA表达的影响
4 海马组织caspase-3表达的免疫组化结果
与正常对照组相比,AD模型组小鼠海马各区caspase-3阳性细胞的百分比均显著增高(P<0.01);与AD模型组相比,高剂量SYD组海马DG区和VE组CA1区caspase-3阳性细胞的百分比减少,差异显著(P<0.05),中剂量 SYD组和 VE组海马DG区caspase-3阳性细胞的百分比显著减少(P <0.01),见表4、图3(以海马 DG 区为例)。
表4 各组小鼠海马各区caspase-3阳性细胞的百分比Table 4.Percentages of caspase-3 positive cells on hippocampus CA1,CA3 and DG regions(±s.n=5)
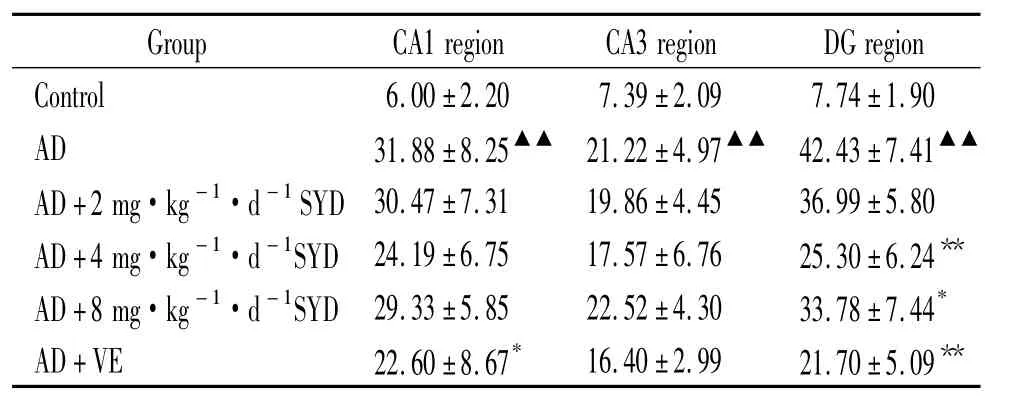
表4 各组小鼠海马各区caspase-3阳性细胞的百分比Table 4.Percentages of caspase-3 positive cells on hippocampus CA1,CA3 and DG regions(±s.n=5)
▲▲P <0.01 vs control;*P <0.05,**P <0.01 vs AD model.
Control 6.00±2.20 7.39±2.09 7.74±1.90 AD 31.88±8.25▲▲ 21.22±4.97▲▲ 42.43±7.41▲▲AD+2 mg·kg-1·d-1SYD 30.47±7.31 19.86±4.45 36.99±5.80 AD+4 mg·kg-1·d-1SYD 24.19±6.75 17.57±6.76 25.30±6.24**AD+8 mg·kg-1·d-1SYD 29.33±5.85 22.52±4.30 33.78±7.44*AD+VE 22.60±8.67* 16.40±2.99 21.70±5.09**

Figure 3.The protein expression of caspase-3 on hippocampus DG region among all groups(×400).Red arrows indicate the caspase-3 positive cells.A:control;B:AD;C:AD+2 mg·kg-1·d-1SYD;D:AD+4 mg·kg-1·d-1SYD;E:AD+8 mg·kg-1·d-1SYD;F:AD+VE.图3 各组小鼠海马DG区caspase-3蛋白的表达
讨 论
AD的发病机制存在多种学说,主要有β淀粉样蛋白学说、Tau蛋白学说、遗传因素学说、慢性炎症学说、氧自由基导致的神经退行性病变学说等,涉及多个致病因素,如遗传、兴奋性毒性、神经营养因子缺乏、自身免疫缺陷和氧化应激等,有研究表明氧化应激在AD的病理生理过程中起着关键的作用[5],是AD病理学改变的最早发生的事件之一[6]。
随着年龄的老化或疾病的发生,脑组织内自由基生成增多或机体抗氧化体系防御功能下降,使自由基产生与清除之间失去平衡,从而诱发一系列自由基连锁反应,破坏细胞膜、细胞内微环境、能量代谢等,导致神经元损伤、死亡,甚至引发AD[7]。本实验用腹腔注射D-半乳糖,同时灌胃三氯化铝来制备AD模型小鼠,结果显示,AD模型组小鼠学习记忆能力明显下降,海马MDA含量明显升高。各剂量SYD对AD模型小鼠学习记忆都有一定程度的改善,其中中剂量SYD和VE的改善作用更明显,提高了海马SOD酶的活性,降低了MDA的含量,表明SYD和VE能提高机体抗氧化能力,对脂质过氧化反应有明显的抑制作用,可以保护海马免受自由基的损伤。
机体自由基的过量产生引起的氧化应激反应可导致细胞凋亡增加。细胞凋亡是不同于细胞坏死的另一种细胞死亡形式,其过程受一系列相关基因的调控。其中Bcl-2家族在凋亡调控基因中处于重要的地位,Bcl-2蛋白是一种膜结合蛋白,存在于细胞的线粒体、核膜等处,主要生理功能是抑制细胞凋亡、延长细胞寿命;Bax蛋白是Bcl-2的同源蛋白,具有促进细胞凋亡的作用,并抑制 Bcl-2的效应[8]。本实验结果显示,AD模型组小鼠海马 bax mRNA表达明显升高,而bcl-2 mRNA表达明显降低,高剂量SYD能够抑制bax mRNA表达,中剂量SYD和VE效果更明显,但各剂量SYD均未对bcl-2 mRNA表达造成明显影响,表明中、高剂量SYD和VE可能通过减少小鼠海马bax mRNA表达而抑制神经元的凋亡。
Caspase家族是细胞凋亡的促进因子,其中caspase-3是caspase级联反应下游最重要的凋亡蛋白酶[9]。研究发现在一些神经元退行性变的细胞和动物模型中,有caspase-3的激活,而抑制其激活可以减少神经元的凋亡[10,11]。有研究证实抑凋亡蛋白Bcl-2和Bcl-XL通过阻止caspase-3的激活进而抑制细胞的凋亡[12],促凋亡蛋白Bax可以使细胞色素C穿过线粒体膜,激活caspase-3而导致细胞凋亡[13]。故测定小鼠海马神经元caspase-3蛋白的表达可以间接反映神经元的凋亡情况。本实验结果显示,AD模型小鼠海马各区神经元caspase-3阳性细胞百分比增高,高剂量SYD,尤其是中剂量SYD和VE明显抑制了caspase-3蛋白的表达,表明中、高剂量SYD和VE可能通过抑制小鼠海马神经元caspase-3蛋白的表达而减少神经元的凋亡。
综上所述,AD模型组小鼠学习记忆能力的下降可能与海马的自由基生成过多造成的氧化应激损伤、bax/bcl-2 mRNA比值的增高、caspase-3蛋白表达增加等相关。自拟中药复方SYD对AD模型组小鼠学习记忆能力的改善可能与抑制海马神经元的凋亡密切相关,其机制可能与SYD能提高海马神经元的抗氧化能力,减轻氧化应激损伤,降低bax mRNA的表达和caspase-3蛋白表达有关,但这些方面之间的具体关联还有待进一步探讨。
[1]朱志明,周永生,欧阳剑虹.治疗老年期痴呆46个复方的药物分析[J].湖南中医杂志,2001,17(1):60- 61.
[2]罗焕敏,肖 飞.D-半乳糖和三氯化铝诱导小鼠产生类阿尔茨海默病变[J].中国药理学与毒理学杂志,2004,18(1):22 - 26.
[3]沈映君 主编.中药药理学[M].第1版.北京:人民卫生出版社,2000.70- 72.
[4]韦 佳,陆大祥,戚仁斌,等.抗衰益智方Ⅰ对小鼠学习记忆能力以及海马胆碱乙酰转移酶表达的影响[J].中国病理生理杂志,2010,26(6):1102-1106.
[5]Taupin P.A dual activity of ROS and oxidative stress on adult neurogenesis and Alzheimer's disease[J].Cent Nerv Syst Agents Med Chem,2010,10(1):16 -21.
[6]Nunomura A,Perry G,Aliev G,et al.Oxidative damage is the earliest event in Alzheimer disease[J].J Neuropathol Exp Neurol,2001,60(8):759 -767.
[7]白洁如,刘颖菊,宋 昀,等.羟基积雪草苷干预神经元退变的机制研究[J].中国老年学杂志,2008,28(23):2297- 2300.
[8]黄俊杰,李倩茗,韦红巧,等.碱性成纤维细胞生长因子对大鼠脑血肿周围组织和海马bax及bcl-2基因表达的调节[J].中国组织工程研究与临床康复,2007,11(14):2637- 2640.
[9]Cho BB,Toledo-Pereyra LH.Caspase-independent programmed cell death following ischemic stroke[J].J Invest Surg,2008,21(3):141 -147.
[10]Gervais FG,Xu D,Robertson GS,et al.Involvement of caspases in proteolytic cleavage of Alzheimer's amyloid -beta precursor protein and amyloidogenic A beta peptide formation[J].Cell,1999,97(3):395 - 406.
[11]Ghribi O,Herman MM,Spaulding NK,et al.Lithium inhibits aluminum-induced apoptosis in rabbit hippocampus,by preventing cytochrome C translocation,Bcl- 2 decrease,Bax elevation and caspase-3 activation[J].J Neurochem,2002,82(1):137 -145.
[12]Zhang Y,Wang W,Sun Z,et al.Granulocyte colonystimulating factor treatment prevents cognitive impairment following status epilepticus in rats[J].Biol Pharm Bull,2010,33(4):572 -579.
[13]Kondratyev A,Selby D,Gale K.Status epilepticus leads to the degradation of the endogenous inhibitor of caspaseactivated DNase in rats[J].Neurosci Lett,2002,319(3):145-148.

