嗜热厌氧梭菌直接发酵造纸污泥的基本特性*
朱明军 李平 谢文化
(1.华南理工大学生物科学与工程学院,广东 广州510006;2.广州甘蔗糖业研究所,广东广州510316)
嗜热厌氧梭菌(Clostridium thermocellum)是一种严格厌氧的嗜热革兰氏阳性菌,其最适生长温度为55~60℃[1-4].嗜热厌氧梭菌能直接以纤维素或微晶纤维素、纤维二糖为碳源发酵生产乙醇,并产生乙酸、乳酸、甲酸、氢气和二氧化碳等副产物.嗜热厌氧梭菌能产生一种叫纤酶小体的酶复合体,能有效降解结晶纤维素,产生葡萄糖供自身细胞生长代谢.目前的研究表明[3,5-7],纤酶小体至少包含9个内切酶蛋白、4个外切酶蛋白、5个木聚糖酶蛋白、1个几丁质酶蛋白和1个地衣多糖酶蛋白.有趣的是嗜热厌氧梭菌虽然能产生木聚糖酶,但自身却并不能利用木糖.纤酶小体各组分通过纤维素结合域(CBD)与纤维素结合,通过锚定域与细胞壁上的脚手架蛋白相联,形成纤维素酶复合体-细胞的三元有机整体(CEM),具有极高的催化效率.早期对C.thermocellum的研究主要集中在发酵条件控制、底物预处理等优化控制上,但由于其生长产酸导致培养基pH下降,同时自身的酒精耐受性只有1%(体积分数,下同)左右,其乙醇产量只有0.8~1.2g/L左右[8-10];之后对其研究主要集中在高酒精耐受株的筛选、纤酶小体的克隆表达、代谢途径的控制及生物联合加工(CBP)应用上.目前已筛选到最高能耐受5%酒精的菌株[11].Harish 等[12]利用共培养技术控制pH变化,发酵预处理过的香蕉收获后得到的农业废弃物,酒精产量最高达到22g/L.这对于其CBP应用来说是个不小的进步.
全球能源问题和环境问题日益严重,利用地球上含量最丰富的纤维素和半纤维素等植物生物质资源开发新能源越来越受到各国政府的重视.嗜热厌氧梭菌能直接利用纤维素发酵生产燃料乙醇,这对于降低成本、简化生产工艺具有重要意义;其酶复合体纤酶小体具有典型的热稳定性,具有适用于高热环境、易纯化、对化学变性剂有强的抗性、反应速率和效率高等优点[13].因此,嗜热厌氧梭菌被认为是纤维素酒精集成生物工艺中最有前景的菌株之一.造纸污泥难处理易污染环境,目前通常采用填埋法和焚烧法进行处理,其中的纤维素和半纤维素并没有得到有效利用.目前对造纸污泥的有效利用的研究较少,江丹等[14]研究了酶解造纸污泥发酵燃料乙醇的规律.本研究以造纸污泥为原料,利用嗜热厌氧梭菌在不预处理和不加酶的情况下直接发酵造纸污泥,并探讨了该发酵过程中产燃料乙醇及产酶的规律.
1 材料与方法
1.1 菌种
嗜热厌氧梭菌(Clostridium thermocellum ATCC 27405)为Dartmouth College Lee R.Lynd教授赠送,保藏于华南理工大学发酵工程研究室.
1.2 原料及试剂
所有试剂均为分析纯,纤维素和二盐酸吡哆胺购于上海生工生物工程有限公司,纤维二糖购于广州齐云生物科技有限公司,其它试剂购自天津科密欧试剂有限公司.浆板纸、化学制浆污泥(含纤维素57.60%,半纤维素13.41%,灰分13.00%)及脱墨污泥(含纤维素11.90%,半纤维素3.90%,灰分44.00%)来自广东某造纸厂.
1.3 培养基及血清瓶培养
主要成分为A、B、C、D、E 液,分开配制,分装于100 mL血清瓶中,抽真空并充0.04 MPa的氮气,115℃灭菌20 min(E液滤菌).培养基5种成分按体积比45∶2∶1∶1∶1 用无菌注射器混合.A 液为菌体生长所需的碳源,根据实验需要调整,本研究中为不同浓度的纤维二糖、商业纤维素及造纸污泥等原料.B液:柠檬酸三钾盐50.00g/L、一水柠檬酸31.25g/L、硫酸钠25.00g/L、磷酸二氢钾25.00 g/L、碳酸氢钠62.50g/L.C 液:氯化铵75g/L、尿素250g/L、酵母抽提物50g/L.D液:六水氯化镁50g/L、四水氯化亚铁5g/L、二水氯化钙10g/L、一水半胱氨酸盐酸50g/L.E液:二盐酸吡哆胺1.0g/L、对氨基苯甲酸0.2g/L、D-生物素0.1g/L、维生素B120.1g/L、维生素B10.2g/L.
将培养基用无菌注射器在100 mL血清瓶中混合,装液50mL,接种量为10%(体积分数,下同),在摇床(上海智诚ZHWY-200D恒温培养振荡器)上于55℃、150r/min的条件下培养24h作为种子液.
1.4 细胞生长的测定
若培养基以纤维二糖为碳源,则使用Genesys 10 VIS型直插式分光光度计(美国Thermo Scientific公司)在600 nm处测定装有菌液的西林瓶(直径2cm)的吸光值.
1.5 发酵产物及纤维二糖、木糖含量的测定
每12h取一次样,1.9mL样品加入0.1mL 10%的硫酸,12000g离心5min,再用0.22 μm微孔滤膜过滤.使用Waters 2695高效液相色谱仪检测,色谱柱为Biorad公司的HPX-87H柱,柱温60℃;流动相为去离子水配制的2.5mmol/L的硫酸溶液,流动相流速为0.6mL/min;检测器为Waters 2414示差折光检测器,检测器温度为40℃.
1.6 粗酶液的制备
摇瓶或发酵罐在不同的时间点取样,将样品在4℃、3000g下离心10min,上清液即为粗酶液,用于酶活测定.
1.7 纤维素酶酶活定义及活性测定
据纤维素酶制剂轻工业行业标准 (QB2583—2003)并将反应温度修改为55℃测定样品的纤维素酶酶活.
滤纸酶活的定义:1mL粗酶液在55℃、指定pH条件下水解滤纸底物1h,产生相当于1mg葡萄糖的还原糖量为1个酶活单位 (U).羧甲基纤维素钠(CMC-Na)酶活定义:1 mL粗酶液在55℃、指定pH条件下水解CMC-Na底物1 h,产生相当于1mg葡萄糖的还原糖量为1个酶活单位(U).
1.8 木聚糖酶酶活的定义及活性测定
取1.5mL pH=6.0的柠檬酸-磷酸氢二钠缓冲液配制的1%木聚糖溶液,加入0.5mL的粗酶液,于55℃反应30min,立即加入3mL的3,5-二硝基水杨酸(DNS)试剂,沸水浴中显色10 min,迅速冷却后,用蒸馏水定容到25mL,充分混匀,于波长540nm处以对照组空白测定吸光值.对照组在沸水浴前加入粗酶液并迅速煮沸.
木聚糖酶酶活定义:1 mL粗酶液在55℃、指定pH条件下水解木聚糖底物1min,产生相当于1μmol木糖的还原糖量为一个酶活单位(U).
1.9 反应器培养方法
反应器培养在Sartorius Stedim Biostat A plus全自动发酵罐中进行.分别采用不同的底物配制A液,灭菌后再泵入B、C、D、E液,通入流速为10 L/h的高纯氮气约1 h制造厌氧环境,接种量为10%(体积分数,下同),装液量为1L,控制发酵罐的各项参数如下:pH=7.0,200r/min,55℃,继续通入的保持厌氧环境的高纯氮气的流速为10 L/h.在不同时间点取样测定发酵产物以及纤维素酶和木聚糖酶酶活.
1.10 纤维素酶和木聚糖酶的基本特性
以20g/L商业纤维素为底物,在反应器中培养96h并制备粗酶液,按1.7和1.8所述方法,分别在不同温度及不同pH条件下测定纤维素酶和木聚糖酶的酶活以获取纤维素酶和木聚糖酶的最适温度和pH.在最适温度和pH下,在粗酶液中加入25mmol/L的不同金属离子并测定纤维素酶和木聚糖酶的酶活以考察不同金属离子对纤维素酶和木聚糖酶酶活的影响.
2 结果与讨论
2.1 不同浓度的两种典型碳源对菌种生长及产酶的影响
纤维二糖和纤维素是嗜热厌氧梭菌的两种典型的碳源,纤维二糖是可溶性的,而纤维素是不溶性的.本研究分别以1.0、2.5、5.0、10.0、20.0g/L 的纤维二糖和纤维素为碳源,在血清瓶中培养,每24 h取一次样,其pH和产物含量变化情况如图1所示.
从图1可以看出,C.thermocellum在纤维二糖中生长迅速,24h即达到最大D(600)值,发酵液中的纤维二糖测定结果表明,1.0g/L和2.5g/L纤维二糖培养基中剩余的纤维二糖均为0;5.0g/L和10.0g/L培养基中剩余的纤维二糖分别为0.16g/L和4.89g/L,说明C.thermocellum仅能利用约5.0 g/L的纤维二糖,这是因为C.thermocellum生长产酸导致培养基pH下降抑制其生长的缘故.将发酵液进行离心分离、细胞裂解及烘干,2.5g/L纤维素培养基中剩余的纤维素含量为0;5.0g/L纤维素培养基中剩余的纤维素含量为0.24g/L,说明C.thermocellum能利用的纤维素最大质量浓度约为5.0g/L.
分别连续测定了5.0 g/L纤维素和5.0 g/L纤维二糖作碳源时的纤维素酶酶活变化情况,结果如图2所示.从图2可以看出,以5.0 g/L纤维素为底物时的滤纸酶活和CMC-Na酶活比5.0 g/L纤维二糖为底物时的都高.这是因为C.thermocellum不需要合成纤维素酶即可直接利用纤维二糖,且纤维二糖还是纤维素酶的抑制剂,因此底物为纤维二糖时纤维素酶酶活会较低.最高木聚糖酶酶活则是5.0g/L纤维二糖为底物时更高,具体原因需进一步研究.
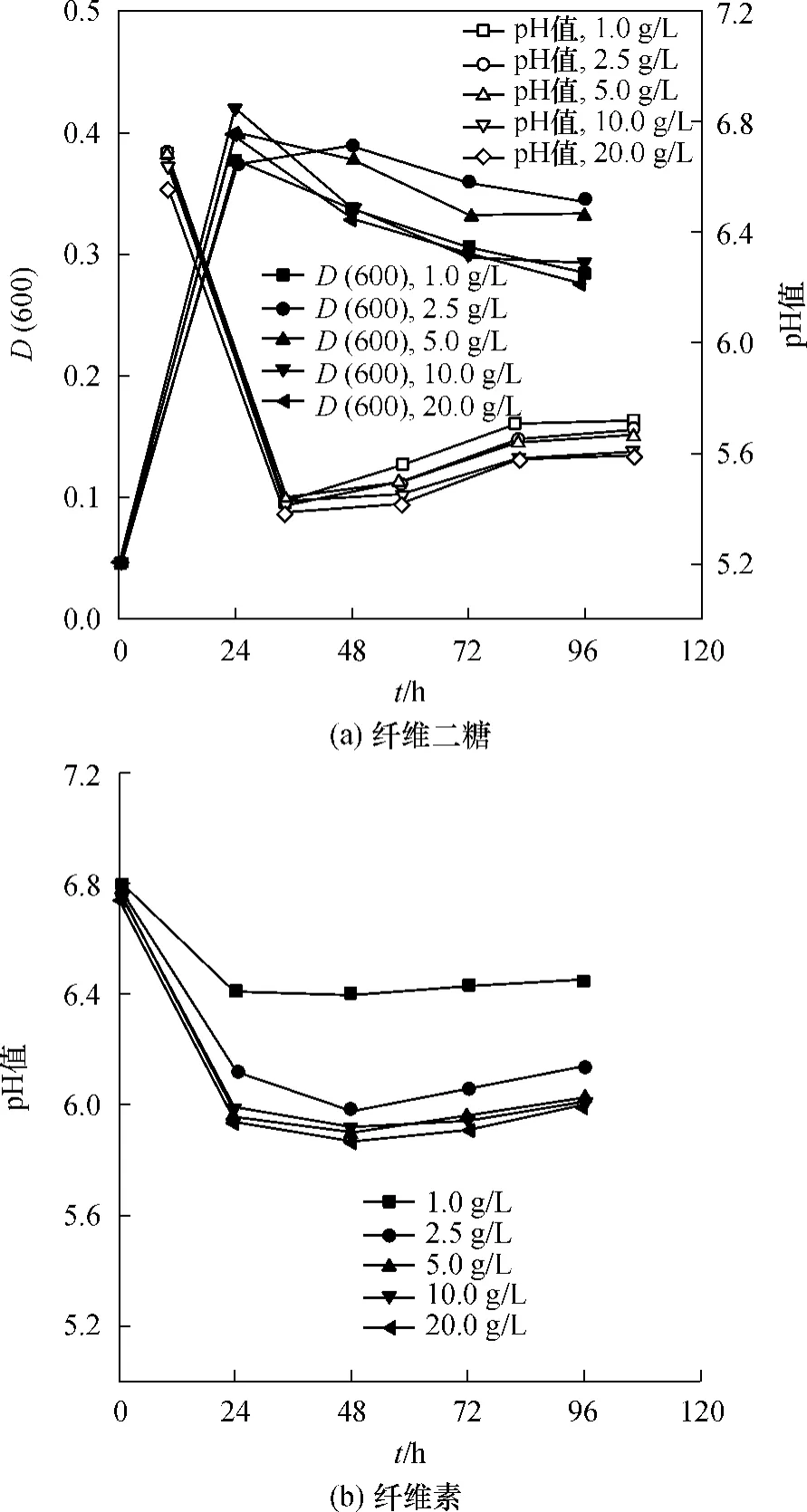
图1 嗜热厌氧梭菌在不同浓度的纤维二糖和纤维素中的生长曲线Fig.1 Growth curves of C.thermocellum at various concentration of cellobiose and cellulose
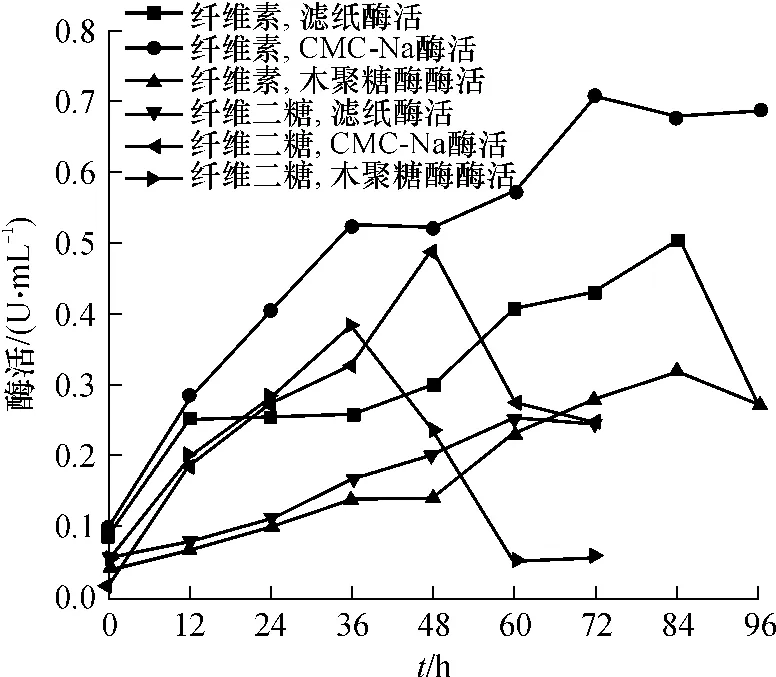
图2 5.0g/L纤维素和5.0g/L纤维二糖血清瓶培养时纤维素酶和木聚糖酶酶活变化曲线Fig.2 Enzyme activity curves of cellulase and xylanase in serum bottles with 5.0g/L cellulose and 5.0g/L cellobiose
2.2 C.thermocellum在发酵罐中直接发酵不同纤维素原料的基本特性
从上面的研究可以发现,C.thermocellum生长产生酸,致使pH下降,当pH下降至一定值时生长即停止.发酵罐能控制pH的变化,对于菌体生长及产物积累有积极作用.
在发酵罐中以20.0g/L商业纤维素为底物时,乙醇含量在96h达到最大值4.17g/L(见图3(a)),是血清瓶培养时乙醇产量的8.03倍,之后略有下降;乙酸是主要的副产物,最高含量达到2.55g/L,甲酸和乳酸的含量相对较低,含量最高时分别为0.93g/L和0.63g/L;滤纸酶活在 C.thermocellum生长稳定期达到1.79U/mL,是血清瓶培养时最高酶活的3.53倍,108h(底物消耗完)达到2.70 U/mL;CMC-Na酶活最高达到3.92 U/mL,是血清瓶培养时的5.69倍;木聚糖酶酶活最高达到0.96 U/mL,是血清瓶培养时的3.01倍,结果表明,反应器培养能提高菌体浓度,促进产酶.进一步提高商业纤维素含量到40.0g/L,乙醇含量达到4g/L左右代谢途径即自动转向乙酸及乳酸代谢途径;同时酶活变化不大(滤纸酶活、CMC-Na酶活及木聚糖酶酶活最高分别为1.78、3.69及1.01U/mL),说明单纯靠提高底物浓度并不能进一步提高产物浓度和酶活.
以20.0g/L浆板纸为底物时,纤维素酶酶活和产物整体变化趋势与以商业纤维素为底物时大致相同(见图3(b)),但最高酶活却比以商业纤维素为底物时低,其原因可能是因为浆板纸在造纸过程中经过高温、碱、蒸汽爆破等一系列处理,菌体不需要表达大量的酶即可利用,所以发酵液的纤维素酶最高酶活较商业纤维素作底物时低.木聚糖酶最高酶活与以商业纤维素为底物时相比略有提高,达到1.14 U/mL.各种产物也比以商业纤维素为底物时低,乙醇含量最高只有2.86g/L,甲酸、乙酸、乳酸的峰值含量分别为0.55、0.55和0.34 g/L.造成这种现象的原因尚待进一步研究.

图3 反应器中C.thermocellum发酵商业纤维素、浆板纸、化学制浆污泥及脱墨污泥的基本特性Fig.3 Characteristics of C.thermocellum cultured in bioreactor with cellulose,paper pulp,chemical paper sludge,recycled paper sludge as feedstock

造纸污泥是制浆和造纸工业废水处理过程的固体残渣.造纸污泥中一般含有20% ~70%的碳水化合物,其中大约有80%是纤维素和半纤维素[14],理论上可以被C.thermocellum直接利用.工业中常见的两种造纸污泥是化学制浆污泥和脱墨污泥.C.thermocellum能够直接利用未经任何预处理的化学制浆污泥和脱墨污泥(见图3(c)、(d)).C.thermocellum直接利用化学制浆污泥(固形物含量为40.0g/L)要经过近96h的延迟期,这可能是由于污泥中含有较多的杂质和灰分所致.与商业纤维素为底物发酵的稳定期相比,化学制浆污泥的稳定期的CMC-Na酶活与之相当,在3.67 U/mL左右,滤纸酶活提高了10%左右,达到1.92U/mL.其原因可能是因为污泥里的纤维素被一些杂质如泥土、CaCO3包裹着,不容易利用,所以菌体要表达更多的酶利用污泥.由于所使用的化学制浆污泥里还含有大约13.41%的半纤维素,能够诱导菌体产生更多的木聚糖酶,因而木聚糖酶最高酶活比商业纤维素作底物时提高了35%,达到1.30U/mL.化学制浆污泥的乙醇产量最高为7.41g/L,较以商业纤维素为底物时的乙醇含量提高了77.9%,但乙酸含量也高达7.11g/L,乙醇/乙酸质量浓度比接近1∶1;与商业纤维素为底物时相比,化学制浆污泥为底物时的甲酸含量也有大幅度提高,最高达到2.22 g/L,乳酸最高含量降低,为 0.58g/L.
脱墨污泥里灰分含量达到44.00%,以CaCO3和高岭土为主,同时含有较多的重金属等杂质,对菌体生长及产酶有较强的抑制作用(见图3(d)).以脱墨污泥为底物(固形物含量为84.0g/L)时最高滤纸酶活只有0.72 U/mL,为以商业纤维素为底物时的27%;最高CMC-Na酶活为1.64U/mL,是以商业纤维素为底物时的42%;最高木聚糖酶酶活为0.90U/mL,变化较小.同时产物含量也较低,乙醇最高含量只有1.31g/L,乙酸、甲酸和乳酸最高含量分别为1.55、0.43和0.07 g/L.不同底物对 C.thermocellum的乙酸、甲酸和乳酸3条支路代谢影响较大,其产量的比值差别较大(见表1).以化学制浆污泥为底物时乙醇产量最高,达到7.41g/L;以浆板纸和纤维二糖为底物时,乙醇/乙酸质量浓度比较高,分别达到5.23和5.07.

表1 不同底物发酵产物比较1)Table 1 Comparison of fermentation products cultured in different substrates
2.3 C.thermocellum纤维素酶和木聚糖酶的基本特性
由图4(a)可知,C.thermocellum纤维素酶的最适反应温度为60℃,酶活是55℃下酶活的1.09倍,温度低于55℃或超过60℃时酶活迅速下降,65℃和50℃的酶活分别只有55℃的酶活的72.50%和75.17%.商业纤维素酶通常通过丝状真菌来生产,其最适温度通常为50~55℃,当温度达到60℃时酶活迅速下降,通常只有最适温度下的40%左右[15],因此C.thermocellum纤维素酶耐热性有较明显的优势.由图4(a)还可知,C.thermocellum产木聚糖酶有良好的耐热性,其最适反应温度为70℃,为55℃条件下酶活的1.52倍,当温度达到80℃时,其酶活依然为55℃条件下的1.16倍.通常商业木聚糖酶来源于真菌或细菌,最适温度一般为40~60℃[16],相比较而言,C.thermocellum木聚糖酶具有较好的耐热性.
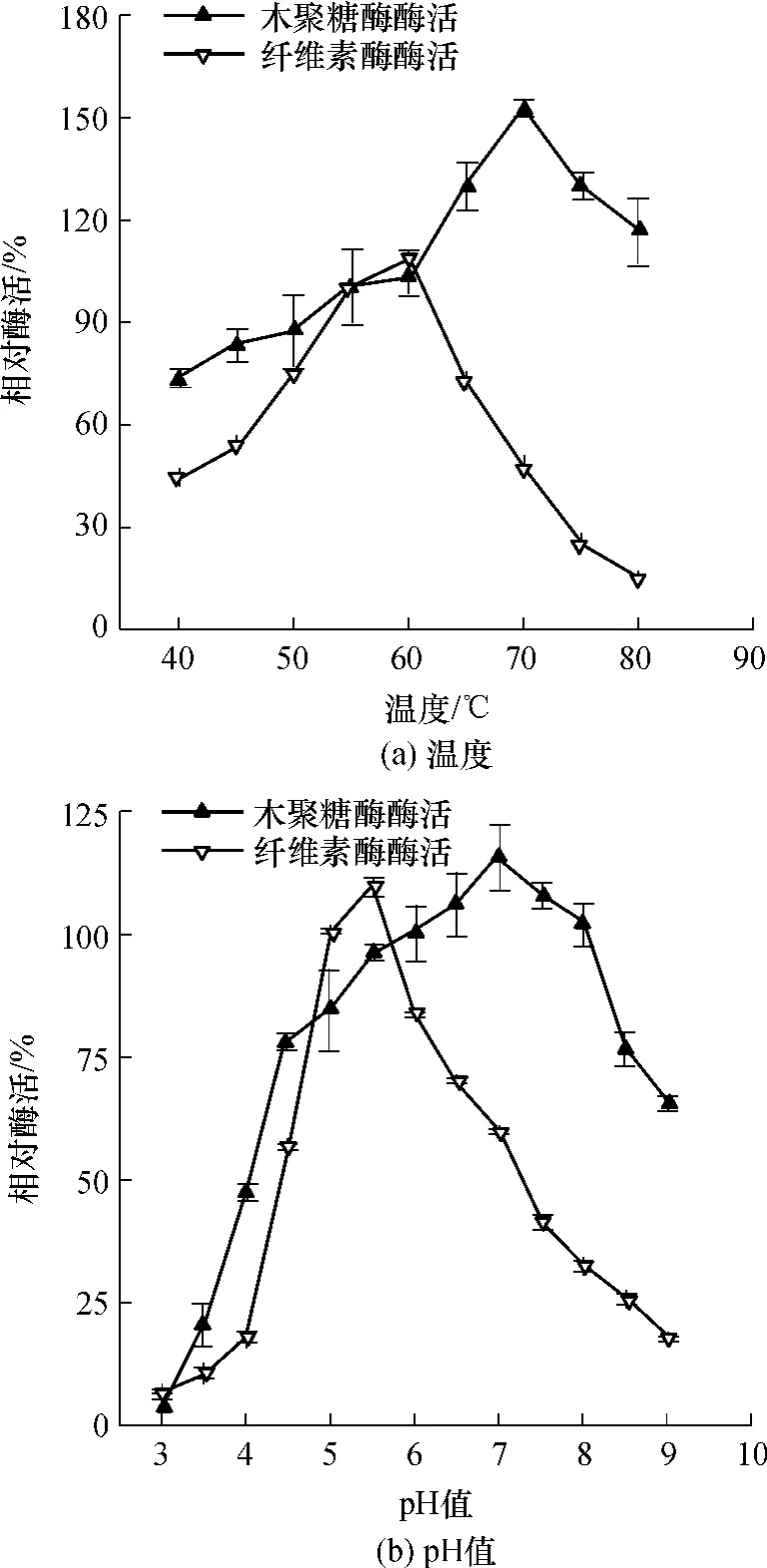
图4 温度和pH对纤维素酶和木聚糖酶酶活性的影响Fig.4 Effects of temperature and pH on cellulase and xylanase activity
由图4(b)可知,C.thermocellum产纤维素酶的最适pH值为5.5左右,pH下降对酶活影响较大,pH=4.5时酶活为pH=5.0时的56.78%,但pH值降到4.0时,酶活只有pH=5.0时的18%,说明该纤维素酶对酸性环境敏感,这也为低pH条件下菌体几乎不生长提供了证据.商业纤维素酶通常分为酸性纤维素酶和中性纤维素酶,前者最适的酶pH值为4.8左右,后者为6.0左右,C.thermocellum产纤维素酶最适pH值为5.5左右,说明该酶与市售的商业纤维素酶有较大区别.C.thermocellum产木聚糖酶的最适pH值为7.0左右,此时酶活为常规测定方法的1.15倍.该木聚糖酶有着良好的pH适应性,在pH=5.5~8.0都能保持96%以上的活性(相对于pH=6.0).
Ca2+是纤维素酶的组成部分,从图5可以看出,Ca2+并未如报道所述对其酶活有促进作用[17],可能是因为粗酶液里其它离子的影响.Ba2+对其有明显的促进作用,纤维素酶酶活为空白对照的1.71倍.其余各种离子对纤维素酶都有不同程度的抑制作用,其中Fe3+、Cu2+的抑制作用最强,纤维素酶酶活分别为原来的29.4%和30.6%.有研究表明,一些重金属元素如Cu2+能影响酶分子的—SH的还原状态使之氧化,从而改变酶的构象使酶失活[18].乙二胺四乙酸(EDTA)也对纤维素酶有明显的抑制作用.
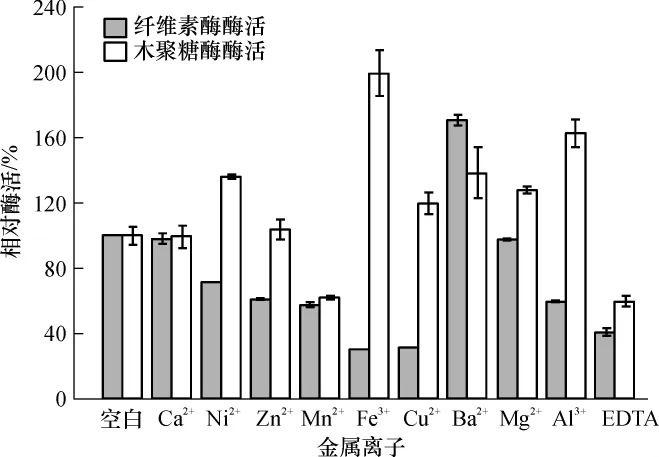
图5 金属离子和EDTA对纤维素酶和木聚糖酶酶活的影响Fig.5 Effects of metallic ions and EDTA on cellulase and xylanase activities
Ca2+也未对木聚糖酶酶活产生明显的促进或抑制作用,Fe3+对木聚糖酶酶活促进作用最强,为空白对照的1.99倍,其次是Al3+,为空白对照的1.63倍.Mn2+和EDTA对木聚糖酶酶活抑制作用较明显,酶活分别为空白对照的61.96%和59.56%.如图5所示的其它几种离子对木聚糖酶酶活都有不同程度的促进作用,木聚糖酶展现了良好的适应性.
3 结论
C.thermocellum能产生纤酶小体直接利用未经任何预处理的造纸污泥发酵产乙醇,反应器培养时最高乙醇产量达到7.41 g/L.不同底物对其代谢产物和纤酶小体的主要成分纤维素酶及木聚糖酶酶活也有影响.其纤维素酶最适温度为60℃,最适pH值为5.5;木聚糖酶的最适温度为70℃,在pH=5.5~8.0范围内都展现了良好的适应性.下一步研究的方向是通过基因工程手段敲除C.thermocellum的其它代谢支路提高乙醇含量以及将纤酶小体组分在其它生长周期短的菌种里进行表达.
[1] Lynd L R,Weimer P J,van Zyl W H,et al.Microbial cellulose utilization:fundamentals and biotechnology[J].Microbiology and Molecular Biology Reviews,2002,66(3):506-577.
[2] Cardona C A,Sanchez O J.Fuel ethanol production:process design trends and integration opportunities[J].Bioresource Technology,2007,98(12):2415-2457.
[3] Gold N D,Martin V J J.Global view of the Clostridium thermocellum cellulosome revealed by quantitative proteomic analysis[J].Journal of Bacteriology,2007,189(19):6787-6795.
[4] Islam R,Cicek N,Sparling R,et al.Effect of substrate loading on hydrogen production during anaerobic fermentation by Clostridium thermocellum 27405 [J].Applied Microbial and Cell Physiology,2006,72(3):576-583.
[5] Wilson D B.Evidence of a novel mechanism of microbial cellulose degradation [J].Cellulose,2009,16(4):723-727.
[6] Shoham Y,Lamed R,Bayer E A.The cellulosome concept as an efficient microbial strategy for the degradation of insoluble polysaccharides [J].Trends in Microbiology,1999,7(7):275-281.
[7] Raphael Lamed,Edward A Bayer.Contact and cellulolysis in Clostridium thermocellum via extensile surface organelles[J].Biomass and Bioenergy,1985,15(1):72-43.
[8] Thomas K N G,Arie B,Zeikus J G.Ethanol production by thermophilic bacteria:fermentation of cellulosic substrates by cocultures of Clostridium thermocellum and Clostridium thermohydrosulfuricum [J].Applied Environmental Mi-crobiology,1981,41(6):1337-1343.
[9] Hogsett D A,Ahn H J,Bernardez T D,et al.Direct microbial conversion:prospects,porogress,and obstacles[J].Applied Biochemistry and Biotechnology,1992,34/35(1):527-541.
[10] Johnson E A,Sakajoh M,Halliwell G,et al.Saccharification of complex cellulosis substrates by the cellulase system from Clostridium thermocellum [J].Applied Environmental Microbiology,1982,43(5):1125-1132.
[11] Williams T I,Lynn B C,Combs J C,et al.Proteomic profile changes in membranes of ethanol-tolerant Clostridium thermocellum[J].Applied Microbiology and Biotechnology,2007,74(2):422-432.
[12] Harish K R Y,Srijana M,Madhusudhan R D,et al.Coculture fermentation of banana agro-waste to ethanol by cellulolytic thermophilic Clostridium thermocellum CT2 [J].African Journal of Biotechnology,2010,9(13):1926-1934.
[13] 曲小爽,顿宝庆,郭明鸣,等.一株嗜热纤维素分解菌的分离及其酶学性质的初探[J].中国农业科技导报,2009,11(1):124-128.Qu Xiao-shuang,Dun Bao-qing,Guo Ming-ming,et al.Initial studies on isolation of a thermophilic cellulosedegrading bacterial and its enzymology characteristics[J].Journal of Agricultural Science and Technology,2009,11(1):124-128.
[14] 江丹,李旭辉,朱明军.造纸污泥同步糖化发酵产乙醇的研究[J].食品与发酵工业,2009,35(11):32-35.Jiang Dan,Li Xu-hui,Zhu Ming-jun.Investigation on the production of ethanol from paper sludge by simultaneous saccarification and fermentation [J].Food and Fermentation Industries,2009,35(11):32-35.
[15] 刘小杰.康氏木霉纤维素酶的发酵及其对稻草降解利用的初探[D].杭州:浙江大学生物系统工程与食品科学学院,2003:1-35.
[16] 丁强.饲用木聚糖酶的研究进展及应用[J].中国饲料,2010,3(2):22-25.Ding Qiang.Research progress and application of xylanase in feed industry [J].China Feed,2010,3(2):22-25.
[17] Belaich J P,Tardif C,Belaich A,et al.The cellulolytic system of Clostridium cellulolyticum [J].Journal of Biotechnology,1997,57(1/2/3):3-14.
[18] Hardy L W,Poteete A R.Re-examination of the role of Asp20 in catalysis by bacteriophage T4 lysozyme[J].Biochemistry,1991,30(39):9457-9463.

