葡聚糖-卵粘蛋白亲和超滤载体的制备及应用*
李存芝 黄雪松 唐书泽 李琳 张广文 胡长鹰
(1.暨南大学 食品科学与工程系,广东 广州510632;2.华南理工大学轻工与食品学院,广东广州510640)
亲和-膜过滤技术也称作亲和错流过滤,由Adamsi-Medda等[1]于 1981年提出,它将水溶性或非水溶性高分子亲和载体与目标蛋白进行特异性可逆反应,然后用膜进行错流过滤,兼具生物亲和与膜分离的优势.目前研究非水溶性亲和载体的较多,即通过对滤膜改性,使其具有亲和吸附目标物质的特性,宜于操作[2-3].水溶性亲和载体与目标分子在均相中吸附和洗脱,反应速度快,达到平衡时间短,与非水溶性亲和载体比较具有显著优势.目前相关的报道集中在水溶性载体的应用[4-8],在载体的制备及机理上的较少.
文献[9]中以合成的相对分子质量为10万的聚丙烯酰胺为水溶性载体分离胰蛋白酶.考虑到聚丙烯酰胺的潜在不安全性且卵粘蛋白是胰蛋白酶的抑制剂[10],本研究采用对人体安全的相对分子质量为200万的水溶性葡聚糖,对其活化后连接卵粘蛋白为配基,制备卵粘蛋白-葡聚糖亲和载体,以卵粘蛋白作为胰蛋白酶的特异抑制剂,分析载体活化过程的相关机理,并将制备的亲和超滤载体应用于胰蛋白酶的纯化.
1 实验材料与方法
1.1 主要材料和设备
葡聚糖 T2000(相对分子质量为200万).卵粘蛋白、胰凝乳蛋白酶(结晶纯),均购自Sigma公司;胰蛋白酶(1∶250,即每克酶制剂含250个酶活力单位),购自上海伯奥生物科技公司;其它试剂为国产分析纯.
UV-2102 PC型紫外-可见分光光度计,由上海UNICO公司生产;傅里叶变换红外光谱仪Vector33,由德国Bruker公司生产;WZZ-1SS数字式自动糖度旋光仪,由上海物理光学仪器厂生产;搅拌式超滤杯(450mL),由北京中科院膜技术开发中心生产;聚偏氟乙烯(PVDF)超滤膜,截流相对分子质量为10万、14万,由中国科学院上海原子核研究所生产;ALPHA2-4真空冷冻干燥机,由德国Christ公司生产.
1.2 亲和载体的制备及定量分析
在配料杯中加入葡聚糖T2000和氢氧化钠,使葡聚糖含量达到4%(质量分数),氢氧化钠浓度达到0.4mol/L,磁力搅拌器搅拌使溶解完全,加入4%(体积分数)的环氧氯丙烷,搅拌分散均匀;将料液置于60℃恒温摇床中避光反应2h;反应液用截留相对分子质量为10万的PVDF膜超滤除去溶液中剩余的环氧氯丙烷、氢氧化钠小分子,冷冻干燥得活化葡聚糖.膜截留物先用蒸馏水洗至pH=8.0,再用pH=9.5的碳酸钠-碳酸氢钠缓冲液清洗,将卵粘蛋白溶解在上述滤膜截留液中,使卵粘蛋白含量为6g/L,在40℃恒温摇床中避光反应24 h;反应后的溶液用截留相对分子质量为14万的PVDF膜除去未被偶联的卵粘蛋白,真空冷冻干燥,获得葡聚糖-卵粘蛋白水溶性亲和超滤载体.
胰蛋白酶和胰凝乳蛋白酶活力的测定分别采用以 N-苯甲酰-L-精氨酸乙酯(BAEE)、N-乙酰-L-酪氨酸乙酯ATEE为底物的酶活力测定法[11].卵粘蛋白配基密度采用考马斯亮蓝G-250染色紫外吸收法在595nm 处测定[11].
1.3 载体的光谱分析
1.3.1 紫外-可见光吸收光谱分析
分别配制一定浓度的葡聚糖、活化葡聚糖、葡聚糖-卵粘蛋白亲和超滤载体,以蒸馏水为空白,在200~500nm波长范围内进行扫描测试[12].
1.3.2 红外光谱分析
分别取约0.2g干燥的样品(葡聚糖、活化葡聚糖、葡聚糖-卵粘蛋白亲和超滤载体)与200 mg KBr粉末混匀,研磨后,抽真空10min,压片,在波数4000~500cm-1范围内进行测试.
2 结果与讨论
2.1 葡聚糖载体的活化及分析
葡聚糖载体需要经过活化才能与卵粘蛋白配基进行偶联形成亲和载体.其中卵粘蛋白是胰蛋白酶的特异抑制剂,其特异吸附胰蛋白酶后,再通过洗脱,可实现胰蛋白酶的分离纯化.
环氧氯丙烷活化法简便易行[13],容易操作,毒性低.含有羟基的载体常采用该方法活化.活化时葡聚糖分子链上产生能与卵粘蛋白结合的活化基团,活化过程中葡聚糖还能产生交联反应,增加了载体的滤膜截留率[6].
本研究采用环氧氯丙烷活化葡聚糖T2000,结合红外光谱(IR)和紫外-可见光谱等分析方法,阐述活化过程的相关机理.
2.1.1 活化载体的红外光谱
图1为葡聚糖T2000与活化的葡聚糖T2000的IR谱图.活化后的葡聚糖在1272 cm-1和870 cm-1处的吸收峰明显增强,这2处为环氧基的特征吸收峰,说明活化葡聚糖中存在环氧基;此外,在1649cm-1处出现羧酸离子的特征吸收峰.因此活化后的葡聚糖T2000上不仅含有环氧基,还含有羧基.
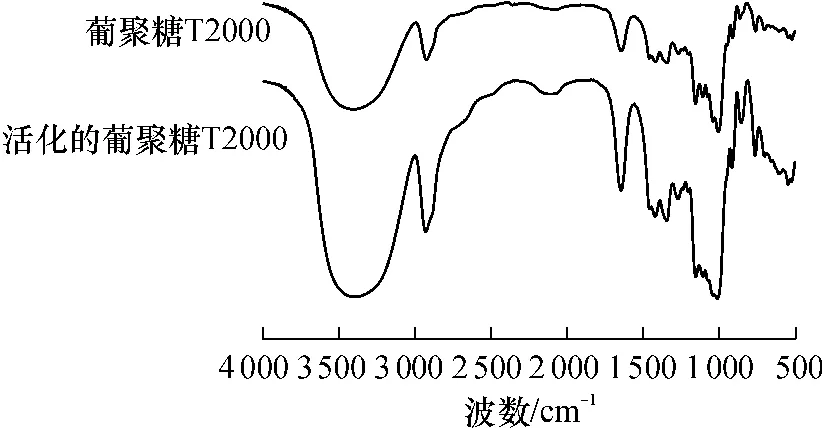
图1 葡聚糖T2000与活化的葡聚糖T2000的IR谱图Fig.1 IR spectra of dextran T2000 and activated dextran T2000
2.1.2 活化载体的紫外-可见吸收光谱
图2是葡聚糖 T2000和活化后葡聚糖T2000的紫外-可见(UV-Vis)吸收光谱.从图2可以看出,葡聚糖的紫外吸收在224nm,其最大吸光值仅为0.16.经活化后的葡聚糖的紫外最大吸收变为205nm左右的强吸收,最大吸光值达1.71,这是由于活化的葡聚糖上产生的羧基发生π→π*跃迁从而表现出的紫外强吸收[12].环氧基团属π→σ*跃迁,其吸收波长小于190 nm,超出紫外检测波长范围,因此在图2(b)的活化葡聚糖紫外光谱图上看不到环氧基团的明显吸收峰.
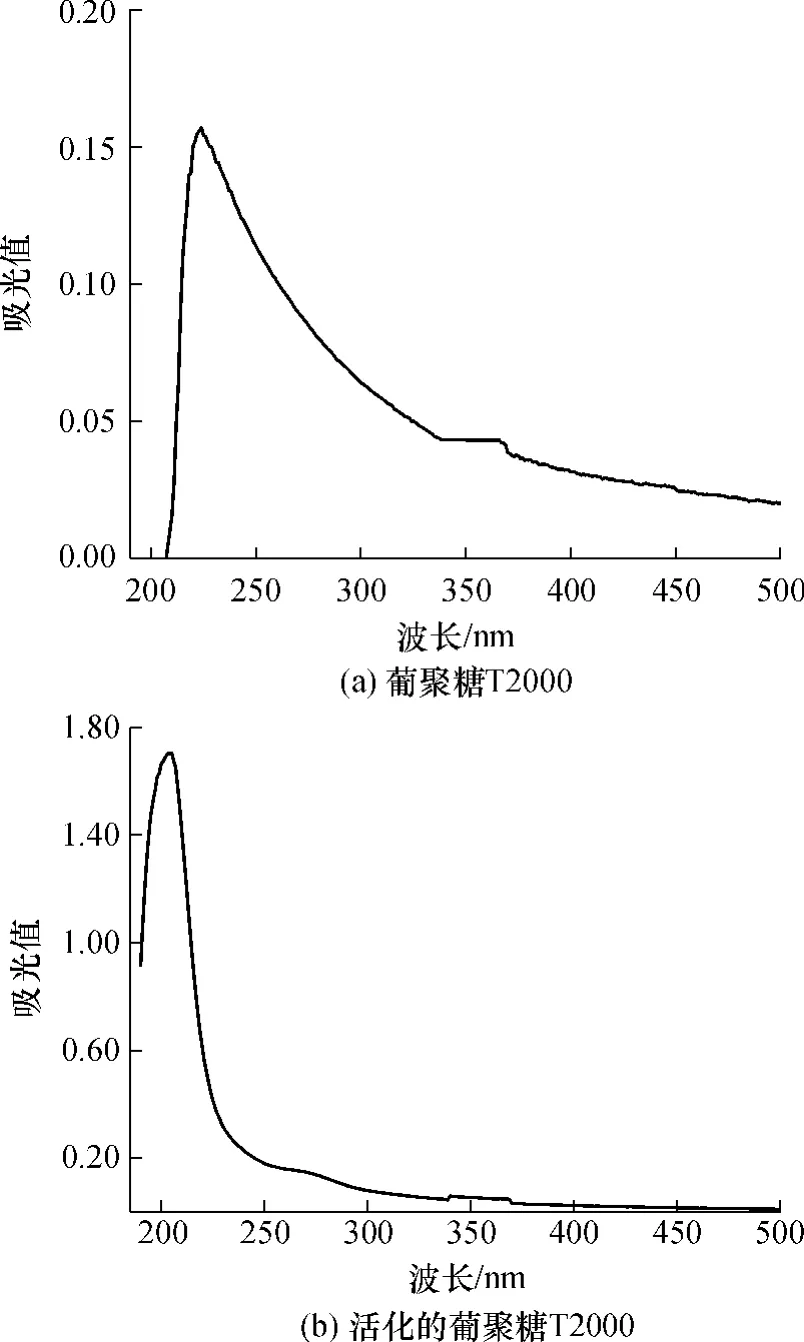
图2 葡聚糖T2000与活化的葡聚糖T2000的UV-Vis光谱Fig.2 UV-Vis spectra of dextran T2000 and activated dextran T2000
2.1.3 葡聚糖载体环氧活化反应机理分析
环氧氯丙烷具有三元环结构,以弯曲键相互连接,分子中存在一种张力环,极易与多种试剂反应,被用在有机合成中合成多种化合物;环氧氯丙烷中氯原子的电负性很强,诱导效应使C—Cl的电子偏向卤原子,碳上带有部分正电荷,容易受到带负电荷的亲和试剂进攻;在碱性的条件下,葡聚糖的羟基呈弱酸性,形成负离子游离基[13].本研究认为负离子游离基作为亲核试剂进攻环氧氯丙烷,由于环氧氯丙烷中处于三元环的两个碳原子所取的空间结构不同,负离子亲核试剂选择进攻取代基较少的环碳原子,以减少空间位阻效应;当葡聚糖负离子游离基进攻环氧氯丙烷时,环氧氯丙烷环上的C—O断裂,同时葡聚糖负离子游离基上的O与环氧氯丙烷上的C形成C—O,进行双分子亲核取代反应(SN2),其反应历程如下:
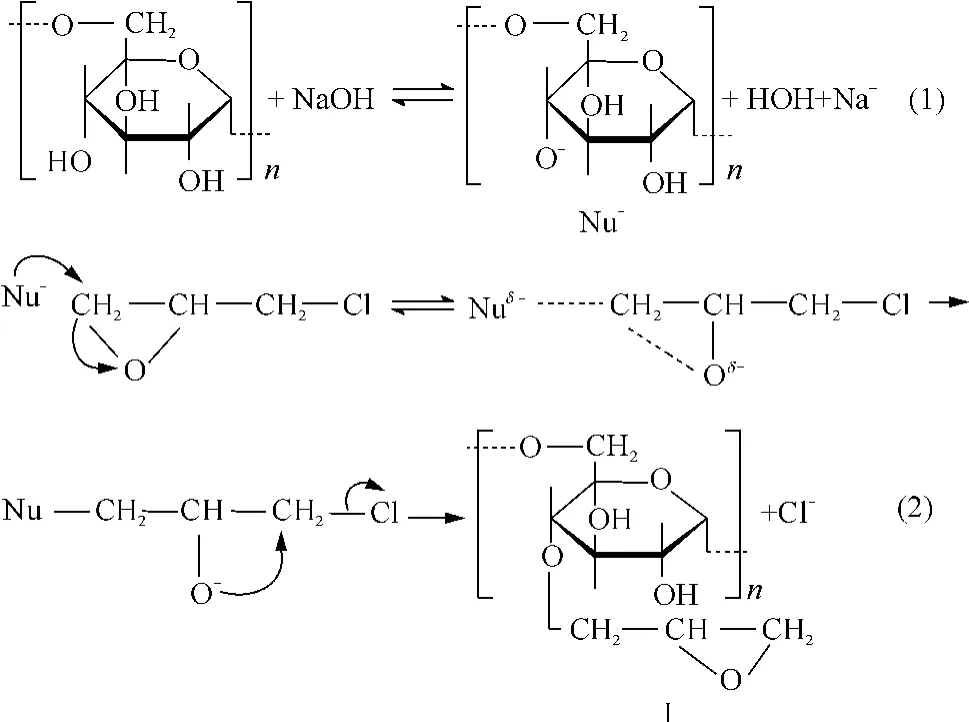
图3为SN2反应中的势能变化示意图,当反应物形成过渡态时,需要吸收活化能ΔEa=Ea1-Ea2,其中Ea1为过渡态势能最高点,Ea2为反应物势能.过渡态为势能最高点,即最难达到的最高能量状态,一旦形成过渡态,即释放能量,形成产物,反应物与产物之间的能量差为ΔH=H1-H2.过渡态时亲和试剂与环氧氯丙烷上碳原子的键尚未完全形成,但亲和试剂上的一对电子已与碳原子共享,离去基团与碳原子之间的键尚未完全断裂,碳原子上的部分负电荷已转移给离去基团[13].
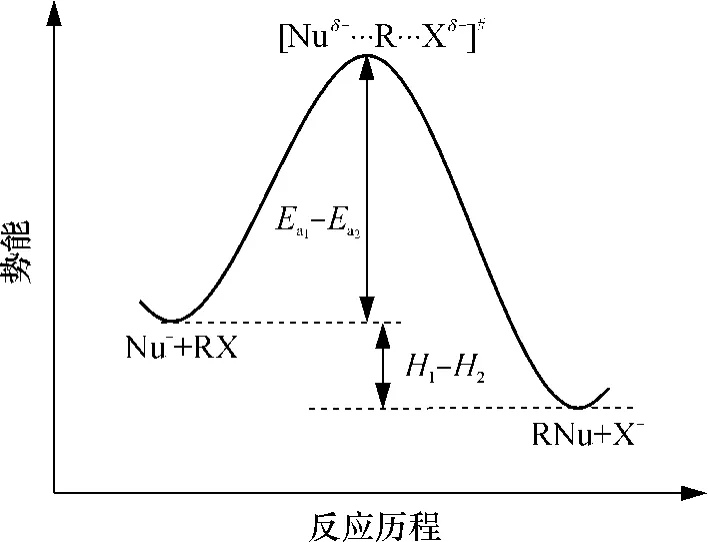
图3 Sn2反应中的势能变化Fig.3 Variation of potential energy in Sn2 reaction
连接有环氧基团的葡聚糖Ⅰ可以与碱性条件下形成的葡聚糖负离子继续反应[13],形成交联结构,如反应式(3)所示.交联分子还可以进一步被环氧氯丙烷活化,形成更大分子的葡聚糖交联分子,其反应历程同样是是双分子亲核取代历程(SN2).

在活化和交联过程中,葡聚糖分子也可被氧化形成羧基,其可能的反应为
经环氧氯丙烷活化后的交联葡聚糖载体分子上既存在羧基,还存在未发生交联及水解反应的环氧基.环氧基活泼,不稳定,极易化学分解.为了在偶联配基过程中很好地利用环氧基活性基团,活化后的葡聚糖T2000活化载体应尽快进行亲和配基的偶联反应.配基卵粘蛋白含有—NH2,可以与环氧基和羧基发生偶联反应,形成水溶性亲和载体.
2.2 活化载体偶联配基形成的卵粘蛋白亲和载体
2.2.1 亲和载体的紫外-可见吸收光谱
图4 亲和载体的UV-Vis光谱Fig.4 UV-Vis spectra of affinity escort
图4是以卵粘蛋白为配基的亲和-超滤载体的紫外-可见吸收光谱.在280nm出现明显的蛋白吸收峰,说明亲和载体中含有卵粘蛋白亲和配基.
2.2.2 亲和载体的红外光谱
图5示出了葡聚糖-卵粘蛋白亲和载体与葡聚糖的红外光谱.一个明显的特征是葡聚糖-卵粘蛋白亲和载体在1514cm-1处出现一个新峰,为明显的氨基酸特征吸收,证明亲和载体中含有卵粘蛋白,1635cm-1和1514cm-1之间吸收峰明显增加.在765 ~525 cm-1、2340 cm-1处吸收明显弱化,甚至消失.这些说明卵粘蛋白在葡聚糖上取代的位置不同,造成有的特征峰消失,有的特征峰加强或新的特征峰出现.
图5 亲和载体与葡聚糖T2000的IR谱图Fig.5 IR spectra of dextran T2000 and affinity escort
2.3 葡聚糖-卵粘蛋白亲和载体在胰蛋白酶纯化中的应用
以胰蛋白酶和胰凝乳蛋白酶的混合物系为研究对象,胰蛋白酶的相对分子质量为23400,而胰凝乳蛋白酶的相对分子质量为22500,由于二者的理化性质相似,相对分子质量相近,常规超滤分离很难将二者彼此分离开.本研究利用卵粘蛋白亲和超滤载体选择性地吸附胰蛋白酶,在亲和超滤过程中实现胰蛋白酶的分离纯化.
图6示出了4℃时卵粘蛋白亲和载体亲和吸附胰蛋白酶的吸附等温线,拟合所得Qm为27.80mg/g(即每克亲和载体最大吸附胰蛋白酶量为27.80mg),解吸平衡常数Kd为15.10 μg/mL.卵粘蛋白亲和载体亲和吸附胰蛋白酶的Langmuir吸附等温方程为
式中:q为胰蛋白酶在亲和载体上的吸附量,mg/g;ρ为溶液中胰蛋白酶的浓度,μg/mL.
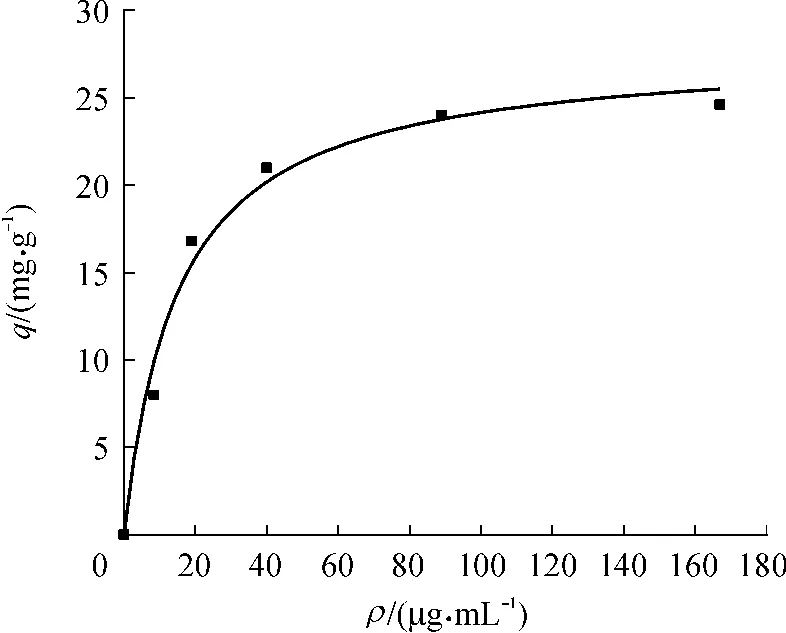
图6 亲和载体对胰蛋白酶的吸附等温线Fig.6 Adsorption isotherm of affinity escort on trypsin
实验中通过对胰蛋白酶的特异吸附及适宜的吸附洗脱条件的选择,实现胰蛋白酶的分离纯化.经亲和纯化后,胰蛋白酶纯化倍数为45,回收率达80%.
胰蛋白酶与载体上亲和配基的作用是一种复杂的生物现象,除具备“锁钥”关系外,还需存在特殊的相互作用力,如氢键、静电、疏水等相互作用[14].此外,当蛋白质分子发生亲和结合时,蛋白质的分子形态往往发生变化,这些因素导致亲和作用具有高度的特异性[14].本实验利用这种特异性通过亲和与超滤的结合将相对分子质量相近的胰蛋白酶与胰凝乳蛋白酶分离开来.
3 结语
本研究以胰蛋白酶的特异抑制剂卵粘蛋白为配基,合成了卵粘蛋白-葡聚糖亲和超滤载体,分析认为,载体环氧氯丙烷活化反应机理为双分子的亲核反应历程(SN2).以胰蛋白酶和胰凝乳蛋白酶的混合物系为对象,以胰蛋白酶的纯化为目标,利用合成的亲和载体对胰蛋白酶进行纯化,结果表明,亲和载体对胰蛋白酶的吸附符合Langmuir吸附等温线方程,纯化倍数为45,活性回收率为80%.对亲和吸附的机理分析认为,由于亲和分子对的锁钥关系及特殊的相互作用力如静电引力等因素共同作用导致亲和作用具用高度的特异性.
[1] Adamsi-Medda D,Nguyen Q T,Dellacherie E.Biospecific ultrafiltration:a promising purification technique for proteins[J].Journal of Membrane Science,1981,9(3):337-342.
[2] Suma Rao,Andrew L Zydney.High resolution protein separations using affinity ultrafiltration with small charged li-gands[J].Journal of Membrane Science,2006,280(9):781-789.
[3] Sumana Mukherjee,Debashis Roy,Pinaki Bhattacharya.Comparative performance study of polyethersulfone and polysulfone membranes for trypsin isolation from goat pancreas using affinity ultrafiltration[J].Separation and Purification Technology,2008,60(3):345-351.
[4] Kenzo Kanemaru,Tatsuya Oshima,Yoshinari Baba.Selective recovery of histidine-containing dipeptides based on metal affinity interactions using chemically modified dextran in combination with ultrafiltration [J].Reactive and Functional Polymers,2010,70(2):103-109.
[5] Edwie F,Li Yi,Chung T S.Exploration of regeneration and reusability of human serum albumin as a stereoselective ligand for chiral separation in affinity ultrafiltration[J].Journal of Membrane Science,2010,362(10):501-508.
[6] 朱家文,曹学君,武斌,等.水溶性亲和超滤载体的制备和应用[J].华东理工大学学报,1999,25(6):563-566.Zhu Jia-wen,Cao Xue-jun,Wu Bin,et al.Preparation of dextran-based water soluble macroligand and its application[J].Journal of East China University of Science and Technology,1999,25(6):563-566.
[7] Mustafa Teke,Azmi Telefoncu.Purification of bovine pancreatic phospholipase A2 by an affinity ultrafiltration technique[J].Separation and Purification Technology,2008,63(11):716-720.
[8] Jonathan Romero,Andrew L Zydney.pH and salt effects on chiral separations using affinity ultrafiltration[J].Desalination,2002,148(9):159-164.
[9] Luong J H T,Male K B,Nguyen A L.Synthesis and characterization of a water-soluble affinity polymer for trypsin purification[J].Biotechnology and Bioengineering,1988,31(5):439-446.
[10] 方林求,褚楠,薛静.鸡卵清蛋白对蛋白酶抑制作用的研究[J].中国生化药物杂志,1995,16(6):261-265.Fang Lin-qiu,Chu Nan,Xue Jing.Study on inhibition of proteinase activity by chicken ovalbumin[J].Chinese Journal of Biochemical Pharmaceutics,1995,16(6):261-265.
[11] 张龙翔.生化实验方法和技术[M].北京:高等教育出版社,1997:170-186.
[12] 彭师奇.药物的波谱解析[M].北京:北京医科大学出版社,2002:55-78.
[13] 岳保珍,李润涛.有机合成基础[M].北京:北京医科大学出版社,2000:15-20.
[14] 孙彦.生物分离工程[M].北京:化学工业出版社,1998:193.

