虎杖白藜芦醇合酶基因转化拟南芥的研究*
柳忠玉 庄楚雄 生书晶 邵利 赵树进
(1.华南理工大学生物科学与工程学院,广东广州510006;2.华南农业大学 生命科学学院,广东广州510642;3.广州军区广州总医院,广东广州510010)
白藜芦醇是含有萜类结构的非黄酮类多酚化合物,化学名称为3,5,4'-三羟基二苯乙烯.它是许多植物受到生物或非生物胁迫(如真菌感染、紫外照射等)时产生的一种植物抗毒素.白藜芦醇在自然界主要存在4种形式:顺式、反式白藜芦醇以及顺式、反式白藜芦醇苷.白藜芦醇以及白藜芦醇苷具有广泛的生物学功能,包括抗肿瘤[1]、保护心血管系统[2]、抗氧化[3]、抗菌等[4].
白藜芦醇广泛存在于葡萄、松树、虎杖、决明子和花生等天然植物或果实当中,到目前为止至少已在21科、31属的72种植物中被发现,其中葡萄、虎杖、花生是白藜芦醇含量较高的3种植物.虎杖(Polygonum cuspidatum Sieb.et Zucc.)是蓼科多年生草本植物,根或根茎入药;与葡萄、花生相比较,虎杖中白藜芦醇和白藜芦醇苷的总含量最高[5],其根茎中白藜芦醇苷含量高达 1750μg/g(干重)[6].
白藜芦醇合酶(RS)(EC 2.3.1.95),是白藜芦醇合成代谢途径中最后一个起作用的关键酶,也是合成途径中唯一必需的合成酶,以4-香豆酰辅酶 A和丙二酰辅酶A为底物合成白藜芦醇.白藜芦醇合酶基因在植物中往往以基因家族存在,例如基因组测序显示,葡萄中的白藜芦醇合酶基因高达43个,其中20个已经被表达[7].为了提高植物抗病性或提高目标植物中白藜芦醇含量,许多研究者将分离到的白藜芦醇合酶基因转入不含有该基因的植物中,其中用于植物转化的最常用的基因是来源于葡萄的Vst1 和 Stsy基因[8],另外花生的 AhRS 基因[9]、高粱的SbSTS1基因[10]、爬山虎的STS基因也被成功用于转化实验[11].由于植物次生代谢的复杂性和种属特异性,在转基因植物中一些目标基因的超表达可能并未提高预期代谢产物的合成量,例如在转基因水稻[12]、苹果中没有检测到白藜芦醇或白藜芦醇苷[13].虎杖白藜芦醇合酶基因 PcRS已经被分离(GenBank登录号:DQ900615),但是将PcRS基因导入植物并成功合成白藜芦醇或白藜芦醇苷的研究鲜见报道;本研究将该基因置于花椰菜花叶病毒CaMV 35S启动子下,构建植物转化载体,通过农杆菌介导转化拟南芥,检测该基因在转基因植物中的表达以及终产物,为虎杖白藜芦醇合酶基因功能的深入研究奠定基础.
1 材料与方法
1.1 材料、菌种和试剂
拟南芥(Arabidopsis thaliana)为哥伦比亚生态型(Col).虎杖采集于广州中医药大学苗圃.大肠杆菌菌株 DH10B、农杆菌 LBA4404菌株、克隆载体pUC19、植物表达载体pCAMBIA1380由华南农业大学植物基因组学与生物技术重点实验室保存.限制性内切酶、连接酶等为TaKaRa公司产品.地高辛标记检测试剂盒购自罗氏公司.
1.2 植物表达载体的构建
首先将组成型表达的35S启动子连接在pUC19的EcoR I/Kpn I位点,得到质粒pUC19-35S.其次,依据PcRS cDNA开放阅读框设计引物P1(5'CCGGTACCATGGCAGCTTCAACTGAAG3')和P2(5'CCGGATCCTTAAATGATGGGCACACTTC3'),以虎杖嫩叶cDNA为模板扩增PcRS基因,扩增片段大小为1167bp.聚合酶链式反应(PCR)条件为:94℃ 预变性2min;94℃变性30s,60℃退火 30s,72℃ 延伸30s,共30个循环;最后72℃ 延伸10 min.将PCR产物连接到pUC19-35S质粒的Kpn I/BamH I位点,得到pUC19-35S-PcRS.再对pUC19-35S-PcRS进行EcoR I/BamH I双酶切,把酶切片段(包括35S启动子和PcRS基因)连接到载体pCAM1380上,得到重组质粒pCAMBIA1380-35S-PcRS(见图1).测序验证插入片段的序列正确后用于转化实验.
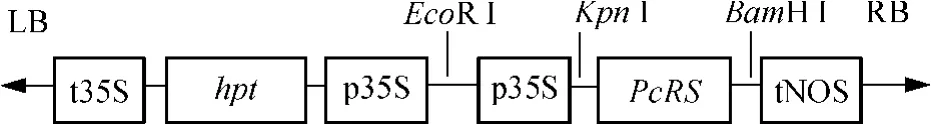
图1 pCAMBIA1380-35S-PcRS构建示意图Fig.1 Schema of pCAMBIA1380-35S-PcRS structure
1.3 花序浸泡法转化拟南芥和转化子筛选
拟南芥种子播种于盛满培养土的培养杯,再置于光照培养箱中,培养条件为16h光照/8h黑暗,生长约4周后,拟南芥植株开始开花,剪去已开花的主茎,使其顶端优势受到抑制而抽出大量侧枝,侧枝开花时用于花序浸泡法转化拟南芥[14].制备好含pCAMBIA1380-35S-PcRS的农杆菌菌液10 mL,在转化前1d,转入含卡那霉素50 μg/mL的液体培养基过夜;第2天,振荡培养至吸光值D(600)在1.2~1.6之间时取出使用.室温3000g离心10 min,弃上清,沉淀悬浮于相应体积的渗透培养基(MS培养基+蔗糖5%+Silwet L-77200 μL/L)中,菌液吸光值D(600)控制在0.8左右.将农杆菌悬浮液倒在小烧杯中,将长有拟南芥的培养杯倒扣其上,保证莲座叶以上部分浸没于液体中,浸泡10min后取出植株,横放在塑料盘中,用保鲜膜封好以保持湿度,放在恒温室培养.第2天竖直培养,仍用保鲜膜保持湿度2~3d.根据情况可再浸染一次.培养3~4周待种子成熟后收取种子.收获的T0代种子经表面消毒后接种到筛选培养基(MS培养基+3% 蔗糖+0.8%琼脂+20mg/L潮霉素)上筛选阳性转化株.对经潮霉素筛选获得的抗性植株进行潮霉素基因PCR检测,PCR引物为P3(5'CGCCGATGGTTTCTACAA3')和P4(5'-GGCGTCGGTTTCCACTAT 3').扩增条件为:94℃预变性2min;94℃变性30 s,58℃退火30 s,72℃延伸30s,共28个循环;最后72℃ 延伸10min,预期扩增片段大小为500bp.
1.4 Southern杂交检测
对经PCR鉴定为阳性的植株进行Southern杂交检测.利用十六烷基三甲基溴化铵(CTAB)法提取叶片基因组DNA,基因组DNA 10μg经EcoR I酶切过夜,0.8% 琼脂糖凝胶电泳分离DNA.电泳结束后,把凝胶浸在变性液(0.5 mol/L NaOH,1.5mol/L NaCl)中轻轻晃动15 min,重复1次;然后把凝胶浸在中和液中(0.5 mol/L三羟甲基氨基甲烷(Tris)-HCl,1.5mol/L NaCl)轻轻晃动 15min,重复 1 次;在20倍柠檬酸钠缓冲液(SSC)中平衡凝胶至少10min.再以20倍SSC溶液为印迹转移缓冲液,利用毛细管虹吸印迹法将 DNA转移至尼龙膜上,紫外交联5min固定DNA.以PcRS cDNA为探针模板,用地高辛随机引物标记试剂盒进行标记.42℃预杂交1 h后,加入探针杂交16 h.洗膜条件:在65℃用2倍SSC溶液(含0.1%十二烷基磺酸钠)漂洗5min,重复1次;然后用0.1倍SSC溶液(含0.1%十二烷基磺酸钠)漂洗15min,重复1次,最后用地高辛检测试剂盒检测杂交信号.
1.5 Northern杂交检测
在转基因植株T3代的纯合子株系和野生型幼苗生长两周后,提取拟南芥幼苗总RNA,用甲醛变性凝胶进行电泳,之后将凝胶中的RNA转移至尼龙膜上,交联5min固定RNA,同样以PcRS cDNA为制备探针的模板,探针标记及杂交、检测方法与Southern杂交相同.
1.6 HPLC法测定提取物含量
转基因植株T3代的纯合子品系和野生型幼苗生长两周后,取拟南芥幼苗0.3g,经液氮研磨后,加入3mL 80%(体积分数)甲醇避光浸提12 h后,待测.色谱柱为SunFireTM C18(4.6 mm×250.0 mm),流动相为乙腈和水,其体积比为25∶75,流速为1.0mL/min,检测波长为306nm,柱温为25℃.
2 结果与分析
2.1 PcRS基因转化拟南芥表达载体检测
35S启动子大小为794bp,PcRS cDNA开放阅读框序列长1167bp,则总的插入片段大小为1961bp.用限制性内切酶BamH I和EcoR I双酶切质粒pCAMBIA1380-35S-PcRS,能够切出与插入片段大小一致的片段(见图2),说明成功构建了带有PcRS基因的植物表达载体.
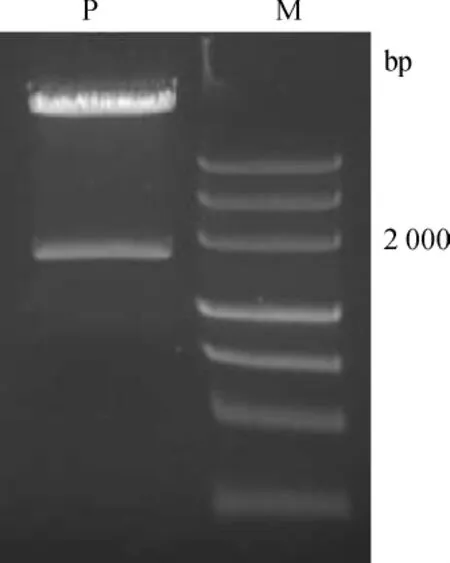
图2 质粒pCAMBIA1380-35S-PcRS鉴定Fig.2 Identification of plasmid pCAMBIA1380-35S-PcRS M—DNA标准物;P—pCAMBIA1380-35S-PcRS
2.2 转基因植株的筛选与PCR鉴定
取从抗性拟南芥植株叶片中提取的DNA作为扩增模板,用潮霉素基因特异引物P3和P4进行PCR扩增,电泳结果(见图3)表明,所检测的8个株系中有7个株系(2-8)约在500 bp处扩增到潮霉素基因片段带,而未转化拟南芥DNA样品未见目的带,初步验证这7个株系为阳性植株.

图3 T0代转基因株系的PCR鉴定Fig.3 PCR analysis in T0transgenic plants
2.3 外源基因整合与表达
对经过PCR初步验证的阳性植株做Southern杂交检测,结果(见图4)发现:所检测的7个株系中,有4个株系(3,6-8)有明显的杂交信号,PcRS基因拷贝数介于1至4之间,株系7为单拷贝整合,株系6和8为3拷贝,株系3为4拷贝,说明PcRS基因已经整合到拟南芥基因组中;其余3个株系无杂交信号.
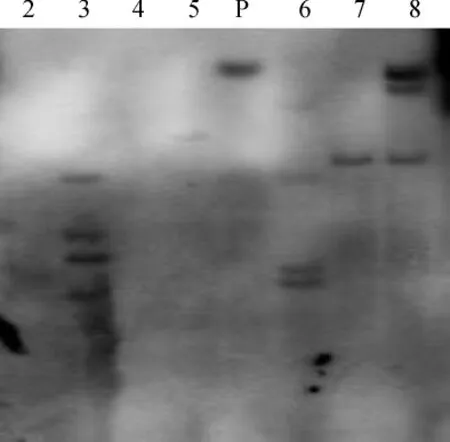
图4 Southern blotting法检测转基因拟南芥T0代Fig.4 Southern blotting analysis of transgenic Arabidopsis thaliana T0lines
选择单拷贝整合株系7为研究对象,株系7的T0代成熟后收获T1代种子,潮霉素筛选T1代种子,未黄化植株成熟后收获T2代种子,T2代经筛选已经能够得到稳定遗传的T3代纯合子株系,编号为T3-7,然后对纯合的转基因株系进行表达分析.用Northern杂交检测外源基因在单拷贝转基因纯合系T3-7中的表达情况,结果(见图5)显示,外源PcRS基因已在转基因拟南芥中过量表达,而未转化拟南芥中没有杂交信号.
2.4 提取物含量
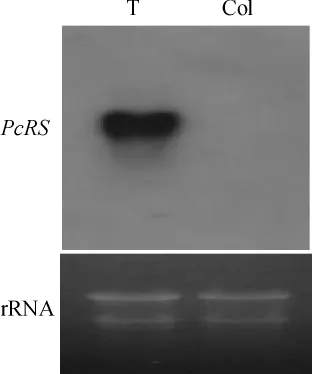
图5 Northern blotting法检测转基因拟南芥T3代Fig.5 Northern blotting analysis of transgenic Arabidopsis thaliana T3lines
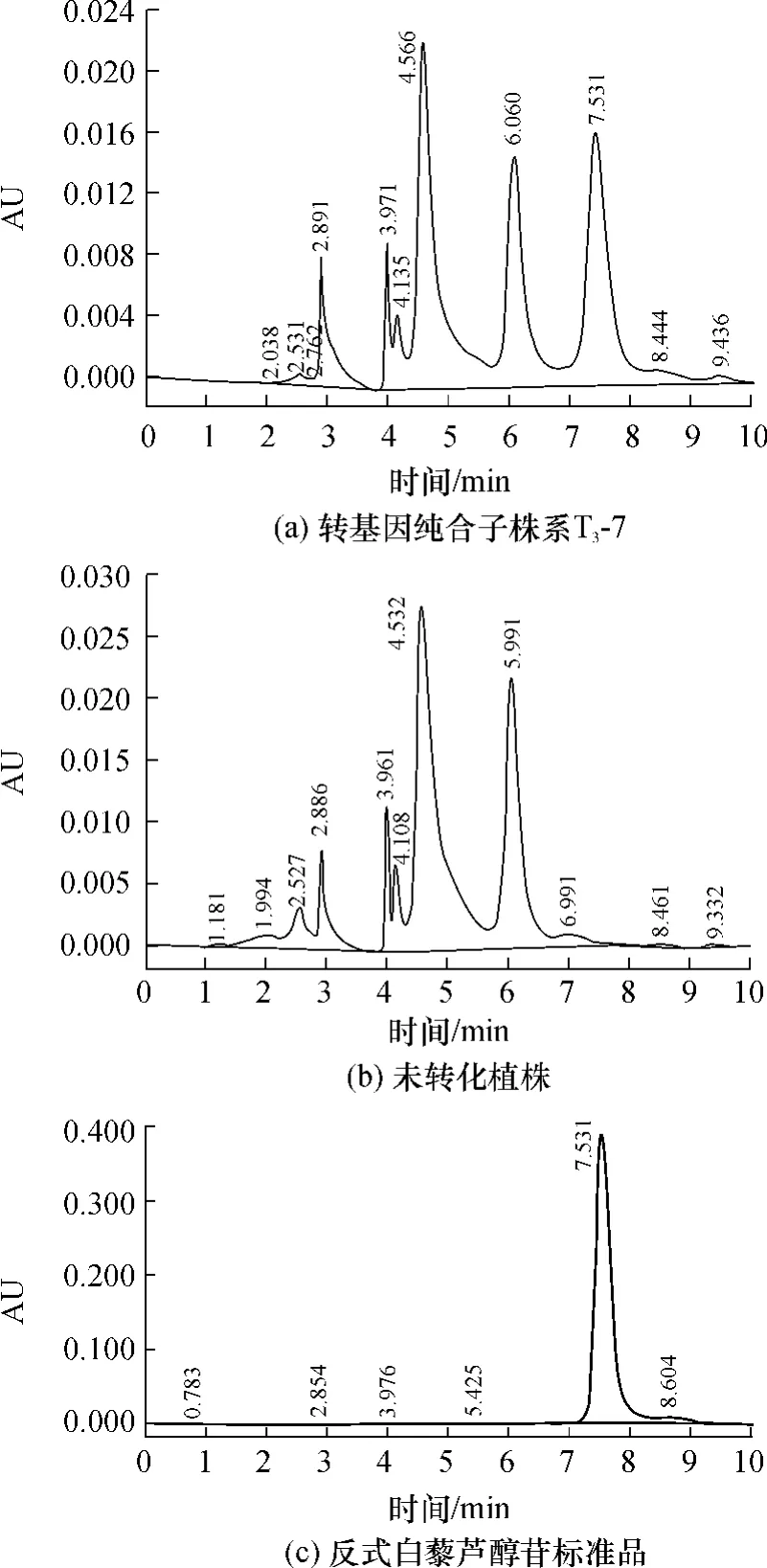
图6 转基因拟南芥叶中反式白藜芦醇苷的HPLC分析Fig.6 HPLC analysis of trans-piceid in the leaves of transgenic Arabidopsis thaliana
利用HPLC法检测转基因纯合子株系T3-7是否能生成白藜芦醇或白藜芦醇苷.对纯合子株系T3-7及非转基因拟南芥提取物进行色谱分析,发现T3-7产生明显新峰(见图6(a)),保留时间为7.5min,与反式白藜芦醇苷对照品(见图6(c))相符,而未转化植株没有此峰(见图6(b)),说明转基因拟南芥合成产物是白藜芦醇苷而不是白藜芦醇.进一步分析表明,转基因纯合子株系T3-7中反式白藜芦醇苷的含量为136μg/g(鲜重),干重为1813μg/g.
转基因纯合子株系T3-7中产生的是白藜芦醇苷而不是白藜芦醇,可能是由于植物体内糖基转移酶的作用[15],在转基因白杨[16]、番木瓜[17]、油菜中也发现了上述现象[18].白藜芦醇苷存在顺式和反式两种结构,本研究将PcRS基因转入拟南芥只检测到了反式白藜芦醇苷,而Yu等[10]将高粱SbSTS1转入拟南芥的主要代谢物是顺式白藜芦醇苷,这可能是由于拟南芥植物体内异构酶的作用.多年生虎杖根茎中白藜芦醇苷含量为 1750 μg/g(干重)[6],一年生虎杖根茎中白藜芦醇苷含量仅为26.88 μg/g(干重)[19],而本研究中生长两周的纯合子株系T3-7幼苗产生白藜芦醇苷的含量为1813 μg/g(干重),比一年生虎杖根茎中的含量高60多倍,这为反式白藜芦醇苷药理学研究提供了便利资源,具有潜在的研究应用价值.
3 结语
本研究将基因PcRS置于CaMV 35S启动子下,构建组成型表达植物转化载体,通过农杆菌介导转化拟南芥、潮霉素筛选和PCR鉴定初步得到阳性植株,Southern杂交结果进一步证实PcRS外源片断已经整合到拟南芥基因组中,Northern杂交证实外源基因在转基因拟南芥纯合子株系T3-7中实现了表达,HPLC法检测到终产物是反式白藜芦醇苷,其含量为136μg/g(鲜重),干重为1813μg/g.本研究结果表明PcRS基因在拟南芥中过量表达能促进反式白藜芦醇苷的合成,这为PcRS基因功能的深入研究奠定基础.下一步将对转基因株系进行抗病性研究,探讨PcRS是否能够提高转基因植株的抗病性.
[1] Fulda S,Debatin K.Extrinsic versus intrinsic apoptosis pathways in anticancer chemotherapy[J].Oncogene,2006,25(34):4798-4811.
[2] Mokni M,Limam F,Elkahoui S,et al.Strong cardioprotective effect of resveratrol,a red wine polyphenol,on isolated rat hearts after ischemia/reperfusion injury[J].Archives of Biochemistry and Biophysics,2007,457(1):1-6.
[3] Jefremov V,Zilmer M,Zilmer K,et al.Antioxidative effects of plant polyphenols:from protection of G protein signaling to prevention of age-related pathologies[J].Annals of New York Academy of Sciences,2007,1095(5):449-457.
[4] Chan M M.Antimicrobial effect of resveratrol on dermato-phytes and bacterial pathogens of the skin[J].Biochemical Pharmacology,2002,63(2):99-104.
[5] Burns J,Yokota T,Ashihara H,et al.Plant foods and herbal sources of resveratrol[J].Journal of Agriculture and Food Chemistry,2002,50(11):3337-3340.
[6] Yi T,Zhang H,Cai Z.Analysis of Rhizoma Polygoni Cuspidati by HPLC and HPLC-ESI/MS [J].Phytochemical Analysis,2007,18(5):387-392.
[7] Jaillon O,Aury J M,Noel B,et al.The grapevine genome sequence suggests ancestral hexaploidization in major angiosperm phyla[J].Nature,2007,449(7161):463-467.
[8] Delaunois B,Cordelier S,Conreux A,et al.Molecular engineering of resveratrol in plants[J].Plant Biotechnology Journal,2009,7(1):2-12.
[9] Lim J,Yun S,Chung I,et al.Resveratrol synthase transgene expression and accumulation of resveratrol glycoside in Rehmannia glutinosa [J].Molecular Breeding,2005,16(3):219-233.
[10] Yu C K,Lam C N,Springob K,et al.Constitutive accumulation of cis-piceid in transgenic arabidopsis overexpressing a sorghum stilbene synthase gene [J].Plant Cell Physiology,2006,47(7):1017-1021.
[11] Liu S,Hu Y,Wang X,et al.High content of resveratrol in lettuce transformed with a stilbene synthase gene of Parthenocissus henryana[J].Journal of Agriculture and Food Chemistry,2006,54(21):8082-8085.
[12] Stark-Lorenzen P,Nelke B.Transfer of a grapevine stilbene synthase gene to rice(Oryza sativa L.)[J].Plant Cell Reports,1997,16(10):668-673.
[13] Szankowski I,Briviba K,Fleschhut J,et al.Transformation of apple(Malus domestica Borkh.)with the stilbene synthase gene from grapevine(Vitis vinifera L.)and a PGIP gene from kiwi(Actinidia deliciosa)[J].Plant Cell Reports,2003,22(2):141-149.
[14] Clough S J,Bent A F.Floral dip:a simplified method for agrobacterium-mediated transformation ofArabidopsis thaliana[J].The Plant Journal,1998,16(6):735-743.
[15] Kobayashi S,Ding C K,Nakamura Y,et al.Kiwifruits(Actinidia deliciosa)transformed with a vitis stilbene synthase gene produce piceid(resveratrol-glucoside)[J].Plant Cell Reports,2000,19(9):904-910.
[16] Giorcelli A,Sparvoli F,Mattivi F,et al.Expression of the stilbene synthase(StSy)gene from grapevine in transgenic white poplar results in high accumulation of the antioxidant resveratrol glucosides[J].Transgenic Research,2004,13(3):203-214.
[17] Zhu Y J,Agbayani R,Jackson M C,et al.Expression of the grapevine stilbene synthase gene VST1 in papaya provides increased resistance against diseases caused by Phytophthora palmivora[J].Planta,2004,220(2):241-250.
[18] Husken A,Baumert A,Milkowski C,et al.Resveratrol glucoside(Piceid)synthesis in seeds of transgenic oilseed rape(Brassica napus L.)[J].Theoretical Applied Genetics,2005,111(8):1553-1562.
[19] 夏海武,吕柳新.虎杖不同部位白藜芦醇含量的分析[J].植物资源与环境学报,2005,14(3):55-56.Xia Hai-wu,Lü Liu-xin.Analysis of resveratrol content in different parts of Polygonum cuspidatum [J].Journal of Plant Resources and Environment,2005,14(3):55-56.

