外环境样本中产毒型O1群霍乱弧菌双重荧光定量PCR快速检测方法的建立*
黄世旺,徐丹戈,徐昌平,张 政,方叶珍,包芳珍,李 剑,蒋雪凤,卢亦愚
霍乱弧菌(Vibrio cholerae)是引起烈性肠道传染病霍乱的病原菌,其传统检测多以细菌培养法为主,操作繁琐、费时费力。近年来,人们逐渐将PCR、荧光定量PCR技术引入到霍乱弧菌的快速检测中[1-4],这对霍乱疫情的早发现、早诊断、早隔离、早治疗起到了积极的作用。但PCR检测需要开盖电泳易受污染造成假阳性的发生,使其在应用上受到了一定限制;而目前在荧光定量PCR诊断方面大多停留在单重荧光检测阶段[4]或是仅应用于临床前研究。我们在2006年建立荧光定量PCR快速检测霍乱弧菌方法[5]的基础上,进一步深入研究,建立了双重荧光定量PCR快速检测O1群霍乱弧菌技术,并采集352件外环境样本对建立的双重荧光定量PCR检测技术进行了临床验证,取得了满意的效果,现将结果报告如下。
1 材料与方法
1.1 菌株与临床样本 O1群霍乱弧菌(小川型)、O139群霍乱弧菌、创伤弧菌、空肠弯曲菌、副溶血性弧菌、甲型副伤寒沙门菌、鼠伤寒沙门菌、福氏志贺菌、奇异变形杆菌、大肠埃希菌、蜡样芽孢杆菌、金黄色葡萄球菌由浙江省疾病预防控制中心与省内相关疾控中心提供。
外环境监测样本:2008年杭州市某区4-11月份采集的352件外环境样本。
1.2 引物与探针 从 GenBank上分别下载rfbO1和CT基因序列,进行同源性比对后,在rfbO1基因保守区域设计特异性引物和 Taqman探针,探针5′端标记HEX荧光报告基团,在CT基因保守区域设计特异性引物和 Taqman探针,探针 5′端标记ROX荧光报告基团。引物和探针均委托 TA KARA公司合成,序列见表1。
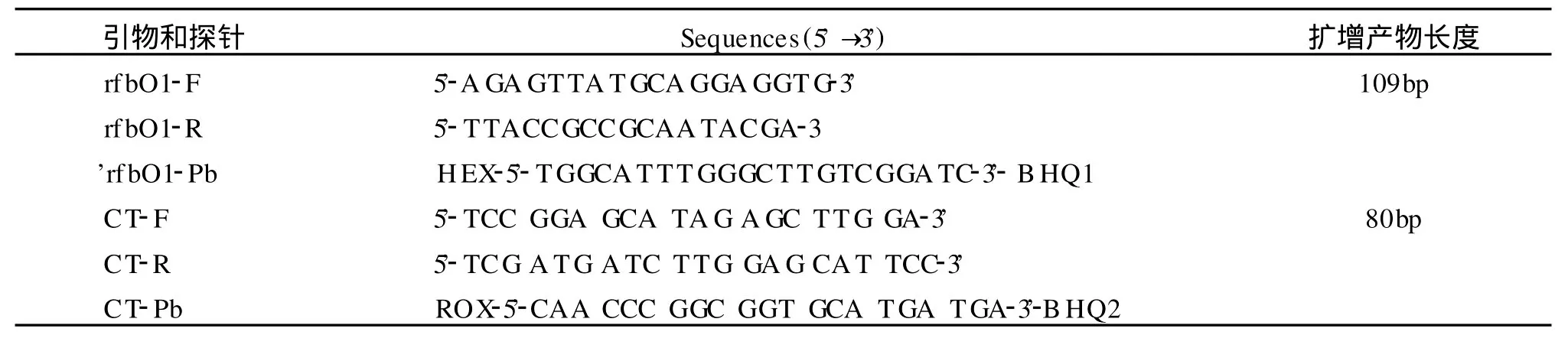
表1 霍乱弧菌CT基因、rfbO1基因引物和探针序列Table 1 Sequences of primers and probe for rfb-O1 and CT gene ofVibrio cholerae
1.3 菌种培养和模板DNA提取 无菌条件下将各种菌株接种于营养肉汤中,36℃培养过夜复苏;划线于营养琼脂平板,36℃倒置培养过夜;挑取单菌落重新接种于营养肉汤,增菌6h,用“煮沸法”提取核酸:即取1mL上述增菌液加入1.5mL离心管中,4 000r/min离心 6min富集,去上清,加入 100μL DEPC水重悬,煮沸 10min,10 000r/min离心 2 min,吸取上清液作为模板DNA,-80℃保存备用。1.4 病原菌的定量标准 纯培养增菌6h,取一份菌液,煮沸 10min后测 OD492nm值,调节浓度使OD492nm=0.1(相当于 1.0 ×107cfu/mL)[6],依次作10倍稀释,备用。另取一份菌液调至相同浓度,进行10倍稀释并涂布,每个稀释度涂布3块平板,进行平板计数。
1.5 单重、双重荧光定量PCR反应体系和反应条件 单重、双重荧光定量PCR均采用 Ta KaRa公司的 Premix Ex TaqTM(Perfect Real Time)试剂盒,在Mx3000P型荧光定量PCR仪上进行检测。在单重荧光定量PCR反应体系和反应条件优化的基础上,双重荧光定量PCR采用的反应体系和反应条件如表2。
1.6 双重荧光定量PCR的特异性、敏感性和重复性 提取O1群霍乱弧菌、O139群弧菌弧菌、创伤弧菌、空肠弯曲菌、副溶血性弧菌、沙门菌、志贺菌等核酸,用建立的双重荧光定量PCR系统进行检测,验证体系的特异性。同时对已定量的O1群霍乱弧菌标准株稀释后分别提取DNA,平行进行单重与双重荧光定量 PCR,比较其敏感性,并构件标准曲线验证体系稳定性。
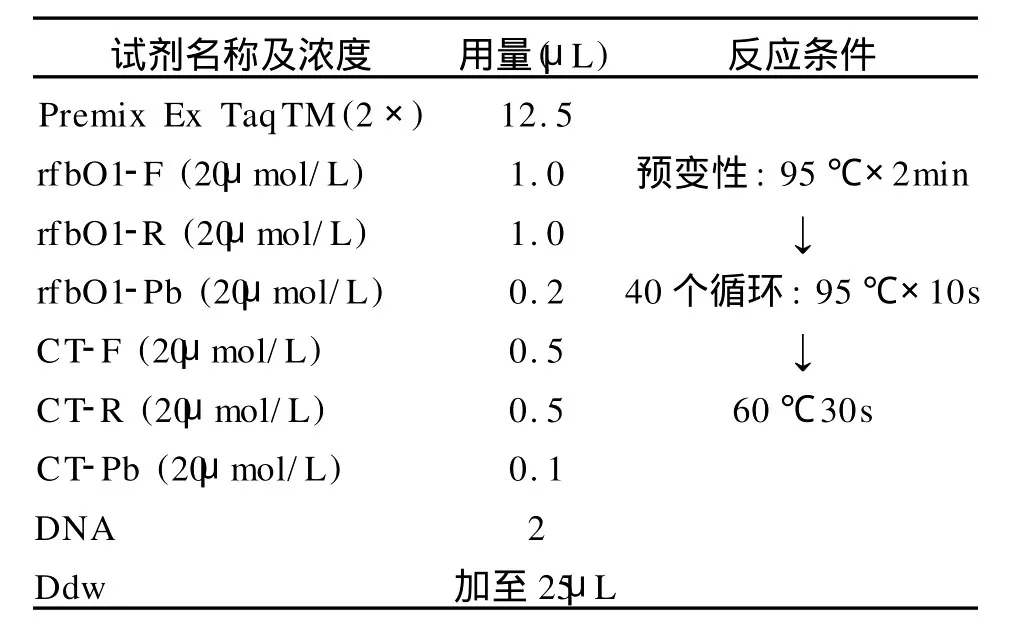
表2 双重荧光定量PCR反应体系和反应条件Table 2 The reaction conditions of the multiplex real-time quantitative PCR method
1.7 结果判定方法 霍乱弧菌rfbO1、CT基因分别用HEX和ROX荧光信号来标记。当rfbO1阳性、CT阳性时,鉴定为产毒型O1群霍乱弧菌;当rfbO1阳性、CT阴性时,鉴定为非产毒型O1群霍乱弧菌;当rfbO1阴性、CT阳性时,鉴定为产毒型非O1群霍乱弧菌。
检测结果以Ct值<37并且扩增曲线呈S型为阳性判定原则,其中Ct值<35且扩增曲线良好可直接判定为阳性,Ct值在35~37之间需重复实验,两次实验均能得到良好S型扩增曲线方可判定为阳性。
1.8 外环境样本中标本核酸制备
1.8.1 外环境样本的采集和处理
1.8.1.1 海水产品(除甲鱼外) 取腮部和肠内容物或贝壳内软组织25g,剪碎后加入225mL碱性蛋白胨水中37℃增菌6h(突发疫情时先增菌1h,挑取部分上层增菌液进行荧光定量PCR检测,其余继续增菌至6h)后,挑取以上样本的上层增菌液进行荧光定量PCR检测和传统细菌培养;同时取2-3滴转种于10mL碱性蛋白胨水中作第二次增菌,37℃增菌6h后再进行荧光定量 PCR检测和传统细菌培养。
1.8.1.2 甲鱼 用5-6支无菌棉签反复涂抹活甲鱼体表(特别是泄殖腔、脚趾及其周围皱褶处),转入100 mL碱性蛋白胨水中37℃增菌6h后(突发疫情时先增菌1h,挑取部分上层增菌液进行荧光定量PCR检测,其余继续增菌至6h),挑取以上样本的上层增菌液进行荧光定量PCR检测和传统细菌培养;同时取2~3滴转种于10mL碱性蛋白胨水中作第2次增菌,37℃增菌6h后再进行荧光定量 PCR检测和传统细菌培养。
1.8.1.3 外环境水样 用灭菌广口瓶采集500mL,取450 mL加入10倍碱性蛋白陈水50 mL,37℃增菌过夜后(突发疫情时先增菌1h,挑取部分上层增菌液进行荧光定量PCR检测,其余继续增菌过夜),挑取以上样本的上层增菌液进行荧光定量PCR检测和传统细菌培养;同时取2~3滴转种于10mL碱性蛋白胨水中作第2次增菌,37℃增菌6h后再进行荧光定量PCR检测和传统细菌培养。1.8.2 外环境样本DNA提取 将增菌后的碱性胨水混匀,吸取10mL至15mL离心管中,1 000r/min离心10min,吸取1mL上层液体经4 000r/min离心10min,收集沉淀,加 100μL DEPC水重悬,煮沸10min,10 000r/min离心,取上清,-80℃保存备用。
2 结 果
2.1 双重荧光定量PCR的特异性 对O1群霍乱弧菌、O139群霍乱弧菌、创伤弧菌、空肠弯曲菌、副溶血性弧菌、甲型副伤寒沙门菌、鼠伤寒沙门菌、福氏志贺菌、奇异变形杆菌、大肠埃希菌、蜡样芽孢杆菌、金黄色葡萄球菌分别提取核酸,采用霍乱弧菌TaqMan双重荧光定量PCR反应系统进行检测,除O1群霍乱弧菌显示CT、rfbO1基因均阳性,O139群霍乱弧菌显示CT基因阳性外,其它所有细菌的检测结果均阴性。说明该体系具有高度特异性。
2.2 双重荧光定量PCR的检测灵敏度 O1群霍乱弧菌定量后(OD492nm=0.1,相当于1.0×107cfu/mL)[6],将其稀释至 1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101cfu/mL,提取细菌DNA,平行进行单重荧光定量 PCR与双重荧光定量PCR反应,比较其灵敏度。结果双重荧光定量PCR对O1群霍乱弧菌rfbO1基因、CT基因检测灵敏度均达到了1.0×102cfu/mL,与单重荧光定量PCR检测rfbO1基因、CT基因灵敏度相当。见图1和图2。

图1 双重、单重荧光定量 PCR检测O1群霍乱弧菌rfbO1基因灵敏度比较注:曲线A和B,C和D,E和 F,G和 H,I和J分别表示双重和单重荧光定量 PCR方法检测相同浓度O1群霍乱弧菌 rfbO1基因,核酸浓度依次为 106、105、104、103、102cfu/mL,101cfu/mL与阴性对照均未出峰Fig.1 Sensitivity for detection of rfb-O1 gene for Vibrio cholerae serogroup O1 with multiplex real-time PCR and real-time PCR.Note:106-102cfu/mL from left to right and 101cfu/mL is negative.
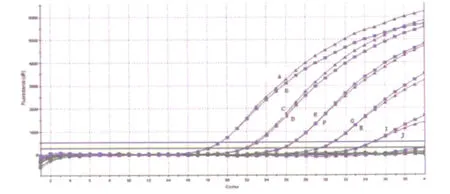
图2 双重、单重荧光定量PCR检测O1群霍乱弧菌CT基因灵敏度比较注:曲线A和B,C和D,E和 F,G和 H,I和J分别表示双重和单重荧光定量 PCR方法检测相同浓度O1群霍乱弧菌CT基因,核酸浓度依次为106、105、104、103、102cfu/mL,101cfu/mL与阴性对照均未出峰Fig.2 Sensitivity for detection of CTgene forVibrio cholerae serogroup O1 with multiplex real-time PCR and realtime PCR.Note:106-102cfu/mL from left to right and 101cfu/mL is negative.
2.3 双重荧光定量PCR标准曲线的建立 以已知霍乱弧菌浓度为横坐标,以PCR反应循环数为纵坐标,可以得到细菌相对定量标准曲线。rfbO1基因、CT基因标准曲线相关系数分别为0.999和0.998,提示双重荧光定量PCR反应检测体系检测不同浓度的细菌核酸均具有理想的效果。

图3 双重荧光定量PCR检测O1群霍乱弧菌rfbO1基因、CT基因标准曲线Fig.3 Standard curves of the CTand rfb-O1 gene for Vibrio cholerae serogroup O1 detected by the multiplex realtime PCR
2.4 双重荧光定量PCR应用于外环境样本监测中我们利用建立的双重荧光定量 PCR检测方法对2008年4-11月份所采集的352件外环境样本进行了检测,同时与传统细菌培养法进行比较,共检测出5株带毒力基因的O1群霍乱弧菌。如表3和图4所示。
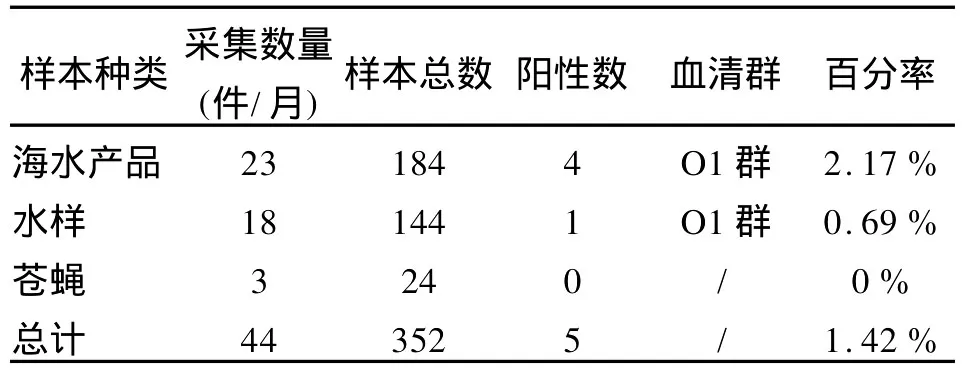
表3 2008年4-11月采集352份外环境样本中检出5株O1群霍乱弧菌情况Table 3 Five strains of toxigenic Vibrio cholerae serogroup O1 were collected from 352 environmental specimens from Apr.to Nov.2008
利用传统细菌培养法进行检测,5份阳性标本中只有1份在1次、2次增菌中均分离到O1群霍乱弧菌,其余4份均只在2次增菌中分离到,这可能与监测样本本身含菌量少有关。而我们利用所建立的双重荧光定量PCR法进行检测,这5份标本均在1次、2次增菌中同时检测出霍乱弧菌,这就在很大程度上避免了漏检,有效防止假阴性结果的发生。
3 结 论
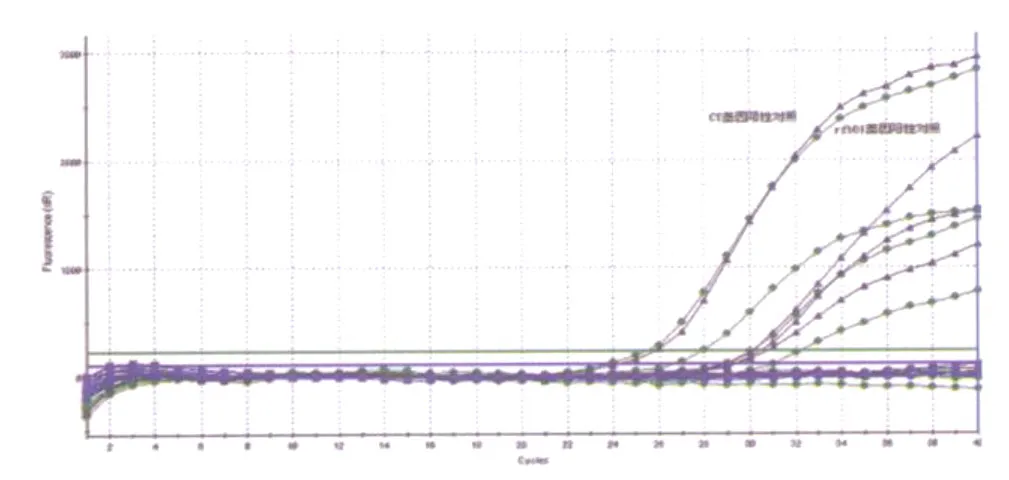
图4 双重荧光定量PCR对部分外环境样本中O1群霍乱弧菌的检测注:带符号“●”、“▲”分别表示霍乱弧菌 rfbO1、CT基因Fig.4 Detection of toxigenic Vibrio cholerae serogroup O1 from environmental specimens by multiplex real-time quantitative PCR
目前荧光定量PCR技术以其灵敏度高,检测速度快,特异性强等优点,已在许多病原微生物的诊断中发挥了巨大作用。本研究组近年建立的单重荧光定量快速检测霍乱弧菌方法,也在疫情的应急诊断中得到运用,并取得较好效果[7]。在此基础上分别在rfbO1基因序列检测上采用 HEX标记的荧光探针,在CT基因序列检测上采用ROX标记的荧光探针,组合成双重荧光定量PCR检测体系,应用美国Stratagene公司Mx3000P型荧光定量 PCR仪进行双通道荧光检测与鉴定分型,实现一管双检,即可判断出是否带毒力基因,又可有效区分出是否为O1群霍乱弧菌,大大简化了实验过程,节省了实验试剂。霍乱弧菌双重荧光定量PCR快速诊断分型对控制疫情蔓延发展和制定及时防控策略具有重要意义。
本研究建立的方法不仅能够最快在3 h内准确地鉴定出是否为带毒力基因的O1群霍乱弧菌,而且与传统培养法和普通PCR法相比具有更高的灵敏度。我们以往研究的单重荧光定量PCR检出限可达到1.0×102cfu/mL,本研究建立的双重荧光PCR也可以达到单重荧光法的最低检出限。研究建立的双重荧光PCR定量标准曲线相关系数分别达到0.999和0.998,说明此反应体系稳定性强,具有较高的准确度。
本研究建立的快速、灵敏、准确的双重荧光定量PCR分型检测技术,可应用于外环境样本中O1群霍乱弧菌的大范围筛查,对霍乱疫情的预防及控制和流行病学监测具有重要价值。
[1]Lyon W J.TaqM an PCR for detection ofVibrio choleraeO1,O139,non-O1,and non-O139 in pure cultures,raw oysters,and synthetic seawater[J].Appl Environ Microbiol,2001,67(10):4685-4693.
[2]Begum K,Ahsan CR,Ansaruzzaman M,et a1.Toxin(s),other than cholera toxin,produced by envkonmental non O1 non 0139 Vibrio cholerae[J].Cell Mol Immunol,2006,3(2):115-121.
[3]黄晓蓉,吕海沧,郑晶,等.多重 PCR方法检测霍乱弧菌的研究[J].微生物学杂志,2006,26(5):11-13.
[4]王云华,罗诗龙,伍朝晖,等.实时荧光RT-PCR方法检测水及水产品中霍乱弧菌[J].中国国境卫生检疫杂志,2006,29(5):311-313.
[5]黄世旺,卢亦愚,徐丹戈,等.TaqMan荧光定量PCR技术快速检测霍乱弧菌方法的建立[J].中国卫生检验杂志,2006,l6(8):923-924,984.
[6《]霍乱防治手册》编写组.霍乱防治手册[M].5版.中华人民共和国卫生部疾病控制司,1999:10.
[7]徐丹戈,黄世旺,卢亦愚,等.实时荧光定量聚合酶链反应法与常规聚合酶链反应法及传统培养法检测霍乱弧菌的比较[J].中国预防医学杂志,2007,8(增刊):54-56.

