猪HEV实验感染SD大鼠的研究*
王晓娟,常义宾,王 玲,耿家宝,卜秋宁,付红伟,朱永红
戊型肝炎(Hepatitis E,HE)是由戊型肝炎病毒(Hepatitis Evirus,HEV)感染引起的急性肝炎,但在器官移植病人中也有慢性化的报道[1],主要经粪口途径传播,也有经输血[2]和母婴垂直传播[3]的报道。HEV感染的特点是主要侵犯青壮年,儿童和老年人群多为亚临床感染,孕妇感染后病死率可高达20%[4]。根据核酸序列分析可将HEV分为四个主要基因型,1、2、3、4型。目前认为基因 1型和 2型只能感染人,而3型和4型既可感染人,也可感染多种动物。在自然界中已发现了多种HEV动物宿主,并且有报道人食用感染HEV动物的肉制品后患戊型肝炎的病例,并经测序证实,病人感染的HEV与从肉制品中分离到的HEV的基因同源性为100%[5],证实了HEV在人和动物之间的传播。因此,戊型肝炎已被公认为是一种人兽共患病,并相继有研究报道了HEV在不同动物间的跨种系传播[6],提示多种动物在HEV的传播方面可能起重要作用。
近年来研究显示,除了非人类灵长类、猪和鸡外 ,在狗 、猫 、牛 、羊 、马 、啮齿类动物 、猫鼬 、鹿 、家兔等其他动物物种中也检测出抗-HEV抗体。其中,啮齿类动物抗-HEV抗体检出率较高,但各地报道结果不尽相同,而且通过实验室感染啮齿类动物的研究结果显示,啮齿类动物是否对HEV易感尚无统一定论。因此,为进一步探讨啮齿类动物对HEV的易感性,本实验用猪HEV分别经尾静脉注射和经口途径对SD大鼠进行了实验感染,现将结果报告如下。
1 材料和方法
1.1 动物来源及分组 22只健康SD大鼠,体重180 g左右,均购自北京大学医学部实验动物中心,分笼喂养。大鼠的饲养和使用按照《北京市实验动物管理条例》(2004年修订)进行。实验前已通过实验动物伦理审查。22只实验大鼠随机分为四组:第一组6只经尾静脉注射0.6×102GE HEV病毒悬液(病毒滴度为102GE/m l);第二组6只经尾静脉注射1.2×102GE HEV病毒悬液;第三组5只经灌胃途径给予0.6×102GE HEV病毒悬液,第四组5只经灌胃途径给予1.2×102GE HEV病毒悬液,每组均设1只对照,经相应途径给予相应剂量的10%PBS悬液。
1.2 病毒来源及接种 取HEV 4型猪粪便标本(本实验室曾用此株病毒株成功感染上猕猴[7])用PBS(pH 7.4)制成10%(m/v)粪便悬液,4℃4 000 r/min离心30min,取上清,用0.45μm 和0.22μm的滤器过滤上清,-80℃贮存备用。分别将两份10%的猪粪便悬液进行10倍梯度稀释,采用基因组当量法(Genom ic Equivalent,GE)进行病毒定量,作为本实验的病毒悬液感染动物。该粪便悬液的病毒滴度为102GE/m L。实验动物的分组及感染剂量见表1。

表1 实验动物分组及HEV感染的各项观测结果Tab le 1 Results of each group with different doses of HEV administration
1.3 标本收集及检测 所有动物在感染前及感染后每隔3d分别收集粪便和血清标本,直到感染后60d为止。大鼠血清用EIA法检测抗-HEV抗体;并对所有的血清标本用日立全自动生化分析仪7170A(日本日立高新技术贸易有限公司)检测血清A LT。当A LT有明显升高时,处死大鼠,取其肝脏,分别用10%甲醛和4%多聚甲醛固定,做石蜡切片和透射电镜切片,做病理学检测。
1.4 HEV RNA提取及检测 总RNA提取试剂盒和AMV反转录酶购自Promega公司,Taq-plus DNA聚合酶和引物合成来自上海生物工程技术服务有限公司。取粪便上清120μL或血清标本100 μL,按总RNA提取试剂盒说明书操作提取HEV RNA,逆转录后采用巢式PCR进行扩增。
引物系参照中国猪HEV 4型序列(GenBank accession num ber:AY594199)设计。两套引物(P引物和S引物,涵盖HEV基因1-4型)均为本实验室常用的扩HEV RNA的通用引物,且已证实均能成功地从人和猪的血清及粪便标本中扩增出HEV RNA[8-9]。引物序列详见表2。
RNA模板35μL,10×PCR缓冲液5μL,2.5 mmol/L dNTPs 4 μL,P1、P4或 S1、S4各 3 μL,AMV反转录酶0.2 u,42℃反转录50 min,加入2.5 u的 Taqplus DNA聚合酶,然后进入第1轮PCR:94℃5 min,94℃1 min,50℃1 min,72℃1min,30个循环,72℃延伸8min;第2轮PCR引物为P2、P3或S2、S3各3μL,加5μL第一轮产物,总体积为50μL:94℃5 min,94℃45 S,50℃45 S,72℃45 S,30个循环,72℃延伸8 min。每次均设阴阳性对照。

表2 HEV RNA ORF1和OFR2部分核苷酸序列RT-nPCR扩增引物Table2 Sequences of primers for HEV RT-nPCR
2 结 果
2.1 ALT水平及临床体征 在大剂量病毒(1.2×102GE)静脉注射组有4只大鼠在感染后2周左右血清A LT水平出现了较明显的升高,并伴有精神不振、腹泻、毛发无光等症状,其它组的大鼠ALT水平虽有波动但与感染前的大鼠A LT平均值相比无明显差异。
2.2 抗-HEV抗体及HEV RNA 在整个实验过程中,仅有1只经尾静脉注射1.2×102GE HEV粪便悬液的SD大鼠(简称Y鼠)在实验观察期内出现了抗-HEV抗体阳转(4只ALT水平轻微升高的SD大鼠有1只突然不明原因死亡,2只在ALT水平升高时处死取肝脏做病理,因而这3只大鼠的血清抗-HEV抗体OD值缺失),其他组的大鼠均未检测到HEV抗体。所有大鼠血清和粪便标本均用HEV P引物和S引物检测,但均未检测到 HEV RNA,只有Y鼠的粪便核酸扩增出现过阳性,但测序失败。
2.3 肝组织病理学 取A LT值上升的大鼠肝组织做病理检查,在光镜下可见肝组织出现轻微炎症性病理学改变:血窦内皮可见散在单核细胞和淋巴细胞粘附,汇管区及纤维间隔中有散在淋巴细胞和少量单核细胞浸润(见图 1)。电镜未见病毒样颗粒。
3 讨 论
本室曾用与本研究所用相同的猪HEV 4型病毒株成功地感染了猕猴。感染后猕猴出现粪便排毒和病毒血症,HEV抗体阳转,ALT水平异常升高,肝活检显示典型的急性病毒性肝炎病理学改变,电镜下可见肝细胞中散在大量戊型肝炎病毒样颗粒。以上研究结果证明该株猪HEV病毒能够在实验条件下引起跨物种(猪HEV感染猕猴)感染。因此,本研究选用了相同的病毒株来探讨其对啮齿类动物感染的可能性。
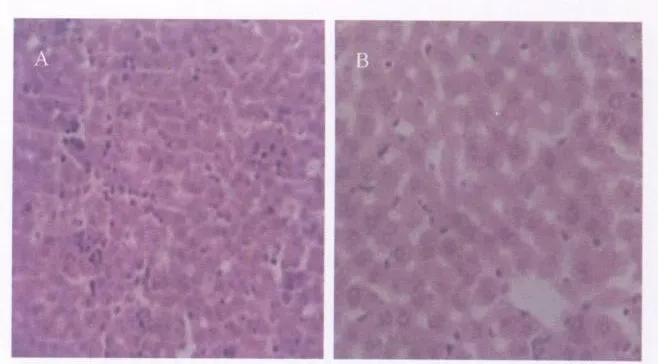
图1 SD大鼠肝组织病理学改变(H.E.染色)A为HEV感染鼠的肝组织切片;B为对照鼠的肝组织切片。放大倍数:20×Fig.1 Pathologic changes in livers of SD rats(Hematoxy lin and eosin stain)A:Liver section from HEV in fected SD rat,B:Liver section from normal SD rat magnification:20×ob jective
尽管猕猴经大剂量注射HEV病毒悬液后出现ALT水平明显升高并持续3周,但在本实验中仅有4只经尾静脉注射1.2×102GE的同一株病毒悬液的SD大鼠在感染后2周左右出现了ALT水平的升高,其他组大鼠A LT水平的平均值和注射后对照组大鼠的ALT水平相比差异不显著。这种结果可能是由于猪HEV对SD大鼠的致病性较弱,所导致的肝组织病变较轻微,不足以导致明显的ALT水平变化,只有较大剂量的病毒感染才会出现明显的改变。Maneerat[10]等曾报道W istar大鼠在感染HEV后ALT基本为正常水平;Fen Huang[11]等也报道用猪HEV感染BALB/c裸鼠中也发现ALT无明显变化。因此,对于不同鼠种来说,ALT能否作为反映各种啮齿类动物肝脏轻微病变的有用指标或者敏感性指标仍需进一步研究证明。取ALT值升高较明显的大鼠肝组织做病理学检查,光镜下可见肝组织出现轻微的炎症性病理改变,提示可能由猪HEV感染所致。
血清学检测中经尾静脉注射 1.2×102GE HEV病毒悬液的4只SD大鼠之一Y鼠在感染后第40 d出现了抗-HEV抗体阳转(因4只ALT水平升高的SD大鼠有1只突然不明原因死亡,2只在A LT水平升高时处死取肝脏做病理,因而这3只大鼠的血清抗-HEV抗体OD值缺失),并伴有A LT水平轻微升高、精神不振、腹泻等症状。此外,Y鼠的粪便核酸扩增出现过阳性,虽然测序失败,但以上结果均提示感染成功。测序失败的原因可能是猪HEV在SD大鼠体内复制率较低,病毒在血液及粪便中的浓度均较低且持续时间较短,所以病毒核酸不易被扩出。以往对啮齿类动物的血清抗-HEV抗体检测发现,HEV感染很普遍且HEV抗体阳性率较高,但在抗HEV阳性鼠标本中均未扩增出HEV核酸序列,提示啮齿类动物虽在HEV传播中可能起重要作用,但鼠与人之间的HEV感染关系尚不清楚,鼠是否为HEV自然宿主尚待深入研究。本实验结果虽然提示猪HEV 4型可能会跨种系传播感染SD大鼠但易感性较低,且需较大的感染剂量,但由于病毒核酸扩增测序失败,因此,SD大鼠是否对猪HEV易感尚有待进一步研究证实。
[1]Kamar N,Selves J,Mansuy JM,et al.Hepatitis Evirus and chronic hepatitis in organ-transplant recipien ts[J].N Engl J Med,2008,358(8):811-817.
[2]Mitsui T,Tsukamoto Y,Yamazaki C,etal.Prevalence of hepatitis Evirus infection among hemodialysis patients in Japan:Evidence for infection with a genotype 3 HEV by blood transfusion[J].JMed V irol,2004,74(4):563-572.
[3]Khuroo MS,Kamili S,Khuroo MS.Clinical course and duration of viremia in vertically transmitted hepatitis Evirus(HEV)infection in babies born to HEV-in fected mothers[J].J Viral Hepat,2009,16(7):519-523.
[4]Skidmore S.Overview of Hepatitis E V irus[J].Cu rr Infect Dis Rep,2002,4(2):118-123.
[5]Takahashi K,K itajima N,Abe N,et al.Complete o r near complete nucleotide sequences of hepatitis Evirus genome recovered from a wild boar,adeer,and four patientsw ho ate the deer[J].V irology,2004,330(2):501-505.
[6]Meng XJ.Hepatitis Evirus:animal reservoirs and zoonotic risk[J].Vet Microbiol,2010,140(3-4):256-265.
[7]Ji YL,Zhu YH,Liang JR,et al.Sw ine hepatitis Evirus in rural sou thern China:genetic characterization and experimental in fection in rhesusmonkeys(MacacamμLatta)[J].JGastroen terol,2008,43(7):565-570.
[8]Fu HW,Li LJ,Zhu YH,et al.Hepatitis Evirus infection among animals and humans in Xin jiang,China:Possibility of swine to human transmission of spo radic Hepatitis E in an endemic area[J].Am JT rop Med Hyg,2010,82(5):961-966.
[9]Chang YB,Wang L,Geng JB,et al.Zoonotic risk of hepatitis Evirus(HEV):A study of HEV infection in animals and humans in subu rbs of Beijing[J].Hepatol Res,2009,39(12):1153-1158.
[10]Maneerat Y,C layson ET,Myint KS,et al.Experimental infection of the laboratory rat with the hepatitis Evirus[J].J Med Virol,1996,48(2):121-128.
[11]Huang F,ZhangW,Gong G,et al.Experimen tal infection of BA LB/cnudemice with Hepatitis Evirus[J].BMC Infectious Diseases,2009,93:1471-2334.

