甘草酸二铵肠溶胶囊的制备与质量控制
吴云珍,宋旭莹,陆纪宏
(浙江金华康恩贝生物制药有限公司,321016)
甘草酸二铵是从甘草中提取的α体甘草次酸衍生物,具有抗炎、抗变态反应、抗病毒、保护细胞膜结构、调节免疫、改善肝功能等多种作用。甘草酸二铵属于弱酸性化合物,微溶于水,且水溶液不稳定,在酸性水溶液中很快分解[1]。目前上市的甘草酸二铵肠溶胶囊采用肠溶胶囊壳达到肠道释放的目的。有学者指出,肠溶胶囊均为明胶胶囊外包肠溶衣制成,由于明胶的特殊性质,这种传统的包衣方式很难达到理想的效果,或是影响药物性质,或是影响整体胶囊的稳定性。本实验中,笔者在考察药物稳定性及筛选辅料的基础上,采用挤出滚圆工艺及流化床包衣法制备甘草酸二铵肠溶微丸,更好地控制了药物释放,以体外溶出度为评价指标,并依据正交实验设计对处方进行了优化。
1 仪器与试药
1.1 仪器 E-50轴向单螺杆挤出机(重庆英格),S-250滚圆机(重庆英格),WBF-2G型包衣造粒机(重庆英格),ZRS-8G型溶出仪(天津大学无线电厂),Agilent1100高效液相色谱仪(美国安捷伦公司),AG135型电子分析天平(梅特勒-托利多仪器有限公司),TU-1800S型紫外-可见分光光度计(北京普析通用仪器有限公司)。
1.2 试药 甘草酸二铵(西安富捷药业有限公司,批号:100904,纯度:99.2%),烟酰胺对照品(中国药品生物制品检定所,批号:100115-200703),羟丙基甲基纤维素E5(上海卡乐康公司),微晶纤维素(湖州展望天明药业有限公司),磷酸氢二钠(上海展云化工有限公司),磷脂酰胆碱(上海太伟药业有限公司 ),邻苯二甲酸二乙酯(中国医药集团化学试剂有限公司),Eudragit L30D-55(德固赛公司),滑石粉(莱州市风羽滑石粉有限公司)。
2 方法
2.1 载药微丸的制备 采用挤出滚圆造粒机制备微丸。称取处方量药物及辅料,过筛混合均匀,加2%羟丙甲基纤维素(hydroxy propyl methyl cellulose,HPMC)适量制成软材,经挤出筛板(孔径0.8 mm)挤成直径相当的条状,进滚圆机使颗粒完全滚圆,于50℃烘干,取0.80~1.18 mm(18~24目)微丸包衣。
2.2 隔离微丸的制备 按处方量将HPMC用适量纯化水预先溶解,加入磷酸氢二钠,搅拌30 min,过内径0.180 mm(80目)筛,即得HPMC包衣液,备用。开启流化床设备并选择适当程序,设备加热至显示温度(45±2)℃。加入药丸,加热,至显示温度(40±2)℃。开始喷HPMC溶液[设备参数:进风温度38~50℃,气压:0.2 ~0.4 MPa,雾化压力0.2 ~0.5 MPa,引风机频率26~43 Hz,温度设定35~50℃,蠕动泵流量10~60 r·min-1,产品温度(35±5)℃],质量增加约 5%。喷涂完毕,隔离丸于流化床设备内沸腾20~25 min出料,过内径0.710~1.180 mm(16~24目)筛。
2.3 肠溶颗粒的制备 将邻苯二甲酸二乙酯、滑石粉、磷酸氢二钠加入适量水中,搅拌均匀,然后按比例加入Eudragit L30D-55分散体,搅拌60 min,过内径0.180 mm(80目)筛,即得缓释层水分散体包衣液,备用。取隔离微丸,置包衣造粒机中,用已配制好的丙烯酸树脂包衣溶液进行包衣[设备参数:进风温度设定38 ~50 ℃,气压压强:0.2 ~0.4 MPa,雾化压强:0.2 ~0.5 MPa,引风机频率25 ~50 Hz,温度设定35~50 ℃,蠕动泵流量10~30 r·min-1,产品温度(40±2)℃,增质量约12%]。包完衣后置于50℃烘箱内干燥老化24 h,取出得肠溶微丸。
2.4 耐酸力与释放度测定
2.4.1 液相色谱条件[3]色谱柱为十八烷基键合填充柱(100 mm×4.6 mm,5μm);流动相:甲醇-水-四氢呋喃-5% 醋酸铵(5∶9∶3∶4);流速:1.0 mL·min-1;检测波长:252 nm;柱温:室温;进样体积:10 μL。
2.4.2 耐酸力测定 取本品6粒,照《中华人民共和国药典》2010年版二部附录X C第一法溶出度测定法,以盐酸溶液(9→1 000)500 mL为溶剂,100 r·min-1,经2 h,取下转篮,以水冲洗除去转篮内颗粒表面的酸液至中性,将转篮内颗粒移置100 mL量瓶,加磷酸盐缓冲液(pH11.0)(取 0.25 mol·L-1磷酸钠溶液 110 mL,加 0.5 mol·L-1磷酸氢二钠溶液220 mL,用水稀释至1 000 mL,混匀)约60 mL,超声处理使甘草酸二铵溶解,加上述缓冲液稀释至刻度,精密量取5 mL,置50 mL棕色量瓶,用水稀释至刻度,摇匀,精密量取20 μL 注入液相色谱仪,照“2.4.1”项方法测定。另取烟酰胺对照品10 mg,精密称定,以磷酸盐缓冲液(pH=11.0)溶解并稀释成约 1 μg·mL-1溶液,同法测定,按外标法以峰面积计算,结果乘以1.898,耐酸力不得小于90%。
2.4.3 释放度的测定[4]照《中华人民共和国药典》2010年版二部附录X D释放度测定法第二法。取6片,以人工胃液500 mL为溶剂,转速100 r·min-1,2 h后,在容器中加入预热至37℃的0.235 mol·L-1磷酸氢二钠溶液400 mL,继续依法操作,经45 min时,精密量取续滤液5 mL置于具塞试管中,加0.25 mol·L-1氢氧化钠溶液1.0 mL,摇匀,作为供试品溶液。另取烟酰胺对照品10 mg,精密称定,以磷酸盐缓冲液(pH=11.0)溶解并稀释成约 1 μg·mL-1溶液,作为对照品溶液。取供试品溶液和对照品溶液,照“2.4.1”项方法测定,按外标法以峰面积计算,结果乘以1.898,每粒的释放量不得小于75%。
2.4.4 线性关系考察 取甘草酸二铵适量,用磷酸盐缓冲液(pH=11.0)配制成1 mg·mL-1储备液,分别吸取1,2,5 mL 置于 100 mL 量瓶,吸取 1,2,5 mL 置于10 mL量瓶,加入磷酸盐缓冲液(pH=11.0)稀释至刻度,成浓度为 10,20,50,100,200,500 μg·mL-1系列溶液,依法测定,以甘草酸二铵浓度与相应的峰面积进行线性拟合,得方程:Y=0.305X+170.69,R2=0.999 4。结果表明,在10~500 μg·mL-1浓度范围内,甘草酸二铵的量与相应的峰面积呈良好的线性关系。
2.4.5 耐酸力和缓冲液中释放度测定 将3批甘草酸二铵肠溶微丸按“2.4.2”和“2.4.3”项检测,结果批号为010215,010216,010217的样品,耐酸力分别为93.7%,95.1%,96.5%;释放度分别为 86.6%,91.8%,88.7%。由此可知,3批甘草酸二铵肠溶微丸均符合标准规定。
2.5 肠溶微丸处方优化 选取微晶纤维素含量(A,%)、HPMC 增质量(B,%)和 Eudragit增质量(C,%)为因素,以45 min药物溶出度为指标,采用L9(34)正交设计实验优化处方(表1),筛选出符合要求的最优处方。
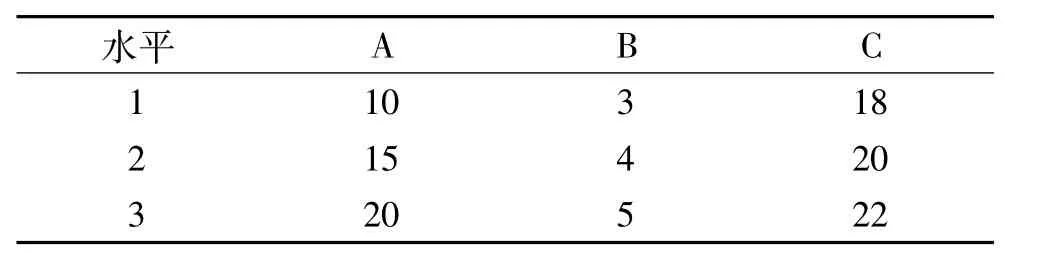
表1 正交实验因素与水平%
3 结果
3.1 肠溶微丸处方优化结果 正交实验结果见表2,由表2可知,最优处方为 A2B2C1,即微晶纤维素为15%,HPMC增质量为4%,Eudragit L30-D55增质量为18%。
3.2 肠溶微丸溶出度测定结果 按最优化处方,制备3批肠溶微丸并测定在人工胃液中溶出2 h后,人工肠液45 min中的溶出度。肠溶微丸在人工肠液中释放迅速,达到了速释的目的。
3.3 肠溶微丸含量及耐酸力考察结果 肠溶微丸3批,含量及耐酸力测定结果3批样品耐酸力良好,批次间差异较小。

表2 正交实验设计表
4 讨论
甘草酸二铵肠溶胶囊是中药甘草有效成分的第3代提取物及磷脂酰胆碱的混合物。具有较强的抗炎、保护肝细胞膜及改善肝功能的作用。该产品使用挤出滚圆-微型流化床包衣法制备甘草酸二铵微丸,以正交实验法对处方进行了优化,肠溶微丸耐酸性好,在人工肠液中释放迅速、完全,批次间差异较小。本实验制备工艺简单、易操作、重复性好,适宜工业化生产。
[1]SHIOTA G,HARADA K,LSHIDA M,et al.Inhibition of hepatoceular carcinomaby glycyrrhizin in diethylnitrosamine-treated mice[J].Carcinogenesis,1999,20(1):59.
[2]王中彦,唐星,张向荣,等.硝苯地平阿替洛尔缓释胶囊的制备与体外释放[J].沈阳药科大学学报,2003,19(2):90-91.
[3]甘草酸二铵胶囊[S].WS12(X2416)22003Z.
[4]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科学技术出版社,2010:附录X85,87.

