脂肪酸对糖尿病及非糖尿病人成熟脂肪细胞分泌白介素-6的影响及罗格列酮干预的效果
李淑英
(河北省围场满族蒙古族自治县医院,河北 围场 068450)
糖尿病微血管及大血管并发症是患者致死、致残的重要原因,如何减缓糖尿病并发症的发生发展是目前急需解决的问题。低度炎症反应在糖尿病及其并发症中的作用受到人们的关注。白介素-6(IL-6)是炎症反应中重要的炎性细胞因子,也是诱导肝脏产生急性期蛋白的最主要的炎症介质。IL-6与胰岛素抵抗(IR)、肥胖、2型糖尿病(T2DM)、冠心病等的发生发展有密切的关系[1]。
Jove M 等[2]体外研究发现 0.5mmoL/L 脂肪酸培养的骨骼肌细胞其IL-6的分泌及表达均增加,脂肪酸还可引起葡萄糖载体-4(GLUT-4)的下降及胰岛素诱导的葡萄糖摄取的减少,当事先给予IL-6抗体培养后上述现象即消失,说明脂肪酸可能通过升高IL-6的水平引起胰岛素抵抗及T2DM的发生。实验中我们观察不同浓度的脂肪酸对脂肪细胞分泌IL-6的影响。
罗格列酮(RSG)属噻唑烷二酮类(TZDs)新型抗糖尿病药物,通过激活PPAR-γ而增加肌肉、脂肪组织和肝脏对胰岛素的敏感性而改善糖尿病。研究显示[3]经罗格列酮治疗12周的糖尿病病人其升高的血清IL-6水平明显下降,Lagathu C等[4]的研究发现罗格列酮可防止慢性IL-6处理的脂肪细胞所导致的IL-6分泌增多及胰岛素抵抗。但罗格列酮是否可逆转游离脂肪酸对脂肪细胞分泌IL-6的影响目前尚无定论,本实验将从细胞水平加以研究。
综上所述,本实验拟分离人成熟脂肪细胞(内脏网膜和腹部皮下),直接从体外观察脂肪酸对脂肪细胞分泌IL-6的影响及RSG的干预作用,并比较脂肪酸及罗格列酮对糖尿病人与非糖尿病人脂肪细胞分泌IL-6的影响是否相同。
1 临床资料
1.1 研究对象与取材:实验所用患者内脏网膜及腹部皮下脂肪取自外科住院进行择期开腹手术的12例患者,住院原因分别为肝内外疾病等。其中6例患者为非糖尿病患者,年龄32-56岁之间,BMI在21.1-24.9kg/m2之间,并除外肝、肾及其他内分泌代谢疾病,入院一周内无急性感染,无胰岛素、TZDs、免疫抑制剂、激素、β肾上腺能受体激动剂、儿茶酚胺等药物应用史。另外6例为糖尿病患者,糖尿病诊断按1999年WHO标准,并除外恶性肿瘤,肝、肾及其它内分泌代谢疾病,心血管疾病,急性炎症等,年龄35-60岁之间,BMI在21.3-26.2 kg/m2之间,患者术前皮下注射胰岛素使空腹和餐后血糖均恢复正常3d以上(表中空腹及餐后血糖为手术前一日血糖)。患者一般资料来源于围场县医院。
1.2 主要试剂与器材:DMEM/F12(1:1)培养液(含L-谷氨酰胺和HEPES):美国,HYCLONE公司;胎牛血清白蛋白(BSA):上海,森雄公司;二甲基亚砜溶液(DMSO):由湘雅医院病理生理实验室提供;PBS粉:美国,HYCLONE公司;RSG原粉:北京,高盟化工有限公司;脂肪酸:美国 SIGMA公司;人IL-6ELISA检测试剂盒:深圳,依诺金公司。
2 方法
2.1 脂肪酸对IL-6浓度影响的剂量曲线:细胞来源为非糖尿病人的内脏网膜脂肪细胞,脂肪酸作用浓度为 0.5mmoL/L,0.25mmoL/L,0.125mmoL/L,观察时间为24h。各浓度脂肪酸干预下lnIL-6用6次独立实验的平均值±标准差表示。
2.2 RSG对脂肪酸介导的IL-6分泌的干预作用:细胞来源为非糖尿病人的内脏网膜脂肪细胞,RSG干预浓度为5umoL/L,10umoL/L(具体见:含脂肪酸和RSG的联合培养基的制备),观察时间为24h。各浓度RSG干预下lnIL-6用6次独立实验的平均值±标准差表示。
2.3 脂肪酸及RSG干预对糖尿病人脂肪细胞分泌IL-6的影响:细胞来源为糖尿病人内脏网膜脂肪细胞,脂肪酸浓度为0.5mmoL/L,RSG干预浓度为10umoL/L,观察时间为24h。各组lnIL-6用6次独立实验的平均值±标准差表示。
2.4 脂肪酸及RSG干预对糖尿病人及非糖尿病人IL-6分泌影响的比较:细胞来源为糖尿病及非糖尿病人内脏网膜脂肪细胞,脂肪酸浓度为0.5mmoL/L,RSG干预浓度为10umoL/L,观察时间为24h。以脂肪酸培养分泌IL-6与基础IL-6差值及脂肪酸培养分泌IL-6与RSG干预的差值取自然对数进行独立样本T检验,lnIL-6用6次独立实验的平均值±标准差表示。细胞在含相同浓度DMSO和BSA的DMEM/F12培养液中培养,除药物不同外,其余成分均相同。
2.5 人IL-6ELISA定量测定:人IL-6ELISA定量测定培养基中IL-6的浓度。
2.6 统计分析:用SPSS14.0统计软件进行统计分析。
3 结果
3.1 脂肪酸影响IL-6浓度的剂量效应:从图1可以看出,脂肪酸对IL-6的分泌的促进作用呈浓度依赖性,与对照组相比,0.125mmoL/L 脂肪酸、0.25mmoL/L脂肪酸和0.5mmoL/L脂肪酸培养下,IL-6分泌升高至对照组的107%、154%和202%。
3.2 RSG对IL-6分泌的影响:RSG对脂肪酸介导的IL-6分泌促进作用具有逆转作用,并与RSG的作用浓度有关。0.5mmoL/L脂肪酸使IL-6的分泌升高至对照组的202%,低浓度RSG干预后,IL-6浓度逆转至对照142%,高浓度RSG干预可完全逆转至对照组水平。随机区组方差分析两两比较示脂肪酸组与对照组,脂肪酸组与联合组之间P值均小于0.05(见表1)。

表1 6例非糖尿病患者分离的网膜(OT)脂肪细胞在不同浓度脂肪酸及RSG干预下培养24hIL-6的分泌(pg/mL)及lnIL-6值
3.3 脂肪酸及RSG干预对糖尿病人IL-6分泌的影响:脂肪酸对糖尿病人网膜脂肪细胞分泌IL-6有促进作用。若设定DM人脂肪细胞培养24h后基础IL-6值为100%,则0.5mmoL/L脂肪酸培养的网膜脂肪细胞分泌的IL-6为对照组的155%,高浓度RSG可完全逆转脂肪酸引起的IL-6升高。随机区组方差分析两两比较示脂肪酸组与对照组,脂肪酸组与联合组之间P值均小于0.05(见表2)。
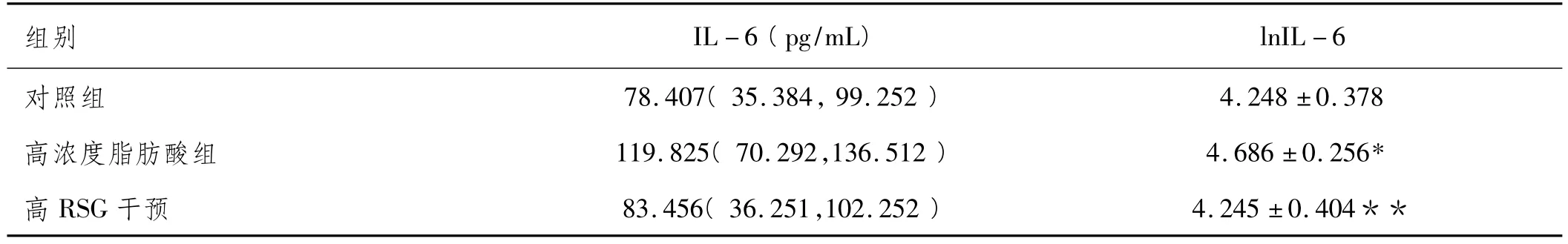
表2 6例糖尿病患者分离的网膜(OT)脂肪细胞在脂肪酸及RSG干预下培养24hIL-6的分泌(pg/mL)及lnIL-6值
3.4 脂肪酸及RSG干预对糖尿病人及非糖尿病人IL-6分泌影响的比较:从表3可以看出,脂肪酸及RSG干预对糖尿病及非糖尿病人IL-6分泌影响无明显差异(P 值均 >0.05)。

图1
3.5 脂肪酸影响IL-6浓度的剂量曲线。内脏网膜脂肪细胞在各种浓度的脂肪酸(0.125-0.5mmoL/L)中培养24h。对照组的细胞仅在含相同浓度的DMSO和BSA的培基中培养。各浓度脂肪酸干预下lnIL-6用6次独立实验的平均值±标准差表示。
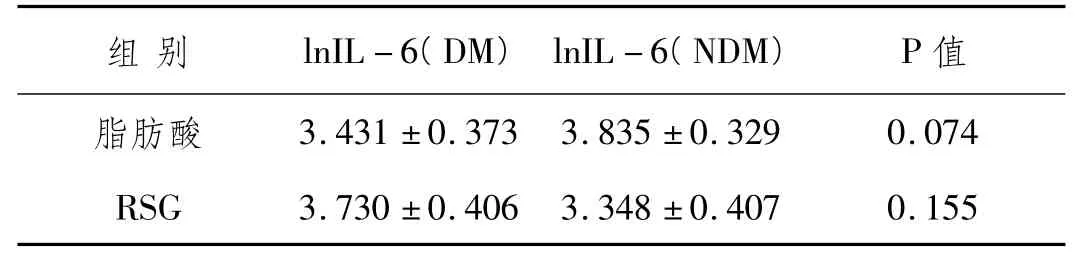
表3 脂肪酸及RSG干预的DM及非DM人网膜脂肪细胞分泌IL-6差值及lnIL-6比较
4 讨论
4.1 脂肪酸对IL-6分泌的影响:我们以不同浓度的脂肪酸培养内脏脂肪细胞24h来观察脂肪酸对脂肪细胞分泌IL-6的影响。结果显示脂肪酸有促进脂肪细胞IL-6分泌的作用,且呈剂量依赖性,0.125mmoL/L脂肪酸、0.25mmoL/L脂肪酸和0.5mmoL/L脂肪酸培养下,IL-6分泌分别为对照组的107%、154%和202%。脂肪酸具有升高脂肪细胞IL-6分泌的作用,而IL-6为一种重要的炎性细胞因子充当了脂肪组织内能量代谢-内分泌调节-炎症反应相互作用的媒介,降脂治疗可能对降低IL-6水平及预防IL-6诱导的IR、T2DM及其并发症的发生发展有重大意义。
4.2 RSG对IL-6分泌的影响:在脂肪酸的培基中加入RSG后,IL-6的浓度下降,表明RSG可逆转脂肪酸引起的IL-6分泌升高,并且逆转作用的强弱与RSG浓度有关,5umoL/L的RSG联合培养后,IL-6浓度下降至对照组142%,10umoL/L RSG可使IL-6完全降低至对照组水平。我们的实验结果表明RSG可逆转脂肪酸引起的网膜脂肪细胞IL-6的升高,即RSG有降低脂肪细胞IL-6分泌的作用。这与在体实验的研究结论不一致,如Steven M等[6]给T2DM人服用RSG4-8mg/d连续26周血IL-6水平无明显变化。RSG对IL-6影响在体内外的差异可能是由于在活体内RSG在降低脂肪细胞分泌IL-6的同时具有增加体重和肥胖的作用,而IL-6的分泌与BMI成正相关,离体实验可排除RSG的这种作用。
4.3 糖尿病人与非糖尿病人脂肪细胞基础IL-6分泌及脂肪酸和RSG干预效果的比较:我们的实验表明,10ummoL/LRSG能完全逆转脂肪酸对IL-6分泌的促进作用。而脂肪酸及RSG对DM人及非糖尿病人网膜脂肪细胞的作用无明显差异。脂肪酸及RSG对两种人脂肪细胞的作用机制可能是相同的,具体的作用机制仍需进一步研究。IL-6可通过多种途经导致IR,而本实验证实RSG可降低脂肪细胞IL-6水平,RSG可能通过降低IL-6的水平延缓IR及T2DM的发生,而对于已患T2DM者RSG可通过降低IL-6水平减少炎症反应及并发症的产生。
[1]Dandona P,Aljada A,Bandyopadhyay A.Inflammation:the link between insulin resistance,obesity and diabetes[J].Trends Immunol,2004,25(1):4 -7.
[2]Jove M,Planavila A,Carlos Laguna J,et al.Palmitate - Induced interleukin 6 production is mediated by protein kinase C and nuclear-factor kB activation and leads to glucose transporter 4 down - regulation in skeletal muscle cells[J].Endocrinology,2005,146(7):3087 -3095.
[3]郭军,周新丽.罗格列酮对2型糖尿病患者血清IL-6及CRP 表达的影响[J].山东医药,2004,44(13):34-35.
[4]Lagathu C,Bastard JP,Auclair M,et al.Chronic interleukin-6 treatment increased IL-6 secretion and induced insulin resistance in adipocyte:prevention by rosiglitazone[J].Biochem Biophys Res Connun,2003,311(2):372 -379.
[5]Steven M,Haffner,MD Andrew S,et al.Effect of rosiglitazone treatment on nontraditional markers of cardiovascular disease in patients with type 2 diabetes mellitus[J].Circulation,2002 ,106(6):679 -684.

