NaA型沸石吸附镍离子的实验研究*
,
(淮海工学院化学工程学院,江苏连云港 222005)
利用粉煤灰合成的沸石吸附金属离子具有积极的理论价值[1]。彭荣华等[2]进行了改性粉煤灰吸附处理含重金属离子废水的研究,重金属离子的去除率达97.5 %以上,达到国家排放标准;王春峰等[3]利用粉煤灰合成NaA型沸石对Cu(Ⅱ)等吸附行为进行了研究,结果表明NaA型沸石对Cu(Ⅱ)等有良好的吸附效果。镍及其化合物是水体和土壤中的重要污染物之一[4],笔者以粉煤灰合成的沸石作吸附剂,对镍离子的吸附进行了研究,同时在沸石的合成工艺上加以改进,使其合成过程更易实现,以期为重金属离子的处理提供新的思路。
1 材料和方法
1.1 试剂与仪器
试剂:氢氧化钠、硝酸镍、硫酸铜、铝酸钠、硝酸等,均为分析纯;实验用水为二次蒸馏水;粉煤灰(江苏省新海发电有限公司)。
仪器:D/Max-3B型X射线衍射仪、BS224S型电子天平、AS-990型吸收分光光度计等。
1.2 材料预处理及性能测试
将粉煤灰研磨至粒径<75 μm,820 ℃下加热1 h后降温,反复4次,除去易挥发杂质、有机物等。将煅烧好的粉煤灰再次研磨至粒径<75 μm,用2 moL/L的盐酸酸化2 h,除掉亚铁和钙离子,用去离子水洗至中性,烘干。
将制备好的硅铝凝胶[n(Na2O)∶n(Al2O3)∶n(SiO2)∶n(H2O)=22.64∶1.00∶4.19∶444.44]密封后在100 ℃的自生压下晶化并用去离子水洗涤至滤液的pH为8~9。洗涤后的产物于100 ℃烘干24 h,研成粉末。对改性前后的粉煤灰进行SEM观察后可以发现,原粉煤灰以表面光滑的球形颗粒为主,不利于吸附;而改性后粉煤灰观察到带有网状结构的NaA型沸石,这种网状结构比表面积大,孔径均匀、细小,具有良好的吸附性[6]。由于实验过程中多方面因素的影响,导致合成的NaA型沸石不纯,可能同时还合成了NaX型沸石[7]。
对改性前后的粉煤灰进行XRD测试可以发现,粉煤灰中的非晶物质、莫来石(Al6Si2O13)含量最多;而合成产物具有 NaA 型沸石的特征峰,且峰形规则、强度大,吸附过程中结构不会发生变化。
1.3 实验方法
pH对吸附的影响,即在温度等条件一定的情况下,考察不同溶液pH下NaA型沸石对镍离子的吸附效率;对于动力学研究,即在温度等条件一定的情况下,仅改变反应时间,分析比较镍离子的吸附平衡时间;对于热力学的研究,即在反应时间等条件一定的情况下,比较镍离子的最大饱和吸附量。
2 结果与讨论
2.1 pH对吸附的影响
pH对NaA型沸石吸附金属离子影响很大,原因是沸石中与吸附性能相关官能团对pH的依赖性比较大,而镍具有两性[8]。所以实验中移取100 mL 20 mg/L的Ni2+标准使用液,在pH<6.5的范围内调节pH,再分别投加0.100 0 g沸石,25 ℃振荡2 h后过滤,稀释,测Ni2+浓度。考察镍离子吸附量与pH的关系,如图1所示。由图1可以看出,NaA型沸石对镍离子的吸附量先随着pH的增大而急剧增加,当pH到达一定值后,吸附量趋于稳定。在pH为5.5时吸附量最大,为16.254 mg/g。产生这种现象的原因是当pH较低时,H+大量存在于溶液中,与离子竞争吸附剂表面的吸附点位,所以吸附量比较低,随着pH升高,溶液中的H+逐渐减少,与离子的竞争能力减弱,Ni2+获得吸附点位的几率升高,吸附量也随之增加[9]。

图1 不同pH对NaA沸石吸附镍离子的影响
2.2 动力学研究
取Ni2+标准使用液于不同的锥形瓶中,调节pH至5.5±0.1,分别加入0.100 0 g沸石,不同温度下(15~45 ℃)分别振荡100~240 min,过滤,测Ni2+浓度。结果如图2所示。由图2可以看出,随着吸附时间的增加,镍离子的吸附量先大幅度增加,然后逐渐趋于稳定;在实验温度范围内,随着温度的升高镍离子的吸附量增加。为了分析沸石吸附镍离子的吸附速率模型和温度对吸附速率的影响,实验采用一级吸附速率方程、二级吸附速率方程处理。

图2 不同温度下时间对Ni2+吸附量的影响
2.2.1 Lagergren准一级动力学模型
根据准一级动力学方程,以ln (1-q/qe)对t作图并求得k1,所得参数见表1。

表1 准一级动力学模型下的参数
通过外推法(t→∞)和试错法确定qe值[22]。从表1中可见,4个拟合方程的相关系数R都在0.96以上,在不同的温度下,相同时间内反应速率常数k1并不相同,但都随着温度的升高而升高,说明温度升高利于反应速率的增大。
2.2.2 准二级动力学模型
根据二级反应方程式作t/qt—t图,并求参数,结果见表2。

表2 准二级动力学模型拟合参数

2.3 等温吸附研究
准确配制pH为5.5±0.01不同初始质量浓度的Ni2+溶液,加入0.300 0 g沸石,于25 ℃振荡120 min后过滤,测Ni2+的质量浓度。在15、25、35、45 ℃下重复实验。
图3是在不同的镍离子含量下,沸石吸附Ni2+达到平衡后,单位质量沸石对镍离子的吸附量qe对溶液中镍离子的含量ρe作图得到的关系曲线。由图3可看出,曲线开始一般有一较陡的变化,而后逐渐变得平缓接近于平衡。曲线初始阶段的陡增说明吸附剂对Ni2+具有很强的亲和性。一般而言,在一定温度范围内,金属吸附率随温度升高而增大。实验结果显示,其他条件一致时,温度升高,吸附量升高。不同温度下,溶液平衡浓度与单位吸附量间遵循一定的规律,实验从Langmuir、Freundlich这2个等温方程进行分析。

图3 不同温度下NaA沸石吸附Ni2+时ρe与qe的关系
2.3.1 Langmuir吸附等温式
在15、25、35、45 ℃条件下NaA沸石吸附Ni2+的Langmuir直线型等温线见图4。沸石对Ni2+的最大吸附量qmax及Langmuir常数b可由方程根据所拟直线的斜率计算得出,结果见表3。

图4 NaA沸石吸附Ni2+的Langmuir直线型等温线

温度/℃拟合方程常数qmax/(mg·g-1)b/(L3·mg-1)R15y=0.048x+0.49420.830.09100.998025y=0.045x+0.46322.220.09200.997935y=0.043x+0.41423.260.10380.998045y=0.041x+0.39024.390.10520.9979
由表3可知,当溶液温度从15 ℃升至45 ℃时,沸石对Ni2+最大吸附量均增加,可见升高温度有利于吸附能力的提高。Langmuir常数b是评估吸附剂性能的一个重要参数,它反映了低浓度下吸附剂的吸附效果。表3中也显示了随温度升高,常数b均呈上升趋势,这说明升温有利于沸石对Ni2+的吸附。
平衡参数RL可根据下式求得:
RL=1/(1+bρi)
(1)
式中:b为Langmuir常数,L3/mg;ρi溶液不同的初始浓度,mg/L。当RL在0~1时,表明有利于吸附,RL大于1时不利于吸附,RL=1时为线性,RL=0时不可逆。通过计算发现,实验中的平衡参数RL均在0~1,因此选用沸石作为吸附剂去除水溶液中的Ni2+是可行的。不同温度下,沸石吸附Ni2+过程的热力学参数ΔG0、ΔH0、ΔS0可根据下式求出:
ΔG0=RTlnK
(2)
ΔG0=ΔH0-TΔS0
(3)
式中:R为气体常量8.314 J/(mol·K);T为热力学温度,K;K为1 000×b×58.69。
ΔG为负时表明沸石吸附Ni2+是一个自发的过程。ΔG对T作图(见图5)呈线性,由图5的截距和斜率可以得出吸附过程的ΔH0=4 237 kJ/mol,ΔS0=85.96 kJ/(mol·K)。ΔH0为正表明为吸热过程,同时ΔS0为正反映吸附过程中随着温度的升高吸附界面上的混乱度升高。

图5 NaA沸石吸附Ni2+过程中吉布斯自由能ΔGo与T关系
2.3.2 Freundlich吸附等温式
对Freundlich等温方程两边求对数变形,并以lnρe对lnqe作图,得常数kf、1/n。图6为15、25、35、45 ℃时沸石吸附镍离子的Freundlich吸附等温线。由图6可见,随温度升高吸附量均依次增大。此结论与Langmuir分析所得结论一致。经拟合所得Freundlich等温线相关系数R及参数kf、n见表4。由表4可见,kf随温度升高而增大;1/n均在0.1~0.5,说明沸石对镍离子的吸附容易发生。
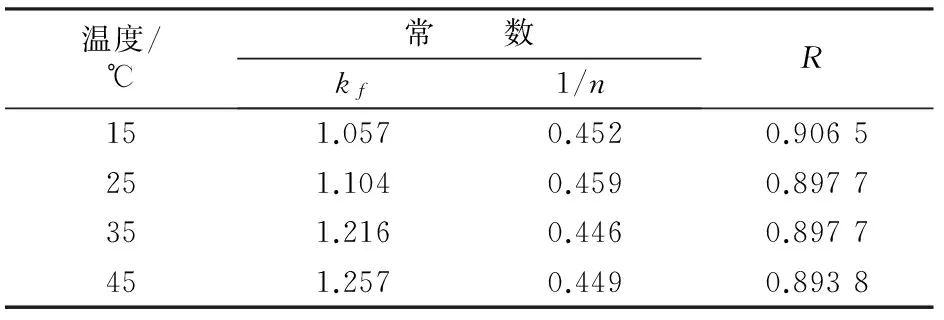
图6 Freundlich等温线
比较Langmuir和Freundlich等温线相关性系数R可以看出,在对应温度下,Langmuir等温线的相关系数R大都在0.99以上,均优于Freundlich的相关系数。这表明沸石对Ni2+的吸附过程更好地遵循Langmuir等温方程。
3 结论
pH=5.5时NaA沸石对镍离子的吸附量最大;吸附等温方程的拟合结果表明NaA沸石对镍离子的吸附过程与Langmuir等温式的拟合度最佳;动力学分析拟合结果表明NaA沸石对镍离子吸附过程与准二级动力学方程拟合度最佳;温度升高,有利于NaA沸石对镍的吸附,NaA沸石对镍离子的吸附过程为自发的、吸热的过程;增大溶液初始浓度、有利于提高NaA沸石对镍离子的吸附量,但吸附效率下降。
[1] Domenico Caputoa,Francesco Pepe.Experiments and data processing of ion exchange equilibria involving Italian natural zeolites:a review[J].Microporous and Mesoporous Materials,2007,105(3):222-231.
[2] 彭荣华,陈丽娟,李晓湘.改性粉煤灰吸附处理含重金属离子废水的研究[J].材料保护,2005,38(1)48-50.
[3] 王春峰,李健生,王连军,等.粉煤灰合成NaA型沸石对重金属离子的吸附动力学[J].中国环境科学,2009,29(1):36-41.
[4] 付桂珍,张保见.蒙脱石/粉煤灰颗粒复合材料吸附含镍废水的研究[J].水处理技术,2009,35(2):29-31.
[5] Inglezakis V J,Loizidou M D.Ion exchange of some heavy metal ions from polar organic solvents into zeolite[J].Desalination,2007,211:238-248.
[6] Maria K,Doula.Removal of Mn2+ions from drinking water by using clinoptilolite and a clinoptilolite-Fe oxide system[J]. Water Res.,2006,40(17):3167-3176.
[7] 陈国安.沸石处理重金属离子废水的试验研究[J].矿产保护与利用,2001(6):17-19.
[8] 彭荣华,李晓湘.钠基累托石对水溶液中镍(Ⅱ)离子的吸附性能[J].材料保护,2009,42(2):77-81.


