共沉淀法制备四氧化三铁包覆云母珠光颜料*
, , , ,
(1.华东理工大学化学与分子工程学院,上海 200237;2.温州大学;3.扬州大学测试中心)
通常制备云母/Fe3O4是在一定的pH和温度下,让一定物质的量比的Fe2+和Fe3+的盐溶液在云母悬浮液中共沉淀生成Fe3O4,然后在惰性气氛中煅烧,即可制得云母/Fe3O4;或直接用二价铁的盐溶液与一定量的氧化剂发生反应,然后在云母悬浮液中沉淀,在惰性气氛中煅烧[1];或者是在云母表面沉积Fe2O3,通过控制还原性气氛煅烧制备云母/Fe3O4[2]。但是上述方法中,在用氧化剂氧化二价铁时,很难掌握准确的比例,因为二价铁接触空气容易氧化;在还原性气氛中还原云母/Fe2O3时,对设备和操作的要求很高。这些均影响了云母/Fe3O4大规模的生产和开发。笔者采用共沉淀法,即在一定的温度下,将三价铁和二价铁盐溶液滴入到云母悬浮液中,通过控制共沉淀的pH,让沉淀出来的Fe3O4均匀、致密地沉积在云母上,并在惰性气氛中煅烧,从而制得黑色的珠光颜料。
1 实验部分
1.1 仪器与设备
BT4A1601PPE200AA010000型恒流泵;BT50-1J型蠕动泵;DICAWOP24000G210E型pH控制器;WMZK-01温度指示控制仪; SK2-2-12管式电阻炉;电热恒温真空干燥箱;Color i5型台式分光测色仪。
1.2 云母/Fe3O4的制备
反应所用的试剂均为分析纯。反应用的去离子水煮沸5 min以除去氧气。在烧杯中放入100 mL煮沸过的去离子水和10 g云母,通过磁力搅拌形成悬浮液。在通氮气情况下,用蠕动泵将一定物质的量比的FeCl3·6H2O和FeCl2·4H2O的混合溶液加入到烧杯中,在pH控制器的控制下,滴入一定量的氢氧化钠溶液,使pH在反应中始终维持在设定数值。反应物加完后,继续搅拌0.5 h,让反应更加完全;然后抽滤,洗涤,在60 ℃下真空干燥;最后在管式炉中通氮气、350 ℃下煅烧3 h。
采用共沉淀的方法在云母表面包覆一层纳米Fe3O4,实验原理如下:

在理想情况下,Fe3+和Fe2+的物质的量比应为2∶1,但是在实际操作中由于Fe2+在空气中非常容易被氧化,因此要想在云母表面包覆的Fe3O4纯度较高,就要把Fe2+氧化的因素考虑进去,Fe3+和Fe2+的物质的量比应小于2∶1[3]。
1.3 产品珠光效果的测定
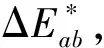
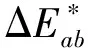
2 结果与讨论
2.1 不同因素对包覆和珠光效果的影响
2.1.1 不同pH对包覆和珠光效果的影响
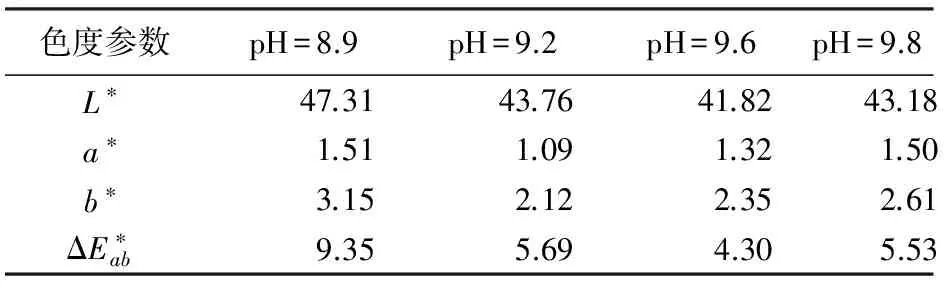
在反应温度为30 ℃,NaOH浓度为0.5 mol/L,n(Fe3+)∶n(Fe2+)=1.364时,考察pH对包覆形态的影响。在各种pH条件下,Fe3O4包覆云母的高倍扫描如图1所示。图1a为pH=8.9时Fe3O4包覆云母的HRSEM图,图1a表明,Fe3O4在云母表面包覆的致密性较差,很不均匀。但样品的a*和b*也达到最大(见表1),显示明显的红色和黄色,可能该样品中Fe2O3占有较大的比例。产生的原因与Fe3+和Fe2+共沉淀的pH有关。此时pH较低,根据溶度积规则,溶液中的Fe3+优先形成β-FeOOH,故煅烧之后产生许多Fe2O3,从而使样品呈现红色。
由图1b可以看出,当pH恰好为Fe3+和Fe2+共沉淀的pH时,即反应的pH=9.2时,云母表面所包覆的Fe3O4颗粒很均匀,平均粒径为70~80 nm。此时,样品包覆得最致密、平整。当pH高于9.2,也即pH=9.6或者9.8时(见图1c和d),云母表面所包覆的Fe3O4团聚现象很严重,凹凸不平,表面出现许多“空洞”。而且pH越高,云母表面出现的“空洞”也就越多。所测定的a*和b*也达到较大值,显示明显的红色和黄色。这是因为,溶液的pH高于Fe3+和Fe2+共沉淀的pH,生成Fe(OH)3的趋向大于Fe(OH)2,且生成Fe3O4以及β-FeOOH粒子的速度比在云母表面沉积的速度大得多,使得瞬间生成的大量混合粒子来不及均匀地沉积,而在云母表面发生团聚,因此云母表面出现许多“空洞”。

a—pH=8.9;b—pH=9.2;c—pH=9.6;d—pH=9.8
色度参数pH=8.9pH=9.2pH=9.6pH=9.8L∗47.3143.7641.8243.18a∗1.511.091.321.50b∗3.152.122.352.61ΔE∗ab9.355.694.305.53
注:L*为亮度值;a*和b*值为色度坐标,a*=红(+),绿(-);b*=黄(+),蓝(-)[4-5]。
2.1.2 不同NaOH浓度对包覆效果的影响
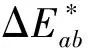
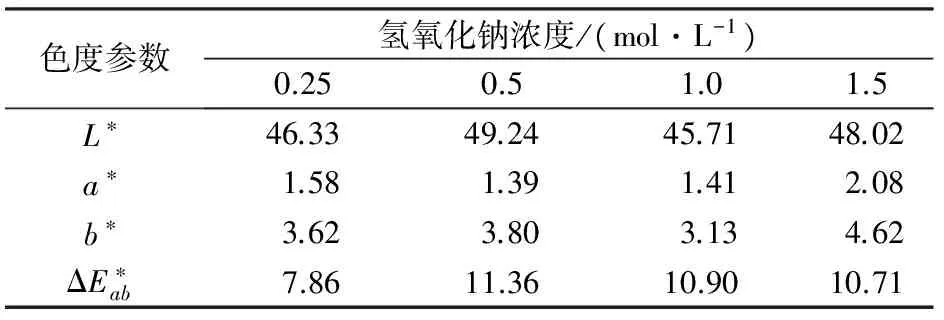
表2 不同氢氧化钠浓度条件下包覆样品的色度参数

a—c(NaOH)=1.0 mol/L;b—c(NaOH)=0.5 mol/L
图2不同NaOH浓度时Fe3O4包覆云母的HRSEM图
2.1.3n(Fe3+)/n(Fe2+)对样品包覆效果的影响
根据文献[9]报道,n(Fe3+)/n(Fe2+)直接影响了纳米Fe3O4的形貌,因此也可能影响对样品包覆的效果。同时,n(Fe3+)/n(Fe2+)对样品的色度坐标参数a*和b*影响也较大(见表3)。
固定反应温度为30 ℃,共沉淀反应的pH=9.2,c(NaOH)=0.5 mol/L的条件下,考察初始n(Fe3+)/n(Fe2+)对包覆形态的影响。Fe3O4包覆云母的HRSEM图如图3所示。
如图3a所示,当n(Fe3+)/n(Fe2+)=1.2时,由于Fe2+过量,不只是Fe3O4在云母表面沉积,生成的过量Fe(OH)2团聚在云母的表面,由于Fe(OH)2本身是白色沉淀,但它极不安定,一遇到空气立即与氧结合成FeO·xFe2O3·yH2O,再进一步氧化成铁红晶种[6],使包覆不平整,所以样品即使在氮气氛围中煅烧,仍然会发现样品是红色,表3中样品的a*和b*值较高也说明了这一点。随着n(Fe3+)/
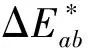

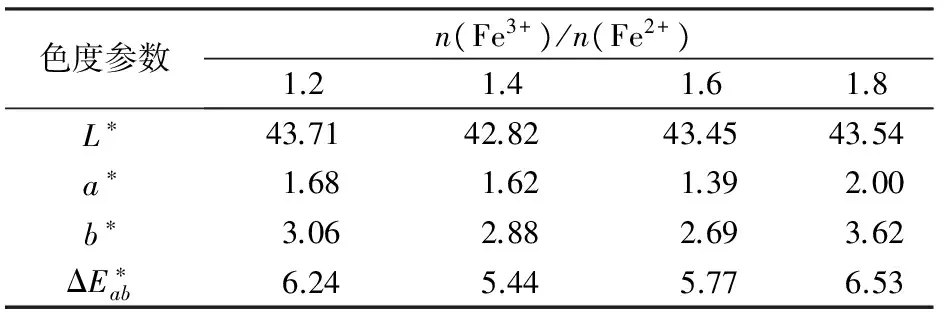
a—n(Fe3+)/n(Fe2+)=1.2;b—n(Fe3+)/n(Fe2+)=1.4;
2.1.4 包膜温度对包覆效果的影响
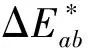
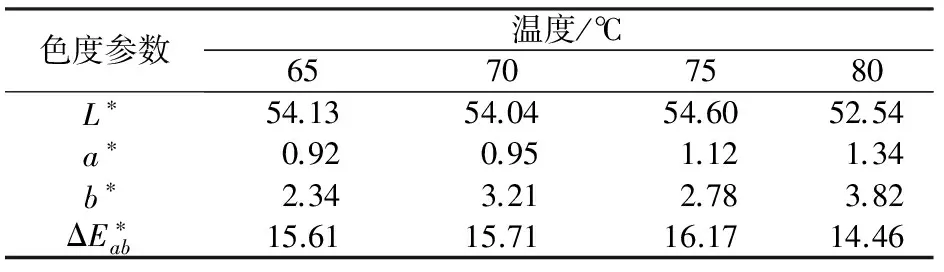
表4 不同温度条件下包覆样品的色度参数
2.2 XRD分析
图4为云母、纳米Fe3O4粒子和Fe3O4包覆云母样品的XRD衍射图。该样品制备条件为:pH=9.2、c(NaOH)=0.5 mol/L、n(Fe3+)/n(Fe2+)=1.6、温度为75 ℃。从图4可知,云母衍射峰出现在17.5、26.5、35.8、45.1°处,分别对应2M1型白云母的(00l)反射峰(004)、(006)、(008)、(0010)[7]。各(00l)反射峰强度较大,而且峰形尖锐、对称,这些都表明实验所选云母的结晶度较高。实验所选Fe3O4的衍射峰出现在30、35.4、43.1、53.7、57.1、62.8°处,分别对应立方相Fe3O4的(220)、(311)、(400)、(422)、(511)、(440)晶面[8]。云母表面包覆Fe3O4后,样品在2θ为17.5、26.5、45.1°处出现的衍射峰,对应于云母的特征衍射峰;而在2θ为35.4、43.1、57.1、62.8°处出现的弱衍射峰,则对应于Fe3O4的特征衍射峰,说明包覆在云母外表面的物质含有Fe3O4。
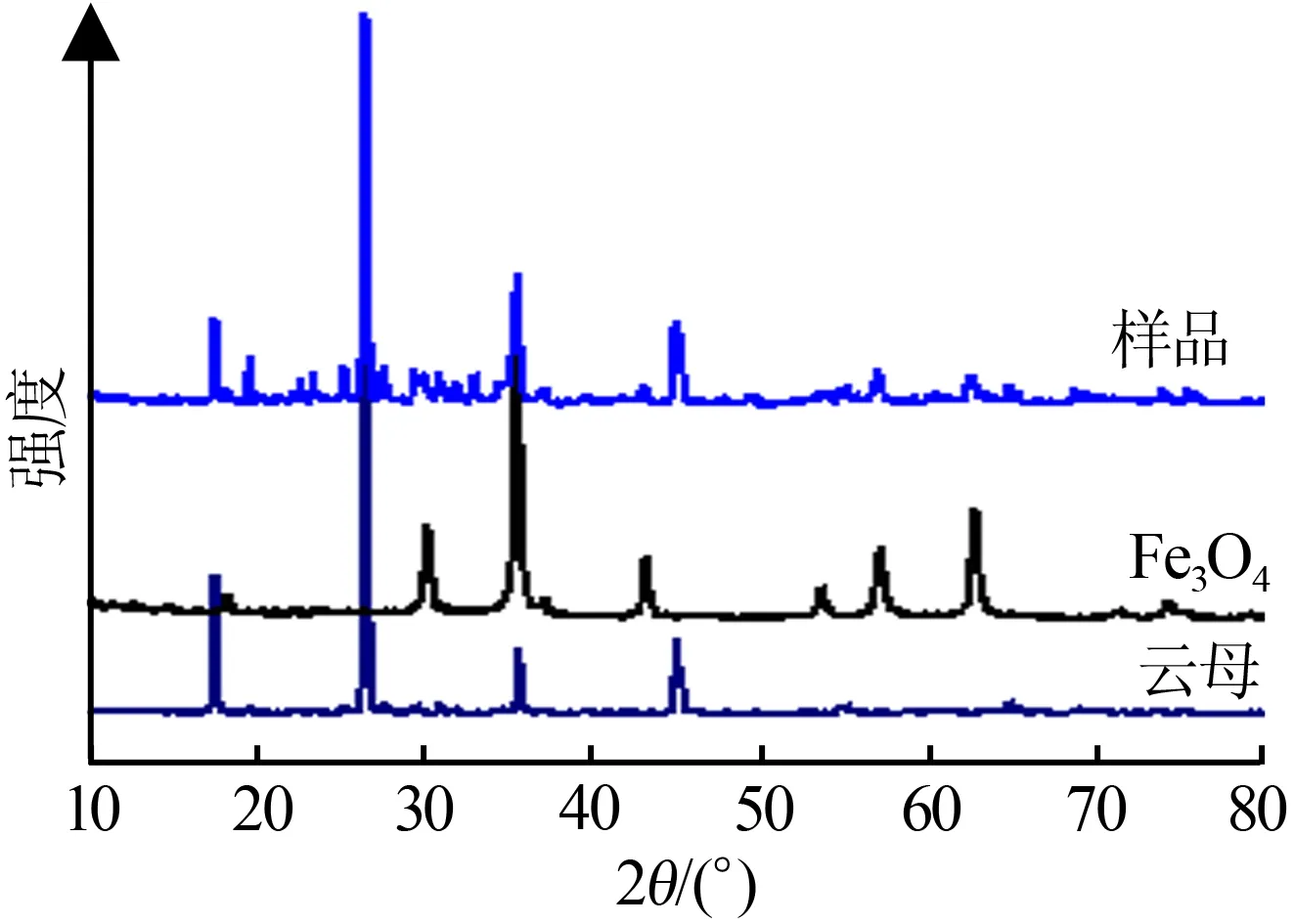
图4云母、纳米Fe3O4粒子和Fe3O4包覆云母样品的XRD衍射图
3 结论
pH、氢氧化钠浓度、n(Fe3+)/n(Fe2+)和温度对Fe3O4在云母表面沉积的平整性均有影响。氢氧化钠的浓度为0.5 mol/L,pH恰好为Fe3+和Fe2+共沉淀的pH时,包覆层平整,珠光效果明显;无论是Fe3+过量,还是Fe2+过量,均对包覆层性能产生不利的影响,只有当n(Fe3+)/n(Fe2+)=1.6时,包覆层相对平整和致密;当反应温度为75 ℃时,珠光效果最好。
[1] Franz K D,Ambrosius K,Kanpp A,et al.Nacreous pigments:US,486779[P].1989-09-19.
[2] Franz K D,Griessmann A,Lenz G,et al.Cosmetic formulations with carrier-free iron oxide platelets:US,4828826[P].1989-05-09.
[3] Wan J,Tang G,Qian Y.Room temperature synthesis of single-crystal Fe3O4nanoparticles with superparamagnetic property[J]. Applied Physics A:Material Science & Processing,2007,86(2):261-264.
[4] Wan J,Yao Y,Tang G.Controlled-synthesis, characterization,and magnetic properties of Fe3O4nanostructures[J].Applied Physics A:Material Science & Processing,2007,89(2):529-532.
[5] Argoitia A,Phillips R W,Nofi M R,et al.Chromatic diffractive pigments and foils:EP,1353197[P].2003-10-15.
[6] 朱骥良,吴申年. 颜料工艺学[M].2版.北京:化学工业出版社,2002:328-329.
[7] 汪灵,李朝毅. 苏州光福瓷石中绢云母的X射线衍射及红外吸收光谱研究[J].岩石矿物学杂志,1991,10(3):270-278.


