二氧化钛/铁酸钴磁性光催化材料的制备及表征*
, ,,
(大连大学物理科学与技术学院,辽宁大连 116622)
TiO2半导体光催化剂因其在去除水和空气中各种污染物方面的潜在应用而受到了人们的广泛关注[1],然而粉末状TiO2在处理污水过程中存在分离和回收困难的问题,限制了其实用化进程。为克服粉状TiO2光催化剂分离难题,自20世纪90年代末,研究者利用纳米磁性粒子具有大比表面积和良好分离回收特性,将其作为光催化剂的载体,制备出以磁性粒子为磁核和具有催化活性的TiO2为外壳的复合粒子,即磁载TiO2光催化剂。磁载TiO2光催化剂既有粉状TiO2优良的光催化活性,又易于使TiO2从体系中分离回收,便于循环使用,因此受到了人们的重视[2-3]。采用廉价、工艺简单的制备方法获得高性能的磁载TiO2,是工业化生产所追求的主要目标。制备纳米TiO2最常用的原料是Ti(OR)4、TiCl4和TiOSO4,工业生产中应用较多的是TiCl4和TiOSO4。与Ti(OR)4和TiCl4相比,TiOSO4价格低廉、原料易得,以其作为制备磁载纳米TiO2的基本原料,具有良好的工业化应用前景[4-5]。目前采用TiOSO4为原料制备磁载TiO2光催化剂的报道还不多见。笔者首先通过化学沉淀法结合超声波技术制备出分散性好、磁性强、化学性质和晶相稳定且具有超顺磁性的CoFe2O4纳米磁性粒子,然后以其为载体通过TiOSO4水解法制备了TiO2/CoFe2O4复合光催化材料,并对其物理化学性质和光催化活性进行了研究。
1 实验部分
1.1 CoFe2O4纳米磁性粒子的制备
按n(Co2+)∶n(Fe3+)=1∶2称取一定量的Co(NO3)2·6H2O(AR)和FeCl3·6H2O(CR),溶于100mL去离子水中,机械搅拌同时超声分散(功率为80 W),升温至62 ℃;然后加入浓度为3.5 mol/L的NaOH(AR)溶液,调节pH至11~13;继续机械搅拌并超声分散,加热升温至72 ℃,恒温反应1 h,磁力沉降,水洗3次,得到CoFe2O4纳米磁性粒子。
1.2 TiO2/CoFe2O4复合光催化材料的制备
取一定量的TiOSO4(纯度为93%)放入三口烧瓶中,加入100 mL去离子水,将三口烧瓶置于60 ℃恒温水浴锅中,机械搅拌5 min得到无色透明的TiOSO4水溶液,加入上述CoFe2O4纳米磁性粒子,机械搅拌10 min后用浓氨水调节pH为7~8,在60 ℃恒温水浴条件下反应1 h,将生成的固体物质离心水洗3次,在100 ℃下烘干,然后在500 ℃下焙烧即得TiO2/CoFe2O4复合光催化材料。
1.3 表征方法
采用美国Lake Shore7410型振动样品磁强计在室温下对样品的磁性能进行测定;采用日本岛津XRD-6000型X射线衍射仪表征样品的相结构和相组成;采用JSM-5600V型透射电子显微镜对复合材料的形貌和分散性进行观察。
1.4 光催化活性的测定
光催化活性评价通过研究降解甲基橙(AR)实现。在培养皿中放入50 mL质量浓度约为20 mg/L的甲基橙,对应加入1.0 g催化剂,搅拌均匀,使用254 nm、8 W紫外灯照射,每隔30 min取样,离心,取上清液,采用721分光光度计在468 nm处测定甲基橙的吸光度A,通过公式计算得到甲基橙溶液在不同光照时间的质量浓度ρ。发现在低浓度范围内甲基橙的吸光度和浓度之间有很好的线性关系,且遵守朗伯-比耳定律。以脱色率来衡量降解程度,试样的脱色率η以下式计算:
η=(ρ0-ρ)/ρ0×100%
式中:ρ0为甲基橙溶液初始质量浓度(mg/L);ρ为不同光照时间甲基橙溶液的质量浓度(mg/L)。
2 结果与讨论
2.1 XRD分析
图1为CoFe2O4(a)和TiO2/CoFe2O4复合光催化材料(b)的XRD谱图。由图1a可知,XRD谱图与标准CoFe2O4谱图(JCPDS 22-1086)完全对应,表明制备的CoFe2O4粒子以尖晶石结构存在;图1b中,在2θ为25.41°、38.72°、48.07°、53.93°和54.3°处出现的衍射峰,分别对应锐钛矿型TiO2的(101)、(004)、(200)、(105)和(211)的特征峰,表明负载的TiO2以高活性的锐钛矿型存在,而CoFe2O4相衍射峰的位置没有变化,由于不同相间元素扩散,谱图中出现少量杂峰,没有出现其他中间相如CoTiO3或Fe2(TiO3)3的衍射峰,由此得出复合材料中TiO2和CoFe2O4结晶过程为各自生长,没有发生反应生成新的物相。
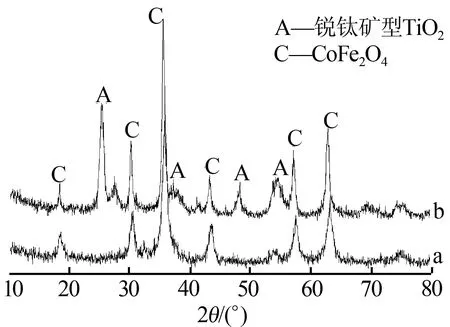
图1 CoFe2O4(a)和TiO2/CoFe2O4(b)复合光催化材料的XRD谱图
2.2 TEM分析
图2为CoFe2O4(a) 和TiO2/CoFe2O4复合光催化材料(b)的TEM照片。从图2a可以看出,CoFe2O4颗粒分散性良好,粒子为球形,粒径比较均匀细小,在10 nm左右;从图2b可以看出,TiO2/CoFe2O4复合光催化材料颗粒尺寸为40~50 nm,并且有一定程度的团聚,这可能是由于在包覆过程中分散不均匀所致。

图2 CoFe2O4(a) 和TiO2/CoFe2O4(b)复合光催化材料的TEM照片
2.3 磁性能分析
图3为CoFe2O4和TiO2/CoFe2O4复合光催化材料的磁性能曲线。从图3可以看出,CoFe2O4粒子和TiO2/CoFe2O4复合光催化材料基本没有表现出铁磁性物质所具有的磁滞现象,而且矫顽力和剩磁几乎可以忽略,这说明制备的光催化材料具有一定的超顺磁性。因此,在无外加磁场作用下,催化剂能够很容易地分散在反应体系中,当赋予悬浆反应体系外加磁场时,能够方便地回收催化剂。另外,TiO2/CoFe2O4复合光催化材料的磁性比CoFe2O4的磁性弱得多,这是由于单位质量中磁性物质含量减少导致。实验表明,磁性能虽有所下降,但是TiO2/CoFe2O4复合光催化材料仍能通过外磁场进行回收利用。
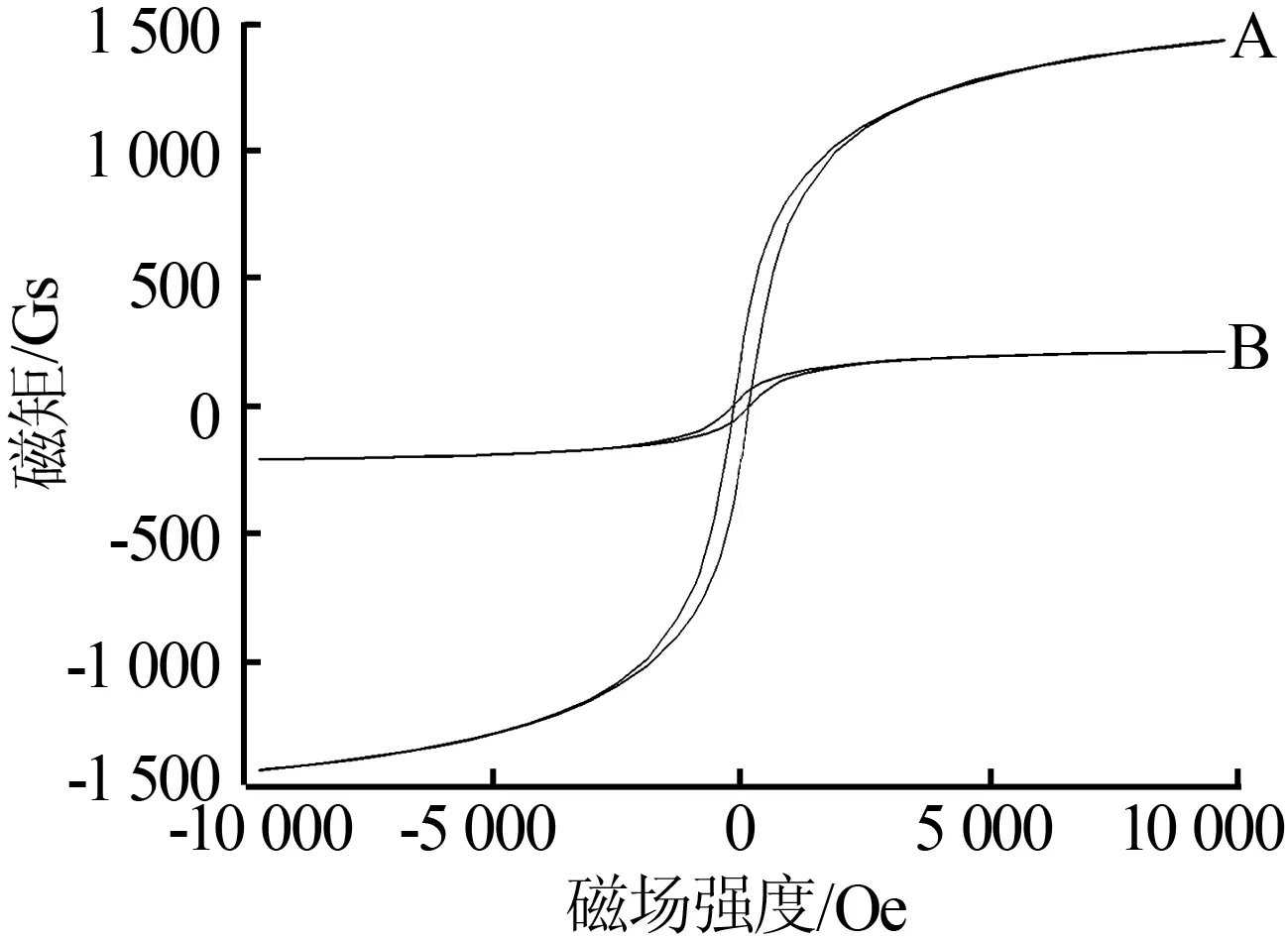
A—CoFe2O4;B—TiO2/CoFe2O4
2.4 光催化性能的研究
图4是在紫外光条件下CoFe2O4、TiO2/CoFe2O4及无催化剂时甲基橙降解效果图。从图4可以看出,在无催化剂时紫外光对甲基橙几乎没有降解作用,因而可以忽略甲基橙自降解对催化剂活性评价的影响。如图4所示加入CoFe2O4后甲基橙的降解率很低,这可能是由于吸附产生的效果,随着光照时间的增加甲基橙溶液浓度没有降低,说明CoFe2O4在紫外光照射下不具有光催化活性;相同条件下TiO2/CoFe2O4复合光催化材料光催化降解甲基橙2 h甲基橙降解率达到70%,表明该催化剂具有良好的光催化活性。
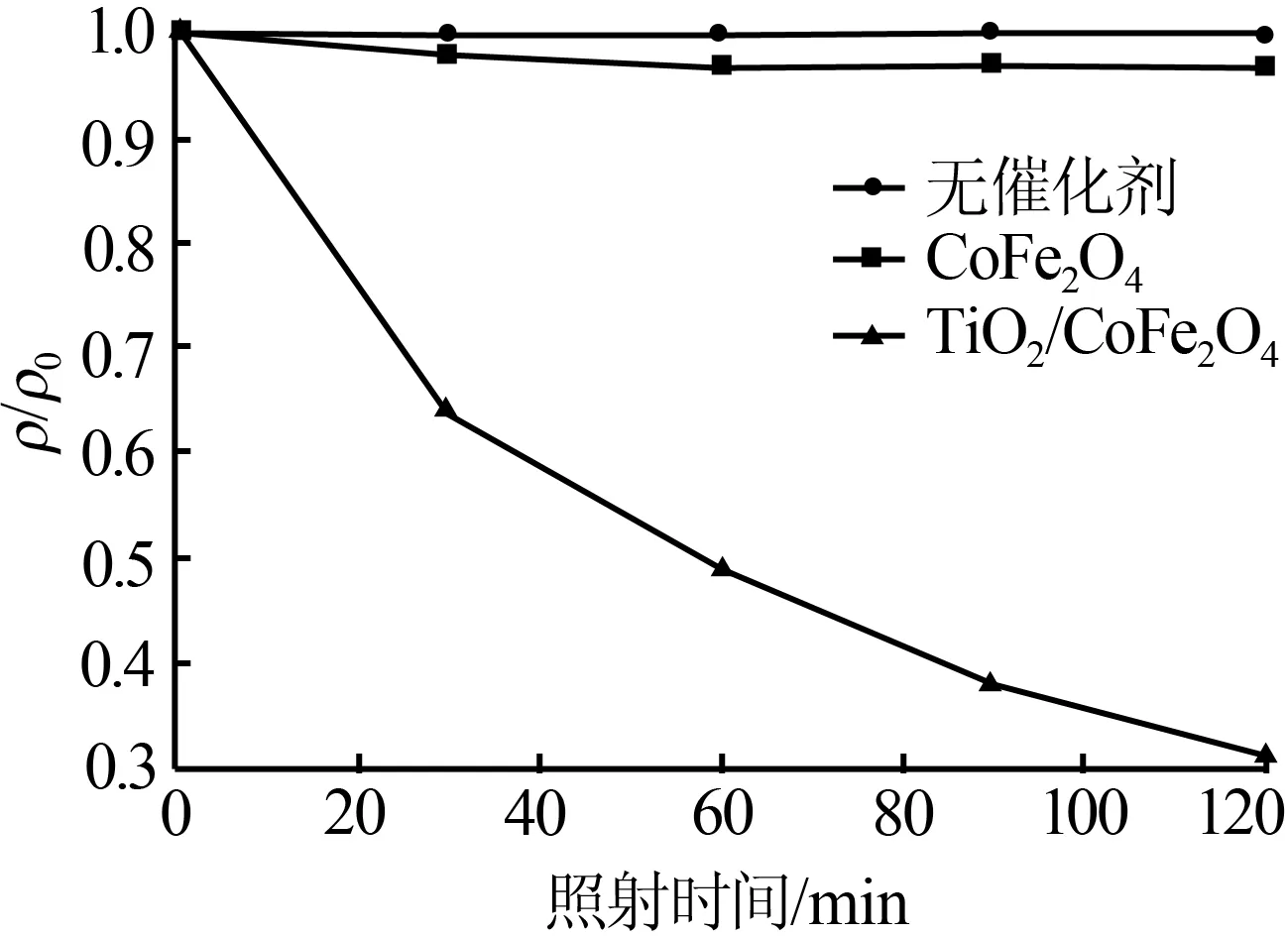
图4 紫外光下CoFe2O4、TiO2/CoFe2O4及无催化剂时对甲基橙的降解性能
将TiO2/CoFe2O4复合光催化材料光催化降解甲基橙2 h,然后通过磁分离回收、烘干,循环使用3次测定其降解率如图5所示。从图5可以看出,随着重复使用次数的增加,TiO2/CoFe2O4复合光催化材料的光催化活性只是略微下降,说明该催化剂具有良好的重复使用性能。
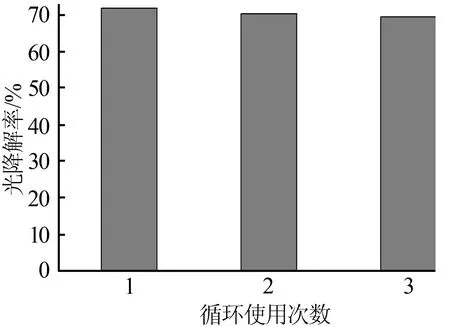
图5 循环使用次数对TiO2/CoFe2O4复合光催化材料光催化性能的影响
3 结论
通过化学沉淀法结合超声波技术制备了CoFe2O4纳米磁性粒子,以其为载体采用廉价、工艺简单的TiOSO4水解法制备了易于磁性固液分离的TiO2/CoFe2O4复合光催化材料。结果表明:制备的TiO2/CoFe2O4复合光催化材料晶型较好,TiO2和CoFe2O4分别以锐钛矿型和尖晶石结构存在,复合材料中TiO2和CoFe2O4结晶过程为各自生长,没有发生反应生成新的物相,颗粒尺寸为40~50 nm,且具有超顺磁性;TiO2/CoFe2O4复合光催化材料有较高的光催化活性同时具有良好的重复使用性能。
[2] Fu Wuyou,Yang Haibin,Li Minghua.Preparation and photocatalytic characteristics of core-shell structure TiO2/BaFe12O19nanoparticles[J].Materials Letters,2006,60(21/22):2723-2727.
[3] Gad-Allah T A,Shigeru Kato,Shigeo Satokawa,et al.Treatment of synthetic dyes wastewater utilizing a magnetically separable photocatalyst (TiO2/SiO2/Fe3O4):Parametric and kinetic studies[J].Desalination,2009,244(1/2/3):1-11.
[4] Salari M,Mousavikhoie S M,Marashi P,et al.Synthesis of TiO2nanoparticles via a novel mechanochemical method[J].Journal of Alloys and Compounds,2009,469(1/2):386-390.


