喷施草甘膦对大豆表皮细胞超微结构影响的研究
卜贵军
(1.湖北省生物资源保护与利用重点实验室(湖北民族学院),湖北 恩施 445000;2.湖北民族学院 生物科学与技术学院,湖北 恩施 445000)
草甘膦是内吸的,无选择性的除草剂.草甘膦可以通过抑制莽草酸途径,来抑制芳香族氨基酸的合成,从而除掉杂草.但由于它是非选择性的,在除掉杂草的同时,如果遇到绿色作物,也会对其造成伤害.随着生物技术的发展,一批抗草甘膦转基因作物[1-2]的出现,使问题得到解决.而转基因大豆中主要是抗除草剂草甘膦转基因大豆[3-7],到2007年已占到全球大豆的64%[8].
抗草甘膦大豆通过转入CP4-EPSPS,使得大都对草甘膦不敏感,这样芳香族氨基酸能够继续合成,大豆生长发育能正常进行.
种植抗草甘膦大豆就需要配套的使用大量的草甘膦以除去杂草.草甘膦市场越来越大.重新认识草甘膦对抗草甘膦植物和普通植物的伤害就变得非常必要.
Delannay X等[9]的研究表明,对抗草甘膦大豆喷施草甘膦对株型的快速生长无影响,不会导致显著的伤害.Elmore R W,Nelson K A等的研究表明[10-11],按照说明书使用对抗草甘膦大豆施用草甘膦,不会影响生长和产量.Kelly A等[12]的研究表明,草甘膦对抗草甘膦转基因大豆的叶面积指数、生殖生长、营养生长以及产量都不会有明显影响.然而,这些研究都停留在宏观水平,喷施草甘膦后,关于抗草甘膦大豆的叶片表皮细胞的变化,开口气孔个数变化及气孔结构的变化的研究,国内外还未见有报道.
本研究以抗草甘膦大豆和东农42为材料,喷施草甘膦,利用扫描电镜来研究草甘膦对东农42和抗草甘膦大豆的不同作用.本研究引入了草甘膦对植物的超微结构影响的研究,为草甘膦的作用机理研究拓展新的视野.
1 材料与方法
1.1 试验材料
东农42(Glycinemax(L.) Merr. Dongnong 42)由东农大豆研究所提供.转基因大豆GTS 40-3-2(Glycinemax(L.) Merr.GTS 40-3-2)由东农转基因作物检测中心提供.草甘膦为41%的草甘膦异丙铵盐.
1.2 田间喷药
大豆种植,采用小区对比相邻种植设计.行距62 cm,株距12 cm,行长50 m.大豆处于营养生长,第3到第5复叶期,即V3~V5期,喷施草甘膦.分别在第1次喷药前(0 d)和喷药后的第1、2、3、4、5、6、7 d,14 d,21 d,28 d,42 d取样.设4个处理:东农42不喷药、东农42喷药、GTS 40-3-2不喷药、GTS 40-3-2喷药.根据说明书按1∶100喷施草甘膦.
1.3 取样
取下叶片,置于冰盒中,带回实验室.叶片取材说明:取3次,每次都取第3片三重复叶的中间一片得第2叶脉与第3叶脉中间部位.
1.4 扫描电镜观察
扫描电镜处理过程包括:取材、固定、冲洗、脱水、置换、用ES-2030(HITACHI)型冷冻干燥仪对样品进行干燥、粘样、在E-1010(HITACHI)型离子溅射镀膜仪镀膜、将处理好的样品放在的S-3400扫描电镜(日立公司)下观察.
2 结果与分析
2.1 东农42喷施草甘膦后叶片的扫描电镜观察
喷施草甘膦后东农42的叶片上表皮的变化如图1所示.
在喷药后第4天时,东农42的上表皮细胞出现变形(图1-17).在喷药后第6天和第7天时,上表皮细胞变形严重,并下陷明显(图1-25,29).在喷药后第1天时,上表皮细胞的气孔,有部分气孔变形(图1-6),到喷药后第4天时气孔器的内壁明显出现皱缩的迹象(图1-18),这种皱缩随喷药天数的增加,其变形程度加大(图1-22,26,30).

图1 喷施草甘膦后上表皮细胞的扫描电镜观察图1-1 未喷施草甘膦的东农42的叶片的上表皮,图1-2 未喷施草甘膦的东农42的叶片的上表皮的气孔,图1-3 未喷施草甘膦的抗草甘膦大豆的叶片的上表皮,图1-4 未喷施草甘膦的抗草甘膦大豆的叶片的上表皮的气孔图1-5,9,13,17,21,25,29 喷施草甘膦1~7 d后东农42的叶片的上表皮的变化,图1-6,10,14,18,22,26,30 喷施草甘膦1~7 d后东农42的叶片的上表皮气孔的变化.图1-7,11,15,19,23,27,31 喷施草甘膦1~7 d后抗草甘膦大豆的叶片的上表皮的变化,图1-8,12,16,20,24,28,32 喷施草甘膦1~7 d后抗草甘膦大豆的叶片的上表皮气孔的变化.Fig.1 Epidermal cell change after spraying glyphosate under scanning electron microscopyFig.1-1 Dongnong 42 leaves upper epidermis with no spraying,Fig.1-2 Dongnong 42 leaves stomata with no spraying,Fig.1-3 Glyphosate resistant soybean upper epidermis with no spraying,Fig.1-4 Glyphosate resistant soybean leaves stomata with no spraying,Fig. 1-5,9,13,17,21,25,29 Dongnong 42 leaves upper epidermis change at 1~7 days after spraying, Fig. 1-6,10,14,18,22,26,30 Dongnong 42 leaves stomata change at 1~7 days after spraying,Fig. 1-7,11,15,19,23,27,31 Glyphosate resistant soybean leaves upper epidermis change at 1~7 days after spraying,Fig. 1-8,12,16,20,24,28,32 Glyphosate resistant soybean leaves stomata change at 1~7 days after spraying.
2.2 喷施草甘膦后的抗草甘膦大豆叶片的扫描电镜观察
图1、图2显示了抗草甘膦大豆叶片的上表皮在喷施草甘膦后的变化.
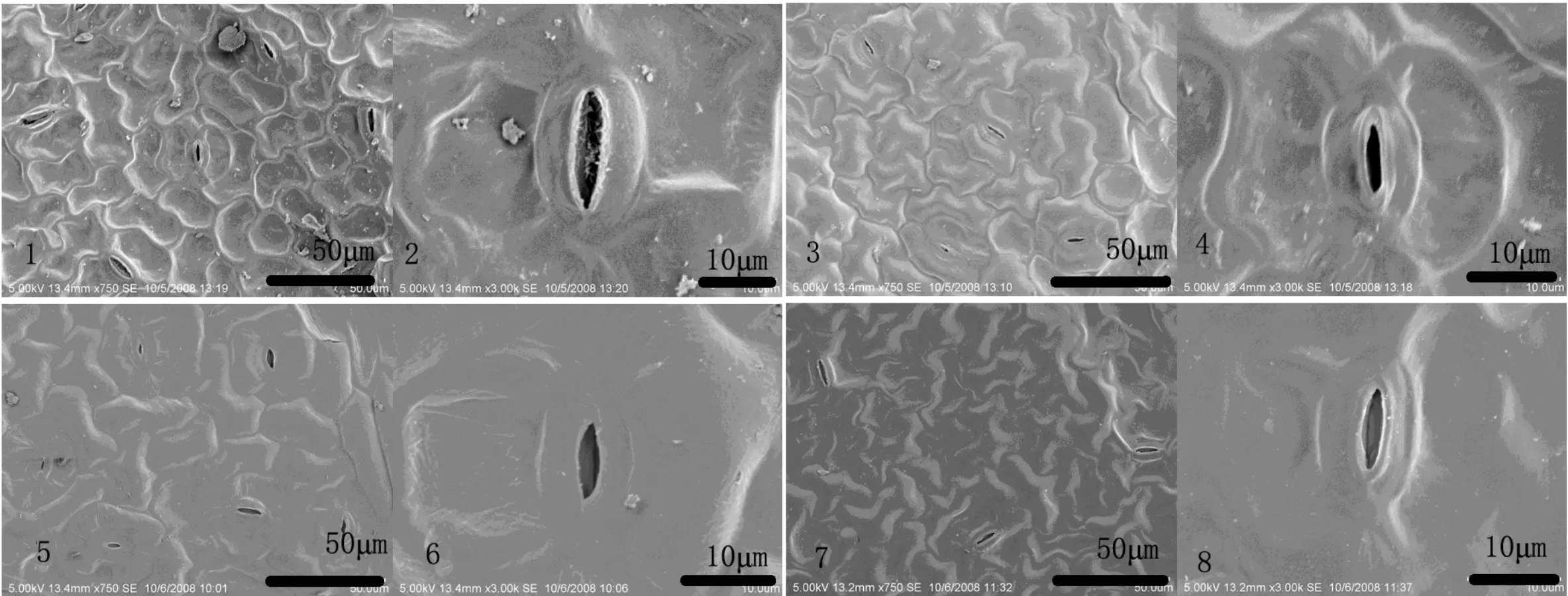
图2 喷施草甘膦后14,21,28,42 d抗草甘膦大豆叶片的上表皮的扫描电镜观察图2-1,3,5,7 喷施草甘膦14,21,28,42 d后抗草甘膦大豆的叶片的上表皮的变化,图2-2,4,6,8 喷施草甘膦14,21,28,42 d后抗草甘膦大豆的叶片的上表皮的气孔的变化.Fig.2 Glyphosate resistant soybean leaves epidermal change after spraying 14,21,28,42 days under scanning electron microscopy Fig.2-1,3,5,7 Glyphosate resistant soybean upper epidermis change at 14,21,28,42 days after spraying,Fig.2-2,4,6,8 Glyphosate resistant soybean leaves stomata change at 14,21,28,42 days after spraying.
在喷药后的42 d内,抗草甘膦大豆叶片的上表皮细胞变化不明显(图1,图2).
抗草甘膦大豆的上表皮的气孔则有一定程度变化,在喷药后的第1天到第4天出现了气孔器内壁的明显变形(图1-8,12,16,20),但到第5天及以后(图1-24)就未发现如此明显的变形(图1,图2).
2.3 扫描电镜下开口气孔个数的变化
从图1可以看出,东农42叶片在喷药后1 d急剧下降,到第2天有所恢复,但此后又进一步减少.抗草甘膦大豆的上表皮的气孔开口数在喷药后第1、2天有所下降,但到第3天有所恢复,到第4、5天又减少,到第6天后逐渐恢复,接近对照.

图3 喷药后上表皮气孔开口数的变化Fig.3 Change of the number of epicuticle opening stomata after spraying
3 讨论
内吸性是草甘膦的特点之一,在喷施后,草甘膦将经植物表皮和气孔进入植物体内[13],进而影响植物的代谢.而表皮细胞作为草甘膦进入植物体的必经途径,非常容易受到草甘膦的作用,同时植物的表皮细胞还与植物代谢息息相关.因此,研究草甘膦对大豆叶片表皮细胞的变化的研究是非常必要的.
在扫描电子显微镜下,可以观察到大豆叶片的表皮细胞、气孔的变化.草甘膦对东农42的表皮细胞及气孔的作用是毁灭性的,但对GTS 40-3-2的表皮细胞及气孔作用中表现出的变化,是一个先发生变化而后逐渐恢复的过程.这与草甘膦对大豆叶肉细胞的超微结构及生化指标的影响相一致[14].东农42的表皮细胞及气孔在施草甘膦后的前期的变化,非常可能是草甘膦及其辅剂的物理作用所致,而后来的变化,则是由于草甘膦抑制莽草酸途径,影响芳香族氨基酸的合成所致.而抗草甘膦大豆GTS 40-3-2的表皮细胞及气孔的变化,其原因则比较复杂,包括:草甘膦作为一种物理过程对细胞的损害,例如对气孔导度,叶面温度,渗透压等的影响;对本身敏感EPSPS的短时间抑制;草甘膦对叶绿素合成的抑制等.大豆表皮细胞及气孔,随着草甘膦被吸收以及叶片的自身发育等因素的变化,其影响就逐渐消失.
虽然抗草甘膦大豆的叶片表皮细胞经过一定时间会恢复,但最终结果表现为大豆成熟期的短暂延迟,如果大豆经历了这个时期仍可成熟,就像Nelson K A等[11]的研究,不会影响生长和产量,否则,在引入或培育抗草甘膦大豆时,就必须考虑到原始大豆品种的成熟期,而且还必须考虑到喷施草甘膦对它的影响.
[1] 钟金传,吴文良,夏友富.全球转基因大豆发展概况[J].生态经济,2005(10):203-206.
[2] 苏少泉.抗除草剂作物的过去、现在与未来[J].世界农药,2006,28(2):1-4.
[3] 韩天富.转基因大豆及其安全管理办法[J].粮食与油脂,2001(2):10-12.
[4] 杨家银.转基因大豆生产的现状与趋势[J].世界农业,2002(6):40-42.
[5] Duke S O.Taking stock of herbicide resistant crops ten years after introduction[J].PestManag Sci,2005,61: 211-218.
[6] Gianessi L P. Economic and herbicide use impacts of glyphosate-resistant crop[J].PestManag Sci,2005,61:241-245.
[7] 苏少泉.世界抗草甘膦大豆的新进展[J].农药,2007,46(2):73-76.
[8] Clive J. Preview:global status of commercialized transgenic crops[M].New York:ISAAA,2008.
[9] Delannay X,Bauman T T,Beighley D H,et al.Yield evaluation of a glyphosate tolerant soybean Line after treatment with glyphosate[J].Crop Science,1995,35:1 461-1 467.
[10] Elmore R W,Roeth F W,Nelson L A,et al.Glyphosate resistant soybean cultivar yields compared with sisterl ines[J].Agron J,2001,93:408-412.
[11] Nelson K A and Renner K A.Weed management in wide- and narrow-row glyphosate-resistant soybean[J].Journal of Production Agriculture,1999,12:460-465.
[12] Kelly A N,Karen A R.Soybean growth and development as affected by glyphosate and postemergence herbicide tank mixtures[J].Agronomy journal,2001,93:428-443.
[13] 刘支前.除草剂在植物体内的传导机理[J].植物生理学通讯,1992,28(3):226 -229.
[14] 卜贵军,郑小江,王学东,等.草甘膦对大豆叶片超微结构及生化指标的影响[J].中国油料作物学报,2010, 32(2):285-289.

