pH值、NaCl浓度和加热温度对猪肉匀浆物凝胶质构特性的影响*
王祎娟,余小领,李学斌,马汉军,段虎,潘润淑,马精艳
1(河南科技学院食品学院,河南 新乡,453003) 2(河南科技学院动物科学学院,河南新乡,453003)
肌肉中的蛋白质根据理化和功能特性,通常分为肌原纤维蛋白、肌浆蛋白、基质蛋白。其中肌原纤维蛋白又称为盐溶蛋白,是肌肉中最重要的蛋白质,约占总蛋白含量的50% ~55%,它是由肌球蛋白、肌动蛋白、肌动球蛋白和调节蛋白等形成的复合体[1]。这些蛋白质形成热诱导凝胶的能力是肉制品加工中重要的功能特性之一,对肉制品的工艺特性和感官品质具有极其重要的影响,在肉制品加工中起到极为重要的作用[2]。
国内外许多学者对不同蛋白质的提取条件、形成凝胶的机理及影响凝胶特性的因素进行了广泛研究[3-15],发现只有肌原纤维蛋白有很好的凝胶能力,而肌原纤维蛋白中只有肌球蛋白可单独形成良好的凝胶,肌动蛋白和肌动球蛋白对肌球蛋白凝胶有协同或拮抗效应,肌浆蛋白和可溶性胶原蛋白可能对凝胶的形成产生影响。然而,不同条件下匀浆物形成凝胶及其质构特性的研究鲜有报道,因此本试验主要通过三元二次通用旋转组合设计试验,研究pH值、NaCl浓度及加热温度对猪后腿肉匀浆物热诱导凝胶质构参数的影响,从而为猪肉凝胶类制品加工工艺的改进提供理论依据。
1 材料与方法
1.1 试验材料
选择品种和饲养管理相同、活重(97±5)kg的杂交猪(淮南猪×长白猪×约克夏)6头,按照常规屠宰工艺屠宰,宰后45 min内从胴体上分割2条猪后腿,剔除其可见脂肪和结缔组织,每份分装100 g,分别放入塑料包装袋中并密封,在-40℃保存备用。
氯化钠、磷酸氢二钠、磷酸二氢钠、碘化钾、无水硫酸铜、四水合酒石酸钾钠、氢氧化钠、盐酸(所有试剂均属分析纯,均购于天津市科密欧化学试剂有限公司)。
1.2 仪器与设备
TA XT-PLUS型质构分析仪,英国 Stable Micro System公司;3-18K型冷冻离心机,德国SIGMA公司;T25数显型高速分散机,美国IKA公司;IF300-15型雪花型制冰机,德国SIM有限公司;WFJ 7200型分光光度计,尤尼科上海仪器有限公司;DELTA320型pH计,梅特勒-托利多仪器(上海)有限公司;BS223S型电子天平,上海天平仪器厂;79-1型磁力加热搅拌器,常州国华仪器有限公司;HH-4型数显恒温水浴锅,国华电器有限公司。
1.3 试验设计
采用三因素二次通用旋转设计进行试验设计,其因素水平编码表如表1所示,试验设计表如表2所示。
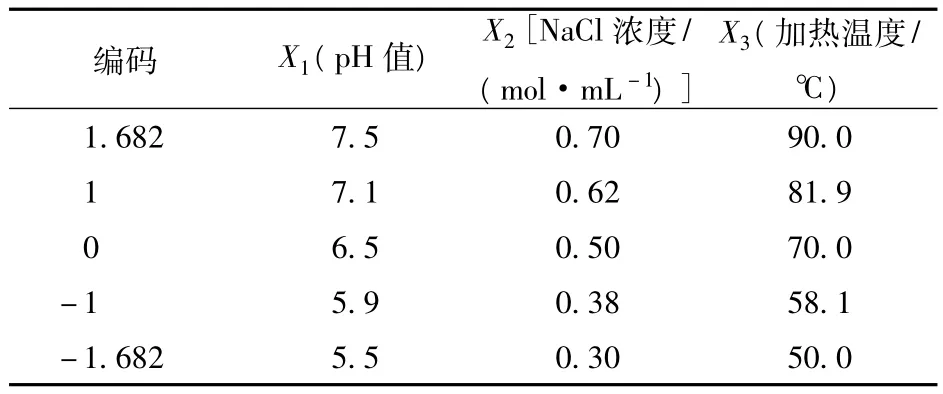
表1 三元二次通用旋转组合设计因素水平编码表

表2 三元二次通用旋转组合设计
1.4 试验方法
1.4.1 肌肉匀浆物的制备
参照 Tomasz Lesiów 的方法[17]并稍加修改。首先取分装好的肉样在0~4℃冰箱中解冻20 h,然后将肉切成0.5 cm3的小块,准确称量并放入烧杯中,加入4倍体积的NaCl溶液,进行匀浆处理(8 000 r/min,每次20 s,3 次),用0.1 mol/L NaOH 和0.1 mol/L HCl调节匀浆液的pH值,然后将匀浆液分装到50 mL离心管,最后将离心管置于0~4℃冰箱中静置24 h。
1.4.2 凝胶的制备
取出离心管并置于水浴锅中,从30℃缓慢升温至试验设计的温度,并在此温度保温30 min,然后置于冰浴中迅速降温30 min,将制备好的凝胶置于4℃冰箱中24 h然后保存备用。测定时取出凝胶在室温下放置30 min后再测定。
1.4.3 凝胶质构特性的测定
使用质构仪的TPA模式测定凝胶质构特性[18],单位为g。质构分析参数设定:探头为P0.5,测试前探头下降速度2.0 mm/s,测试速度1.0 mm/s,测试后探头上升速度2.0 mm/s,穿刺测试距离60%,感应力5 g。
1.5 数据处理
运用SPSS 13.0统计分析软件的广义线性模型模块对所测定的数据进行相关及回归分析,用MATLAB 7.0软件的绘图功能对实验分析结果进行反应曲面的绘制。
2 结果与分析
2.1 pH值、NaCl浓度和加热温度对匀浆物凝胶硬度的影响
以pH值(x1)、NaCl浓度(x2)和加热温度(x3)为自变量,匀浆物凝胶硬度为依变量,进行多元回归分析后得到二次回归方程(1)。

用Matlab 7.0软件绘制方程(1)在不同加热温度条件下的响应曲面直观图,如图1所示。
由图1可知,在所考察的加热条件下,pH和NaCl浓度对凝胶硬度的影响趋势总体上一致,因素间的交互作用显著。这一结论与郭世良[19]的结论相似,即离子强度对凝胶硬度的影响受pH值的影响,且两者存在明显的交互作用。在pH较低时,随着NaCl浓度的增加,凝胶的硬度增大;pH较高时,NaCl浓度对凝胶硬度的影响较小。NaCl浓度较低时,凝胶硬度随pH的增加比较平缓;NaCl浓度较高时,凝胶硬度随pH的增加而降低。加热温度为50℃形成的凝胶硬度比加热温度为58.1℃时的低,加热温度大于70℃时形成的凝胶硬度趋于稳定。出现这种情况,可能是由于凝胶硬度主要取决于肌原纤维蛋白在加热条件下相互交联的种类和数量,形成凝胶时环境的pH值影响蛋白质交联的类别,而离子强度影响交联的数量[20]。pH较低时,蛋白质交联的类别起主导作用,pH较高时,蛋白质的溶解情况占主要地位。
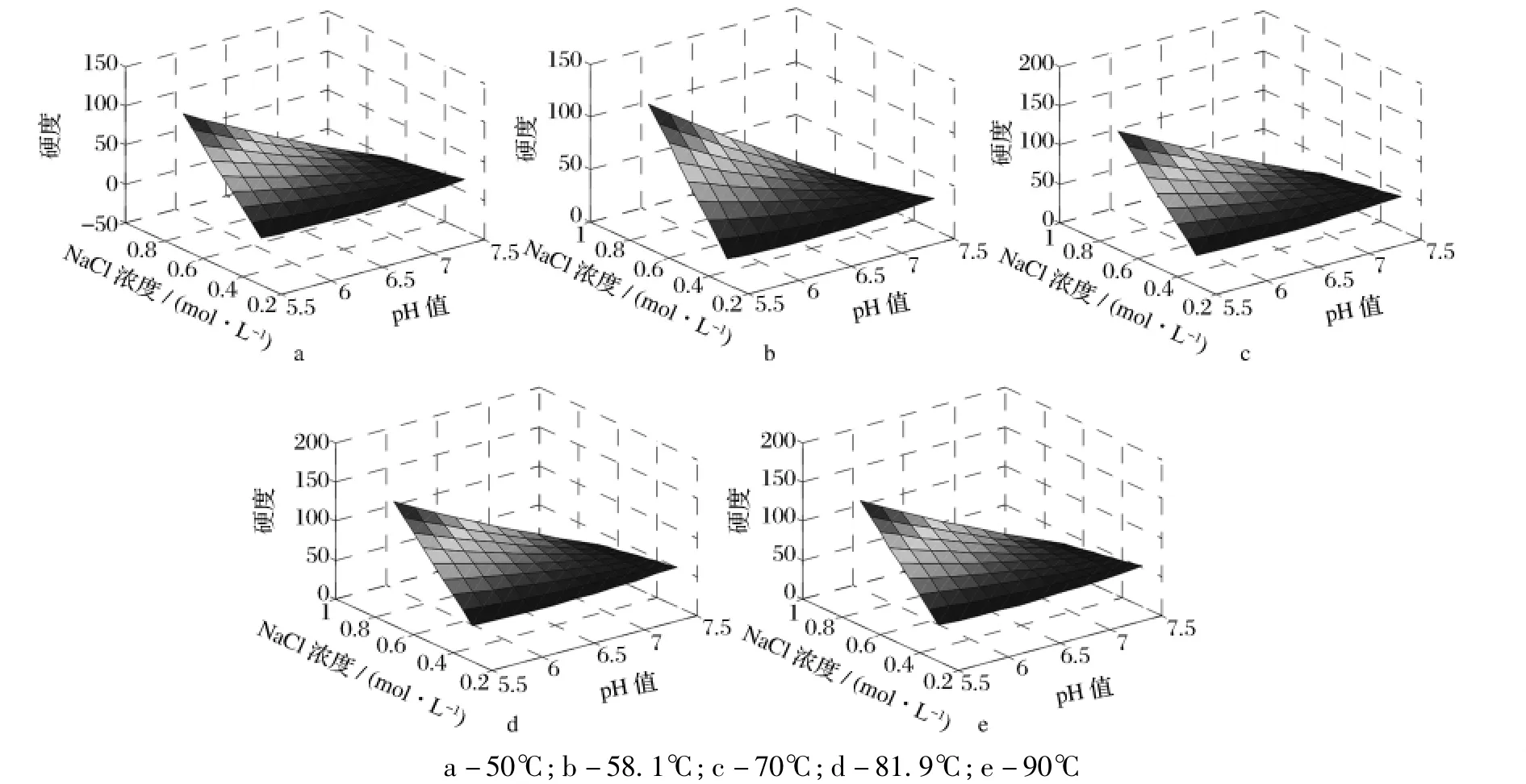
图1 不同加热温度下pH值和NaCl浓度对凝胶硬度的影响
2.2 pH值、NaCl浓度和加热温度对匀浆物凝胶弹性的影响
以pH值(x1)、NaCl浓度(x2)和加热温度(x3)为自变量,匀浆物凝胶弹性为依变量,进行多元回归分析后得到二次回归方程(2)。
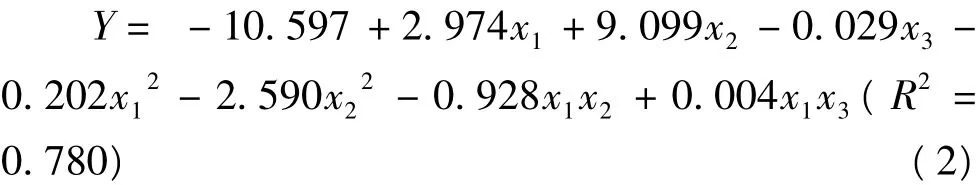
用Matlab 7.0软件绘制方程(2)在不同加热温度条件下的响应曲面直观图,如图2所示。由图2可知,在不同加热条件下,pH值和 NaCl浓度对凝胶弹性的影响趋势总体上一致,pH值和NaCl浓度对凝胶弹性的影响存在显著的交互作用。pH值较低时,凝胶弹性随着NaCl浓度的增加而增大,NaCl浓度较低时,凝胶弹性随着 pH值的升高呈上升趋势,而在较高的pH值和NaCl浓度下凝胶弹性变化较小。同时,温度对凝胶弹性的影响也较小。可能的原因是当肌原纤维蛋白的溶解度达到一定值时,凝胶弹性不再随蛋白质溶解度的增大而增大。
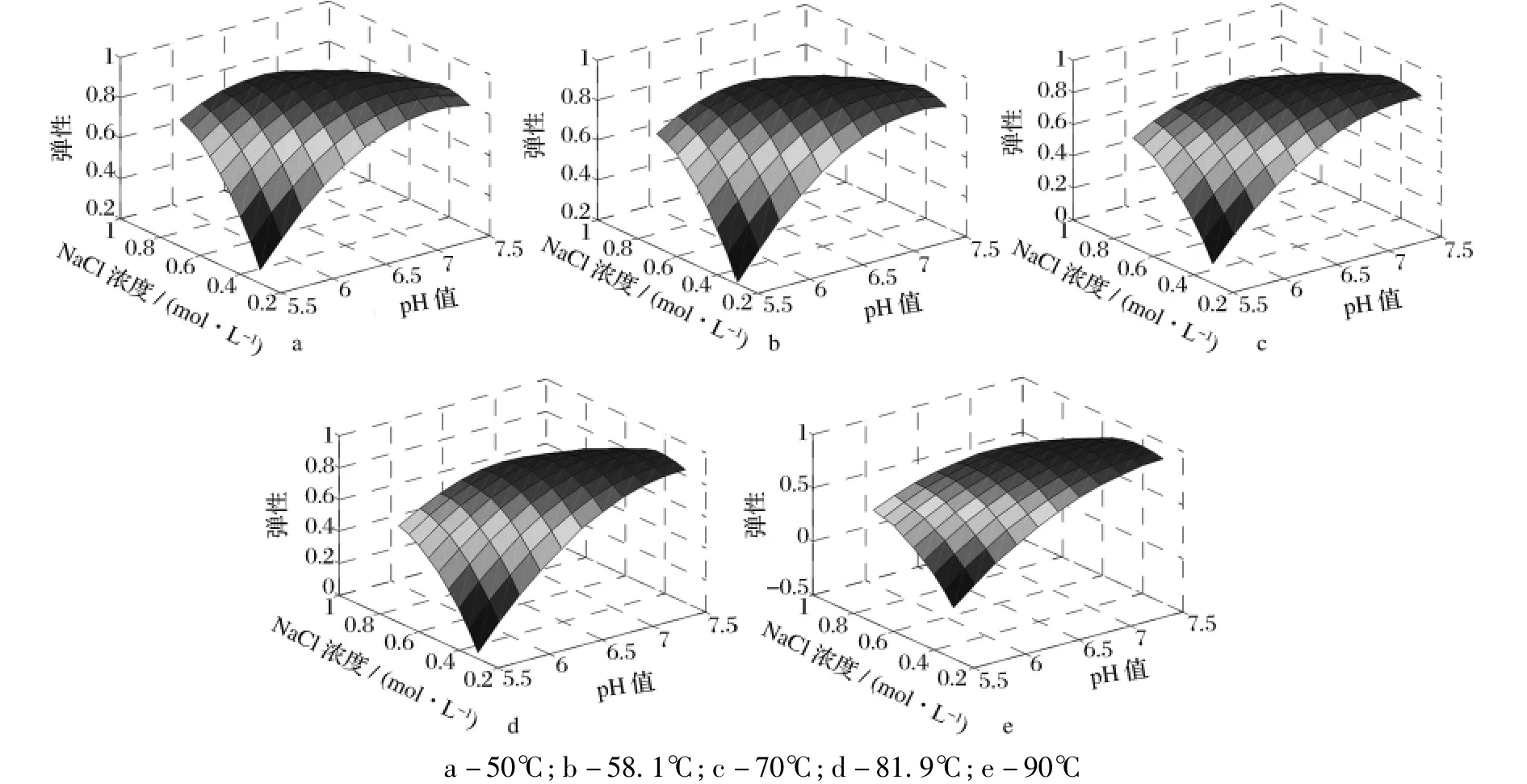
图2 不同加热温度下pH和NaCl浓度对凝胶弹性的影响
2.3 pH值、NaCl浓度和加热温度对匀浆物凝胶内聚性的影响
以pH值(x1)、NaCl浓度(x2)和加热温度(x3)为自变量,匀浆物凝胶内聚性为依变量,进行多元回归分析后得到二次回归方程(3)。
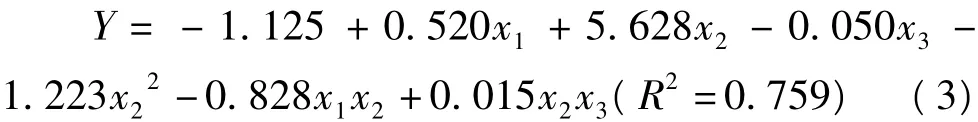
用Matlab 7.0软件绘制方程(3)在不同加热温度条件下的响应曲面直观图,如图3所示。由图3可知,加热温度分别为50、58.1和70℃时,pH值和NaCl浓度对凝胶内聚性的影响趋于总体上一致,而加热温度分别为81.9℃和90℃时,pH值和NaCl浓度对凝胶内聚性的影响也基本一致。NaCl浓度较低时,随着pH值的升高内聚性增加;NaCl浓度较高时,凝胶的内聚性变化较小。pH值较低时,随着NaCl浓度增加内聚性增加,较高pH值下则呈相反的趋势。凝胶的内聚性随着加热温度的升高而呈下降趋势。凝胶的内聚性主要受pH值和离子强度交互作用的影响。二者都影响肌原纤维的溶解度、存在状态和凝胶的形成。
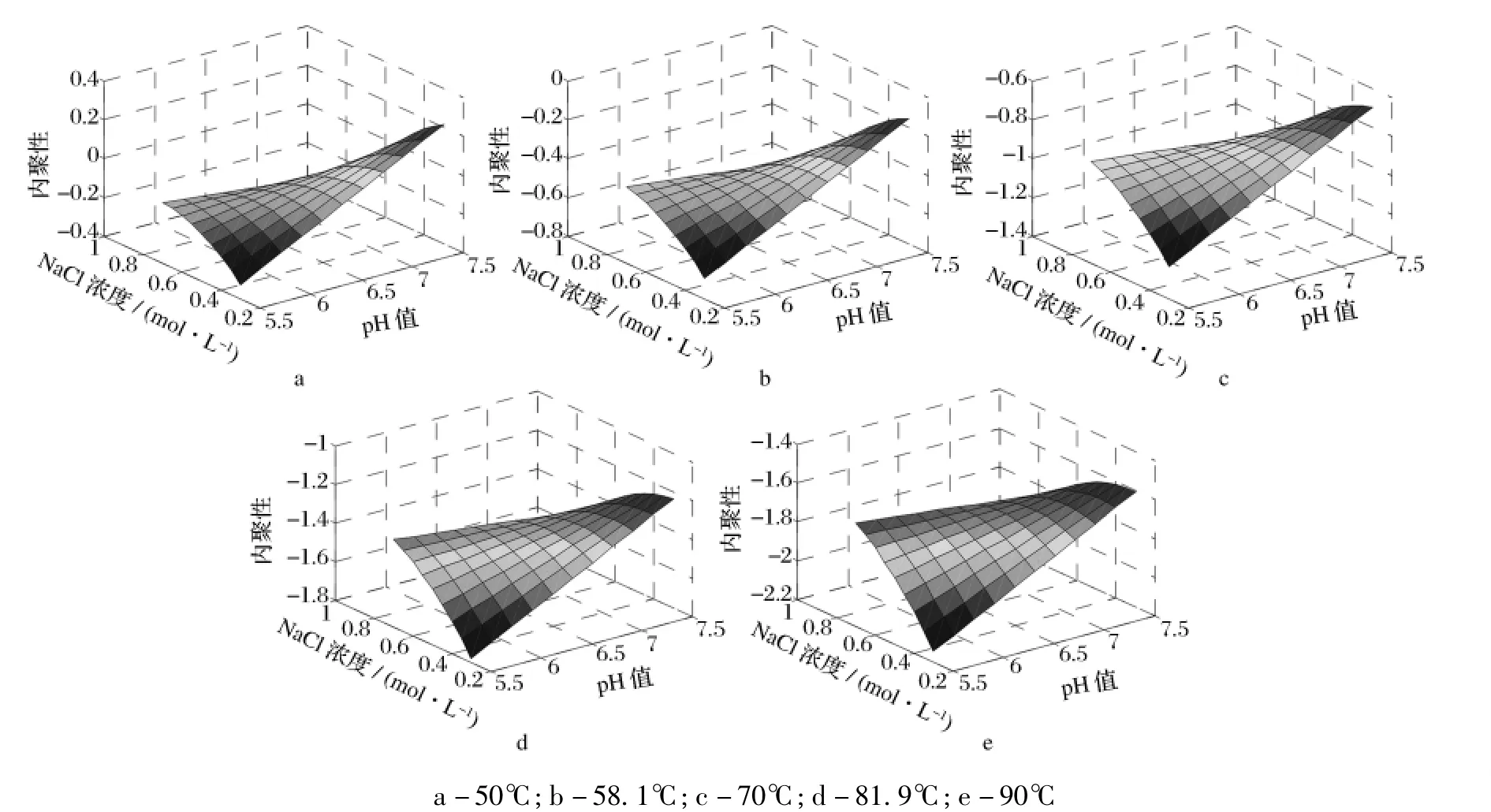
图3 不同加热温度下pH和NaCl浓度对凝胶内聚性的影响
2.4 pH值、NaCl浓度和加热温度对匀浆物凝胶胶粘性的影响
以pH值(x1)、NaCl浓度(x2)和加热温度(x3)为自变量,匀浆物凝胶胶粘性为依变量,进行多元回归分析后得到二次回归方程(4)。
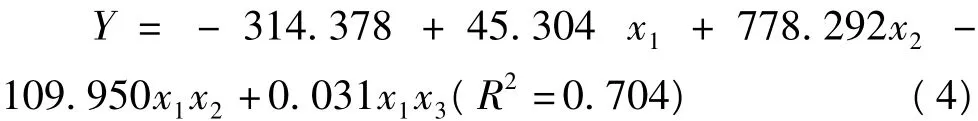
用Matlab 7.0软件绘制方程(4)在不同加热温度条件下的响应曲面直观图,如图4所示。由图4可知,在所考察的加热条件下,pH值和NaCl浓度对凝胶胶粘性的影响趋势总体上一致,两者间存在明显的交互效应。在低pH值下,随着NaCl浓度的增加,凝胶的胶粘性显著增加,当pH值为6.5左右时缓慢增加,而当pH值大于7时,胶粘性随NaCl浓度的增加而减小。NaCl浓度较低时,胶粘性随着pH值的升高而增加但高NaCl浓度下,胶粘性随着pH值的升高而降低。温度大于70℃时凝胶的胶粘性高于温度小于70℃时的胶粘性。
2.5 pH值、NaCl浓度和加热温度对匀浆物凝胶咀嚼性的影响
以pH值(x1)、NaCl浓度(x2)和加热温度(x3)为自变量,匀浆物凝胶咀嚼性为依变量,进行多元回归分析后得到二次回归方程(5)。
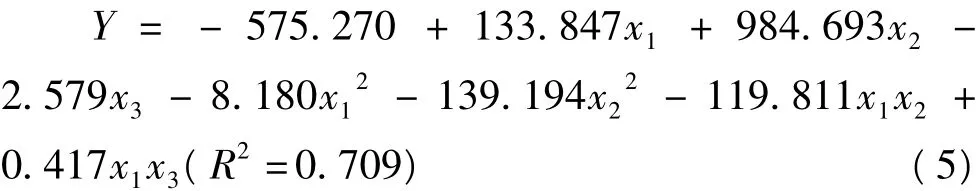
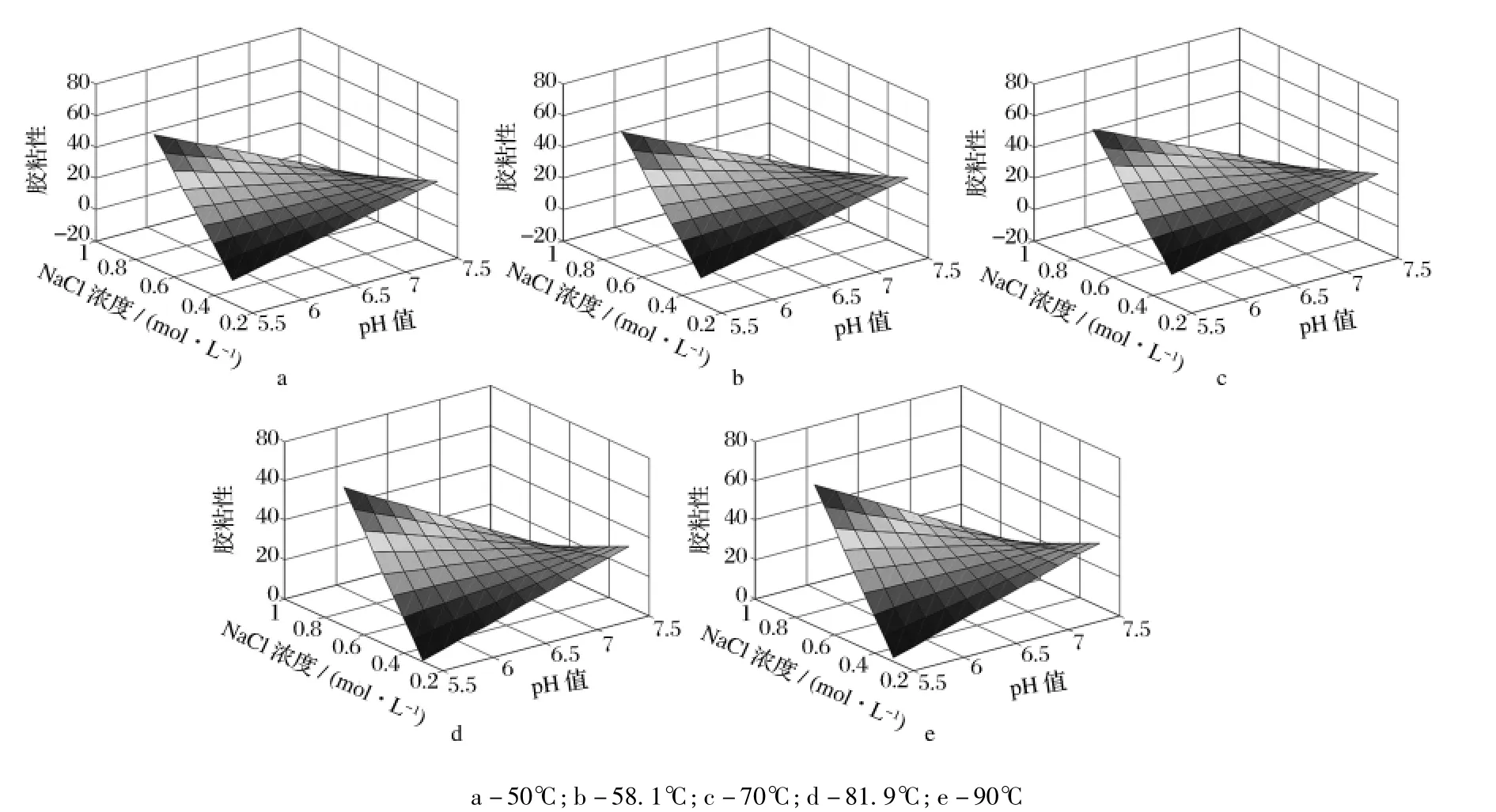
图4 不同加热温度下,pH值和NaCl浓度对凝胶胶粘性的影响
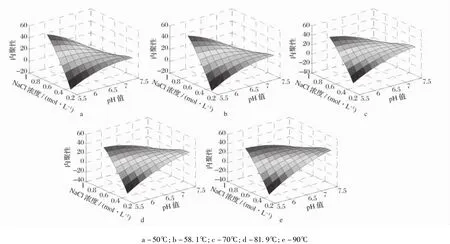
图5 不同加热温度下,pH值和NaCl浓度对凝胶内聚性的影响
用Matlab 7.0软件绘制方程(5)在不同加热温度条件下的响应曲面直观图,如图5所示。由图5可知,在不同加热条件下,pH值和NaCl浓度对凝胶咀嚼性的影响趋势总体上一致,且两者间存在明显的交互作用。pH值较低时,随着NaCl浓度增加凝胶咀嚼性增大;pH值较高时,随着NaCl浓度增加凝胶咀嚼性减小。NaCl浓度较低时,凝胶咀嚼性随pH值的增加而增加;NaCl浓度较高时,凝胶咀嚼性随pH值的增加而降低。加热温度小于70℃时凝胶的咀嚼性显著高于加热温度大于70℃时凝胶的咀嚼性。
3 结论
不同处理条件对猪后腿肉匀浆物凝胶质构参数的影响存在差异。不同加热温度下,pH值和NaCl浓度对凝胶硬度、弹性、内聚性、胶粘性和咀嚼性影响的总体趋势一致且两者存在明显的交互作用。pH值较低时,随着NaCl浓度的增加,凝胶的硬度、弹性、内聚性、胶粘性和咀嚼性均增大而回复性减小;pH值较高时,NaCl浓度对凝胶硬度、弹性和胶粘性影响较小,内聚性和胶粘性随着NaCl浓度增加而降低。NaCl浓度较低时,pH值对凝胶硬度影响较小,凝胶的弹性、内聚性、胶粘性和咀嚼性随着pH值的升高而增大;NaCl浓度较高时,凝胶的硬度、胶粘性和咀嚼性随pH值的增加而降低,而pH值对凝胶的弹性和内聚性影响较小。同时,随着加热温度的升高,凝胶的硬度和胶粘性增大,内聚性和咀嚼性减小,而凝胶弹性变化较小。
[1] 葛长荣,马美湖主编.肉与肉制品工艺学[M].北京:中国轻工业出版社,2005.
[2] 彭增起,周光宏.肌肉盐溶蛋白质溶解性和凝胶特性研究[D].南京:南京农业大学,2005.
[3] 杨龙江,南庆贤.肌肉蛋白质的热诱导凝胶特性及影响因素[J].肉类工业,2001(10):39-42.
[4] 徐幸莲,周光宏.兔骨骼肌肌球蛋白热诱导凝胶特性及成胶机制[D].南京:南京农业大学,2003.
[5] 李继红,彭增起.不同种类肉盐溶蛋白凝胶特性的研究[D].保定:河北农业大学,2004:6.
[6] 郭世良,王玉芬.肌原纤维蛋白和猪肉的热诱导凝胶影响因素及特性研究[D].郑州:河南农业大学,2008,6.
[7] Sharp A,Offer G.The Mechanism of Formation of Gels from Myosin Molecules[J].Sci Food Agric,1992,58:63-73.
[8] Samejima K,Hashimoto Y.Heat gelling properties of myosin,actin,actomyosin and myosin-subunits in a saline model system[J].J Food Sci,1969,34:242 -250.
[9] Lavelle C L,E A Foegeding.Gelation of turkey breast and thigh myofibrils:effects of pH,salt and temperature[J].J Food Sci,1993,58(4):727-730.
[10] Boyer C,Joandel V,Roussilhes V,et al.Heat-induced gelation of myofibrillar proteins and myosin from fastand slow - twitch rabbit muscles[J].J Food Sci,1996,61(6):1 138-1 142.
[11] Kristisson H G,Hultin H O.Role of pH and ionic strength on water relationships in washed minced chicken– breast muscle gels[J].J Food Sci,2003,68(3):917-921.
[12] Westphalen A D,Briggs J L,Lonergan S M.Influence of pH on rheological properties of porcine myofibrillar protein during heat induced gelation [J].Meat Science,2005,70(2):293-299.
[13] Sarah Comfort,Nazlin K Howell.Gelation properties of salt soluble meat protein and soluble wheat protein mixtures[J].Food Hydrocolloids,2003,70(2):149 -159.
[14] Ru Liu,Siming Zhao,Shanbai Xiong,et al.Role of secondary structures in the gelation of porcine myosin at different pH values[J].Meat Science,2008,80(3):632-639.
[15] Camou J P,Sebranek J W,Olson D G.Effects of heating rate and protein concentration on gel strength and water loss of muscle protein gels[J].J Food Sci,1989,54:850-854
[16] 王钦德,杨坚主编.食品试验设计与统计分析[M].北京:中国农业大学出版社,2003.
[17] Tomasz Lesiów,Youling L Xiong.Chicken muscle homogenate gelation properties:effect of pH and muscle fiber type[J].Meat Science,2003,64(4):399-403.
[18] 林丽军,徐幸莲.肌球蛋白的ATPase活性及热诱导凝胶特性研究[D].南京:南京农业大学,2004.
[19] 郭世良,赵改名,王玉芬,等.离子强度和pH值对肌原纤维蛋白热诱导凝胶特性的影响[J].食品科技,2008,33(1):84-87.
[20] Xiong Y L,Brekke C J.Changes in protein solubility and gelation of chicken myofibrils during storage[J].J Food Sci,1989,54(5):1141- 1146.

