腐乳前酵过程中生物胺含量变化*
王颖,邱璠,邢茜,殷丽君
(中国农业大学食品科学与营养工程学院,北京,100083)
生物胺是一类碱性含氮化合物,作为人体内正常的生理活性物质在细胞中具有重要的生理功能。当人体内生物胺含量过多时,会刺激体内释放肾上腺素和去甲肾上腺素,增加胃酸分泌,引起心跳过速、偏头痛、血糖升高和血压升高[1-3]。生物胺的形成主要有2种形式:一种是通过氨基酸的脱羧作用,另一种是通过醛酮类化合物的氨基化或转氨作用形成[4]。生物胺产生的条件有3个:①有可形成生物胺的游离氨基酸,②存在可代谢产生氨基酸脱羧酶的微生物,③适合该微生物生长的环境[5]。
食品中主要存在的生物胺包括组胺、腐胺、尸胺、酪胺、色胺、β-苯乙胺、精胺和亚精胺[5]。目前关于食品中生物胺的研究主要是针对鱼及鱼制品、肉及肉制品、香肠、奶酪、啤酒、红酒、发酵蔬菜等食品[4-8],在未发酵的食品中,如鱼、肉等,生物胺的产生多是由微生物污染引起的,因此把生物胺作为食品腐败变质的指标之一;而在发酵食品,尤其是蛋白质和氨基酸含量高的食品中,由于微生物的作用,生物胺含量相对较高。Mohamed等[9]研究发现,发酵鱼制品 Feseekh在成熟过程中,生物胺总量从83.63 mg/kg干基增长到608.72 mg/kg干基,经过60天储藏后达到1633.02 mg/kg干基。Favaro等[10]检测到鲜肉中只含有少量的酪胺、亚精胺和精胺,其他种类生物胺未检出;而在发酵香肠和干腌制品中,主要含有酪胺(104~295 mg/kg)、腐胺(97~331 mg/kg)和尸胺(6~81 mg/kg)。
腐乳是我国传统大豆发酵食品之一,是以大豆为主要原料,经过磨浆、成坯、前酵、腌制、后酵等过程制作而成的富含大豆蛋白的发酵制品。腐乳口感细腻,营养丰富,有“东方奶酪”之称,深受消费者的喜爱。随着对食品安全重视程度的增加,腐乳作为蛋白质和氨基酸含量较高的发酵食品,存在生成生物胺的可能性,而目前关于传统大豆发酵食品中生物胺的研究还很少,因此有必要对腐乳发酵过程中生物胺的产生情况进行分析。本课题主要研究了腐乳前酵过程中生物胺含量的变化。
1 材料与方法
1.1 原料
大豆,中黄13号,由北京中农作科技发展有限公司提供。
1.2 菌种
雅致放射毛霉Actinomucor elegans(王致和腐乳厂),少孢根霉Rhizopus oligosporus(中科院微生物研究所)。
1.3 主要试剂
HCl,氨水,丙酮,NaOH,NaHCO3,MgCl2,均为分析纯。
1.4 标准品
色 胺 (98%)Sigma-Alorich INC,β-苯 乙 胺(97.5%)Dr Ehrenstorfer GmbH,腐胺(99%)Dr Ehrenstorfer GmbH,尸胺(99%)Dr Ehrenstorfer GmbH,盐酸组胺(99%)TCI东京化成工业株式会社,酪胺(>98%)(TCI(上海)化成工业发展有限公司,>98%),亚精胺 (99%)、精 胺 (97%),丹磺酰氯(97%)Alfa Aesar。
1.5 仪器设备
高效液相色谱仪(SHIMADZU,10A),真空冷冻干燥机(北京四环科学仪器厂,LCJ-10),冷冻离心机(上海安亭科学仪器厂,GL-20G-II),均质机(IKA LABORTECHNIK,T25 basic),电泳仪(AZZO,AE-8450)
1.6 方法
1.6.1 菌种的活化
将菌种划线于PDA培养基斜面上,28℃活化72 h。
1.6.2 孢子悬浮液的制备
将麸皮与水按1∶1.4(g∶mL)混合,置于250 mL三角瓶中,于121℃灭菌20 min,冷却后分别接种雅致放射毛霉、少孢根霉,于恒温恒湿培养箱中28℃培养3d。加入适量生理盐水,充分摇动,分别得到雅致放射毛霉孢子悬浮液和少孢根霉孢子悬浮液。镜检计数,调整浓度为107个孢子/mL。孢子悬浮液随用随配,不做储藏。
1.6.3 腐乳白坯的制作
挑选颗粒饱满的大豆300 g,以1 200 mL去离子水室温浸泡12 h。待大豆泡好后,以1 800 mL水为溶剂,用磨浆机磨成豆浆。过100目筛,加热,95℃保温5 min,冷却至80℃,保温5 min,手动搅拌加入100 mL 1 mol/L MgCl2溶液点浆,80℃蹲脑40 min,压榨成型,最后将豆腐切成块。
1.6.4 腐乳前酵
将豆腐坯整齐的摆入蒸笼中,将制备好的孢子悬浮液均匀喷洒在腐乳白坯表面,平均每块豆腐坯喷洒1 mL孢子悬浮液。豆腐坯之间间隔为1cm。雅致放射毛霉在28℃,相对湿度88%的条件下进行发酵,少孢根霉在32℃,相对湿度88%的条件下进行发酵,并于24、36、48、60、72h 时取样。
1.6.5 腐乳样品稀释液的制备
取冻干的腐乳样品2.5g于离心管中,加15 mL 0.1 mol/L HCl,均质 2 min,4℃15 800 × g离心 20 min,取上清液,过滤,取1 mL滤液定容到5 mL,得到样品稀释液,取1 mL进行衍生,作2个平行。
1.6.6 样品衍生[11]
取1 mL上述腐乳样品稀释液,依次加入200 μL 2 mol/L NaOH、300 μL 饱和 NaHCO3、2 mL 丹磺酰氯(DCl)(10 mg/mL 丙酮),40℃ 暗处理 45 min,加入100 μL 25% 氨水,静置 30 min,乙腈定容到 5 mL,0.45μm有机系滤膜过滤,备用(4℃避光保存)。
1.6.7 HPLC分析
1.6.7.1 绘制标准曲线
分别称取50 mg(精确到0.0001 g)生物胺标准品,用0.1 mmol/L HCl定容到50 mL,制成标准品储备液,各取储备液10 mL混合后定容到100 mL,制成标准品混合液,再用0.1 mmol/L HCl将混合液分别稀释到 100、50、25、10、5 μg/mL。将不同浓度的标准品混合液进行衍生,方法同样品衍生1.6.6。
1.6.7.2 高效液相色谱检测条件
色谱柱:C18柱(4.6 mm ×250 mm,5μm),紫外检测器,检测波长254nm,进样量20 μL,柱温40℃,流动相A为水,流动相B为乙腈,流速为0.8 mL/min,梯度洗脱程序如下:

时间/min A浓度/% B浓度/%0.01 35 65 1 35 65 10 20 80 15 10 90 25 10 90 30 35 65
1.7 多肽测定[12]
参照Church F.C.的方法有所改动。OPA试剂的配制:取50 mL 0.1 mol/L四硼酸钠溶液,5 mL 0.2 g/mL SDS 溶液,0.5 mL β-巯基乙醇,2.5 mL OPA 溶液(50 mg/mL甲醇)混匀,用蒸馏水定容到100 mL。
取冻干的腐乳样品1.0g于离心管中,加10 mL蒸馏水,均质(19 000 r/min)2 min,沸水浴15 min,室温下150 r/min振荡1 h,15 800g离心20 min,取上清液,过0.45μm滤膜,得到样品水提物,4℃保存备用。取100 μL样品水提物加2 mLOPA试剂,混匀,静置10 min,340 nm测吸光度。以谷胱甘肽做标准曲线,谷胱甘肽浓度分别为 0,0.25,0.50,0.75,1.00,1.50,2.00 mg/mL。
1.8 氨基态氮含量测定
参见 SB/T 10170[13],稍有改动。取 3.000 g腐乳冻干样品于烧杯中,加入20 mL水,加热煮沸,冷却至室温后,移入100 mL容量瓶中,用水定容至刻度线,混匀,用干燥滤纸过滤,得到样品滤液。取10 mL滤液于150 mL烧杯中,加入50 mL水,开动磁力搅拌器,用0.1mol/L NaOH标准溶液滴定至pH 8.2,加入10 mL甲醛,继续滴定至pH 9.2,记下加入甲醛后氢氧化钠标准溶液消耗的体积。同时做空白试验。
2 结果分析与讨论
2.1 生物胺标准曲线
通过单个生物胺标准样品的HPLC检测,得到8种生物胺的保留时间,色胺为(10.219±0.031)min,β-苯乙胺为(12.133±0.030)min,腐胺为(12.800 ±0.030)min,尸胺为(13.760 ±0.038)min,组胺为(14.680±0.027)min,酪胺为(18.586±0.027)min,亚精胺为(19.411 ±0.026)min,精胺为(24.164±0.061)min。混合胺的HPLC检测结果可以得出该方法对8种生物胺的分离效果较好(见图1)。8种生物胺标准曲线的回归方程见表1,R2均大于0.998,说明峰面积与生物胺含量之间具有很强的线性相关性。
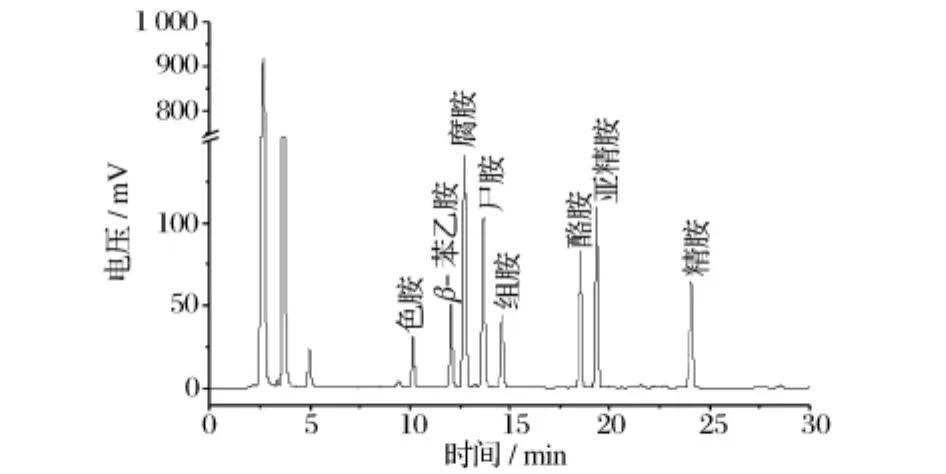
图1 标准生物胺HPLC检测图谱

表1 生物胺标准曲线的回归方程及R2
2.2 腐乳前酵过程中多肽含量的变化
谷胱甘肽标准曲线为y=0.413 2x-0.001 2,且R2=0.999 9,说明在0~2.00 mg/mL范围内,吸光度与浓度有良好的线性关系。在前酵过程中,多肽含量呈现上升趋势,在36h内,雅致放射毛霉发酵的豆腐多肽含量高于少孢根霉发酵的,48h后,少孢根霉发酵豆腐中多肽含量明显高于雅致放射毛霉发酵的(图2),发酵到72h,雅致放射毛霉和少孢根霉发酵的腐乳中多肽含量分别达到了4.2g/100g、7.2g/100g。

图2 雅致放射毛霉和少孢根霉发酵过程中多肽含量
2.3 腐乳前酵过程中氨基态氮含量及生物胺含量变化
豆腐坯中氨基态氮的含量很低,经过发酵,雅致放射毛霉和少孢根霉发酵的腐乳中氨基态氮的含量均有不同程度的增加,雅致放射毛霉发酵腐乳中氨基态氮含量一直高于少孢根霉发酵的腐乳,发酵到72h,氨基态氮含量分别达到0.50g/100g、0.40g/100g(见图3)。

图3 雅致放射毛霉和少孢根霉发酵过程中氨基态氮含量
在整个发酵过程中,总胺含量一直呈现上升趋势,且雅致放射毛霉发酵产生总胺含量一直高于少孢根霉发酵产生的总胺含量(见图4),发酵到72h时,总胺含量分别达到971.1 mg/kg和782.0 mg/kg。Nout[14]等研究了少孢根霉发酵的天培(tempe)中总胺含量的变化,少孢根霉发酵的天培中总胺含量大约为1800 mg/kg,主要含有腐胺和酪胺;添加肺炎克雷伯氏菌和白吉利丝孢酵母后,总胺含量略有增加,达到2 100 mg/kg,尸胺含量增加;添加植物乳杆菌后,酪胺含量降低,总胺含量为 1 000 mg/kg。Tao Tang[15]等对成品腐乳中总胺含量进行检测,微生物发酵腐乳中总胺含量为129.0 mg/kg,酶制腐乳中总胺含量为137.7 mg/kg。相比之下,前酵结束时,总胺含量相对较高。

图4 雅致放射毛霉和少孢根霉发酵过程中总胺含量变化
在雅致放射毛霉发酵过程中,色胺、腐胺、组胺、酪胺、亚精胺和精胺含量变化呈现较平缓的趋势,均在50 mg/kg以下;β-苯乙胺的含量在发酵36h内呈上升趋势,36h以后含量逐渐下降。而尸胺和酪胺含量较高,且在发酵36h之后含量迅速增加(见图5)。少孢根霉发酵36h后,酪胺含量迅速增加,占总胺含量的大部分,其余7种生物胺含量变化不大,且含量均在50 mg/kg以下(见图6)。
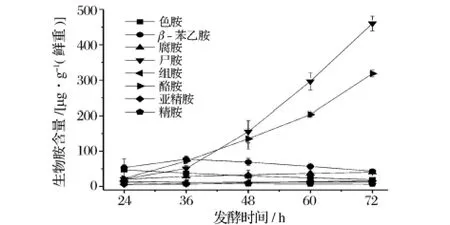
图5 雅致放射毛霉发酵过程中生物胺含量
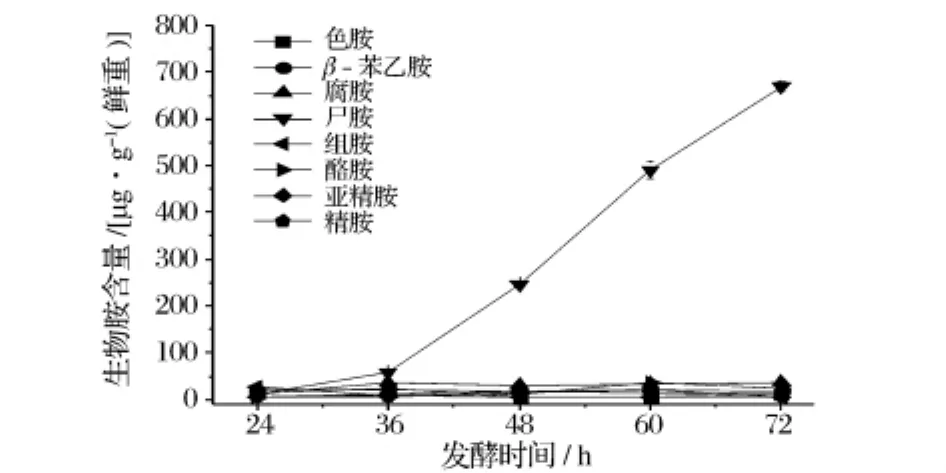
图6 少孢根霉发酵过程中生物胺含量
在腐乳的前酵过程中,主要是微生物在白坯上生长繁殖并分泌酶,使大分子降解成小分子。从以上数据可以看出,在前酵过程中,蛋白质经过不同程度的降解生成了相对较小的多肽和氨基酸,并且多肽和氨基酸的含量随发酵时间的延长不断增加。全明海[16]研究了雅致放射毛霉发酵腐乳中蛋白酶活力的变化,0~12h蛋白酶活力增长很慢,12~36h呈线性迅速增加,36~48 h增长速度有所下降,但仍呈上升趋势。这与雅致放射毛霉前酵过程中多肽含量的变化趋势相一致,但多肽含量的增加相对蛋白酶活有一定的滞后性,多肽含量在24~48 h增长较快,48 h后仍呈增长趋势,但增速较慢。多肽进一步分解为小分子的氨基酸,氨基态氮含量一直呈上升趋势,且雅致放射毛霉发酵产生的氨基态氮含量一直高于少孢根霉发酵的产物,并与生物胺总量的变化趋势一致,这与Lu Yongmei[17]等的研究结果一致。Lu Yongmei等针对40种不同发酵方式的酱油中生物胺含量进行了检测,氨基态氮含量高的样品中总胺含量也相应较高。Andic[18]等人对 Herby Cheese中的生物胺进行了检测,发现干酪中含氮物质的含量与生物胺的含量之间具有相关性,水溶性蛋白、三氯乙酸溶解性蛋白和磷钨酸溶解性蛋白含量高的样品中,生物胺含量高,水溶性蛋白与苯乙胺、腐胺、尸胺、组胺、酪胺的含量呈正相关。生物胺通常是游离氨基酸脱羧产生的,即氨基酸脱去α-羧基形成的,食品中主要的生物胺色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺分别由其相应的前体氨基酸色氨酸、苯丙氨酸、鸟氨酸、赖氨酸、组氨酸、酪氨酸脱羧形成[4]。在腐乳前酵过程中,通过微生物的作用,蛋白质不断降解,小分子含氮物质多肽和氨基酸含量增加,为生物胺的形成提供了前体物质,这从一定程度上解释了氨基态氮和生物胺变化趋势的一致性。
3 结论
雅致放射毛霉和少孢根霉在腐乳前酵过程中,多肽、氨基态氮及生物胺的含量均呈现上升趋势,生物胺总量的升高与含氮物质含量的升高有一定联系。代谢产生的生物胺种类有所差别,雅致放射毛霉发酵腐乳中主要以尸胺和酪胺为主,含量分别达到460.1、318.5 mg/kg,两者共占生物胺总量的80.2%,其余六种生物胺含量均低于100 mg/kg。而少孢根霉发酵腐乳中尸胺含量为668.0 mg/kg,远高于其他种类的生物胺,其余7种生物胺含量均低于50 mg/kg。这有可能与微生物自身所含有的脱羧酶种类不同有关,不同微生物对氨基酸的利用不同,产生的生物胺种类也会有区别。因此,腐乳发酵过程中生物胺的产生机理还需进一步研究。
[1] Lehane L,Olley J.Histamine fish poisoning revisited[J].International Journal of Food Microbiology,2000,58(1/2):1-37.
[2] Caston J C,Eaton C L,Gheorghui B P,et al.Tyramine induced hypertensive episodes,panic attacks in hereditary deficient monoamine oxidase patients:case reports[J].The Journal of the South Carolina Medical Association,2002,98:187-192.
[3] Ten Brink B,Damink C,Joosten H M L J,et al.Occurrence and formation of biologically amines in food[J].International Journal of Food Microbiology,1990,11(1):73-84.
[4] Santos M H S.Biogenic amines:their importance in foods[J].International Journal of Food Microbiology,1996,29(2-3):213-231.
[5] Shalaby A R.Significance of biogenic amines to food safety and human health[J].Food Research International,1996,29(7):675-690.
[6] Hernández-Jover T,Izquierdo-Pulido M,Veciana-Nogués M T,et al.Biogenic amine and polyamine contents in meat and meat products[J].Journal of Agriculture and Food Chemistry,1997,45(6):2 098-2 102.
[7] Suzzia G,Gardini F.Biogenic amines in dry fermented sausages:a review[J].International Journal of Food Microbiology,2003,88(1):41 -54.
[8] Beneduce L,Romano A,Capozzi V,et al.Biogenic amine in wines[J].Ann Microbiol,2010,60(4):573 -578.
[9] Mohamed R,Simon-Sarkadi L,Hassan S,et al.Changes in free amino acids and biogenic amines of Egyptian saltedfermented fish(Feseekh)during ripening and storage[J].Food Chemistry,2009,115(2):635-638.
[10] Favaro G,Pastore P,Saccani G,et al.Determination of biogenic amines in fresh and processed meat by ion chromatography and integrated pulsed amperometric detection on Au electrode[J].Food Chemistry,2007,105(4):1 652-1 658.
[11] 徐振,孟勇,朱志远,等.反相高效液相色谱法测定冷却猪肉中生物胺[J].江西农业学报,2008,20(8):82-84.
[12] Church F C,Swaisgood H E,Porter D H,et al.Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J].Journal of Dairy Science,1983,66(6):1 219-1 227.
[13] SB/T 10170-2007.腐乳[S].
[14] Nout'M J R,Ruikes M M W,Bouwmeester H M.Effect of processing conditions on the formation of biogenic amines and ethyl carbamate in soybean tempe[J].Journal of Food Safety,1993,13(4):293-303.
[15] Tao Tang,Kun Qian,Tianyu Shi,et al.Monitoring the contents of biogenic amines in sufu by HPLC with SPE and pre-column derivatization[J].Food Control,2011,22(8):1 203-1 208.
[16] 全明海.以雅致放射毛霉和少根根霉发酵腐乳的研究[D].北京:中国农业大学,2006.
[17] Lu Yongmei,Chen Xiaohong,Jiang Mei,et al.Biogenic amines in Chinese soy sauce[J].Food Control,2009,20:593–597.
[18] Andic S,Genccelep H,Kose S.Determination of biogenic amines in herby cheese[J].International Journal of Food Properties,2010,13(6):1 300-1 314.

