栗子壳色素的分级与稳定性研究*
戚建华,姚增玉,,王力华
1(西南林业大学西南山地森林资源保育与利用省部共建教育部重点实验室,云南昆明,650224)2(中国科学院沈阳应用生态研究所,辽宁 沈阳,110016)
颜色是食品感官质量最重要的属性[1]。近年来人们越来越关注合成色素的安全性问题,天然食品色素的需求越来越高。我国是栗子生产第一大国,2009年产量约为109万t[2]。栗子壳为栗子深加工过程中产生的废弃物,含有棕色的色素——栗子壳色素。国内外学者对栗子壳色素的提取工艺、稳定性、抗氧化活性、抑菌活性、印染性能和食品着色性能等方面进行了研究,取得了一些成果[3]。栗子壳色素的提取依据所用溶剂不同大体可以分为2类:碱性水溶液提取(碱提法)[4-5]和乙醇水溶液提取(醇提法)[6-7]。碱提法较醇提法色素得率高,但得到的栗子壳色素的溶解性能较差,在中性和酸性水溶液中以及醇溶液中只有其中很少的一部分能够溶解,因此应用范围受到限制。栗子壳色素属于黑色素(melanin),是一类由酚类物质氧化聚合而成的高分子物质[8]。由于黑色素为非均匀性无定形物质,水合后呈胶状,且一般在生物体内与蛋白质、糖类、脂类等物质结合在一起,因此无法通过重结晶或通常的色谱、电泳等方法进行分离纯化[9]。黑色素为腐殖质的类似物,国外有些研究腐殖质的学者曾将黑色素归为活体生物中的腐殖质,并采用对土壤腐殖质进行分级和精制的方法来对来自活体生物中的腐殖质(黑色素)进行分级和精制[10]。本研究以此法为基础,根据溶解性的差异对碱提栗子壳色素进行了分级和精制。与人工合成色素相比,天然色素一般易受光照、温度、pH值、氧化剂和其他一些因素影响,因此本研究还对得到的栗子壳色素的各个分级组分的稳定性进行了比较研究。
1 材料与方法
1.1 材料
栗子(Castanea mollissima)购自沈阳当地市场,手工剥取栗子壳,用蒸馏水洗去栗子壳上黏着的灰尘和残余果肉,然后在60℃烘24 h,粉碎后过0.25 mm筛备用;XAD-8大孔吸附树脂购自Sigma公司(美国);实验所用试剂均为国产分析纯。
1.2 栗子壳色素的提取与分级
栗子壳色素的提取与分级按照图1所示流程进行。
1.2.1 栗子壳色素的提取与游离蛋白的脱除
称取60 g栗子壳放入1 L烧瓶中,加入900 mL 0.5 mol/L的NaOH水溶液,置于40℃水浴中提取36 h后用棉布粗滤,滤液于5 000 g离心30 min。离心上清液采用Sevag法脱除上清液中游离蛋白5次。
1.2.2 栗子壳色素的分级与精制
栗子壳色素的分级与精制按照以下步骤进行:
(1)将脱除游离蛋白后的栗子壳色素粗提液置于烧杯中以2 mol/L的HCl调节至pH 2,静置12 h后以5 000 g离心15 min,分别收集沉淀和上清液,沉淀加蒸馏水并以NaOH调节溶液酸碱度至pH 10~11,使色素重新溶解,离心弃去不溶部分,上清液调节至pH值为2,静置12 h后离心并分别收集上清液和沉淀。如此反复溶解、沉淀数次,至pH为2时上清液接近无色。
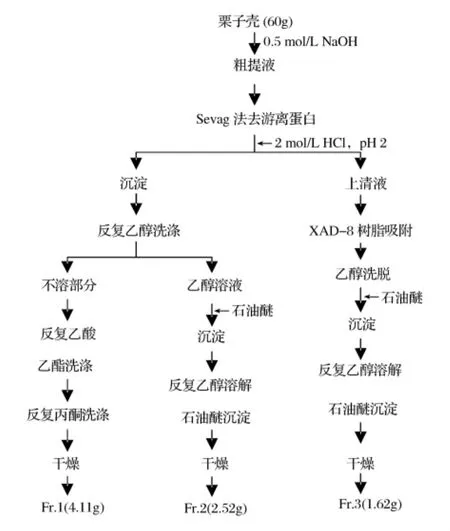
图1 栗子壳色素提取、分级和精制流程
(2)沉淀用乙醇反复洗涤至上清液无色,分别收集沉淀和乙醇溶液。不溶于乙醇的部分先后用乙酸乙酯和丙酮反复洗涤以除去脂溶性成分,最后于60℃下干燥得到色素分级组分Fr.1。
(3)步骤(2)中收集的乙醇溶液中仍然含有色素,向该溶液中加入2倍于乙醇体积的石油醚以使色素沉淀并离心收集,然后用乙醇重新将色素溶解并离心,弃去不溶部分,上清液重新加入石油醚使之沉淀,如此反复3次,以除去脂溶性成分,最后60℃下干燥得到色素分级组分Fr.2。
(4)步骤(1)中酸化至pH 2后离心上清液中仍然含有色素,将其通过XAD-8大孔吸附树脂柱,然后先用3倍于柱体积的pH值为2的水(用HCl调节)洗柱,再用去离子水冲洗至洗出液Cl-定性检测反应为阴性(加入AgNO3洗出液不出现浑浊现象),最后改用乙醇将色素洗脱下来。洗脱液以旋转蒸发仪浓缩至干,然后用无水乙醇重新溶解,加入约2倍体积的石油醚,使色素沉淀,如此反复沉淀3次,以除去脂溶性成分,最后60℃下干燥得到色素分级组分Fr.3。
1.3 栗子壳色素分级组分的溶解性分析
在各个试管中加入0.01 g栗子壳色素分级组分,然后向各试管中分别加入10 mL浓度为1 mol/L的 NaOH、Na2CO3、NaHCO3、NH4OH、HCl水溶液或蒸馏水、甲醇、乙醇、丙酮、乙酸乙酯、三氯甲烷、乙醚、石油醚、正己烷,加盖后室温下放置24 h,期间摇动数次,观察溶液层颜色。
1.4 栗子壳色素分级组分溶液的配制
将100 mg栗子壳色素分级组分用10 mL质量分数0.2% 的氨水在N2保护下溶解,用旋转蒸发仪减压抽去多余氨气,直至pH值达7.5,最后用去离子水稀释至所需浓度。
1.5 栗子壳色素分级组分的化学定性分析
三氯化铁-铁氰化钾试验、明胶试验、盐酸-锌粉试验、三氯化铝荧光试验等化学定性分析参照文献[11]进行。
1.6 栗子壳色素分级组分的紫外-可见光光谱分析
紫外-可见光光谱用UV-2102 PCS分光光度计(尤尼柯仪器有限公司,上海)分析。栗子壳色素分级组分溶液浓度为20 mg/L,扫描范围为200~800 nm。
1.7 栗子壳色素分级组分的稳定性分析
(1)对pH的稳定性:将栗子壳色素分级组分溶液用NaOH或HCl调至不同的pH值,测定400 nm处的吸光度。
(2)对蔗糖的稳定性:4.5 mL 100 mg/L的栗子壳色素分级组分溶液与0.5 mL不同浓度的蔗糖溶液混合,使混合液中蔗糖的浓度分别为0.01、0.1和1 mg/L,在室温下放置12 h后测定400 nm处的吸光度。
(3)对温度的稳定性:取100 mg/L的栗子壳色素分级组分溶液各9份,每份5 mL,装入15 mL具塞试管中,加盖后分为3组,分别置于25、60和100℃水浴中。分别于0.5、1.5和3 h从每个水浴锅中取出1支试管立即用自来水冷却,测定400 nm处吸光度。
(4)对光照的稳定性:取100 mg/L的栗子壳色素分级组分溶液20 mL,置于直径90 mm的培养皿中敞口置于距紫外灯管30 cm处进行照射,分别于0、0.5、1.5、3.5 h取出3.5 mL在400 nm波长下测其吸光度。取100 mg/L的栗子壳色素分级组分溶液2份,每份50 mL,分别置于50 mL具塞三角瓶中,其中1份用黑布包裹,另1份不包裹,将它们同时置于室内自然光下,分别于5、10、15、30 d各取出3.5 mL在400 nm波长下测其吸光度。
(4)对氧化剂和还原剂的稳定性:100 mg/L的栗子壳色素分级组分溶液4.5 mL与0.5 mL不同浓度的Na2S2O3混合,使混合液中Na2S2O3的浓度分别为0.01、0.1和1 mg/L,在室温下放置12 h后测定400 nm处的吸光度。以H2O2代替Na2S2O3研究氧化剂对栗子壳色素分级组分稳定性的影响。
(5)对金属离子的稳定性:以金属的盐酸盐配制浓度为 0.1、1 和 10 mmol/L 的 Na+、Mg2+、Al3+、Ca2+、Fe2+、Fe3+、Cu2+和 Zn2+溶液。4.5 mL 100 mg/L的栗子壳色素分级组分溶液与0.5 mL金属离子溶液混合,在室温下放置12 h后观察有无沉淀产生,并测定未形成沉淀的色素溶液400 nm处的吸光度。
1.8 统计分析
每一个处理独立重复3次,文中数据表示为3次重复平均值±标准误差(S.E.)。
2 结果与讨论
2.1 栗子壳色素分级组分的溶解性
3种栗子壳色素分级组分均溶于碱性水溶液,而不溶于乙酸乙酯、三氯甲烷、乙醚、石油醚和正己烷等亲脂性有机溶剂。Fr.1在中性和酸性水中以及亲水性有机溶剂甲醇、乙醇和丙酮中都不溶解,Fr.3在这些溶剂中都能溶解,而Fr.2溶于亲水性有机溶剂甲醇、乙醇和丙酮但不溶于中性和酸性水。碱提栗子壳色素溶解性较差,在中性和酸性水溶液以及亲水性有机溶剂中只有很少的一部分能够溶解,限制了其应用范围,本研究将其分级为3种溶解性不同的组分,Fr.1适合在碱性条件下使用,Fr.2在碱性条件下以及酒精饮料中均可使用,Fr.3使用范围最广,除了适于碱性条件和酒精饮料外,还可在中性和酸性(如酸性饮料)条件下使用,在应用中可根据不同要求选择合适的分级组分,从而拓宽了栗子壳色素的应用范围。
2.2 栗子壳色素分级组分的化学定性
三氯化铁-铁氰化钾反应的实验结果表明,3种栗子壳色素分级组分均含有酚羟基;各分级组分均不能使氯化钠-明胶溶液产生沉淀,不具鞣性;盐酸锌粉试验阴性且三氯化铝反应未观察到荧光,说明3种栗子壳色素分级组分均不具有典型黄酮类色素性质。李云雁和宋光森[12-13]与段蕊等[14]初步研究后得出结论:栗子壳色素具有典型的黄酮类化合物性质,且含有单宁类化合物;而李永祥等[11]的研究则证明,初步精制的栗子壳色素虽然含有酚羟基但并非黄酮类化合物,也非单宁。本研究与李永祥等[11]的研究结果基本一致。不同学者得到不同甚至相左的结论,可能是由于色素的精制程度不同而引起的,在栗子壳色素粗提液中可能含有黄酮类化合物和单宁。
2.3 栗子壳色素分级组分的紫外-可见光光谱
3种栗子壳色素分级组分均具有黑色素紫外-可见光光谱的典型特征,其谱图都是随着波长增大而逐渐减小的曲线,在可见光区没有明显的吸收峰,仅在270 nm左右有一肩峰。生物体合成的黑色素通常在270~280 nm处存在肩峰或小的吸收峰,而人工合成黑色素则无此特征[14],因而该峰被认为是由结合于黑色素上的蛋白质中的酪氨酸、色氨酸和苯丙氨酸中的苯环引起的。400~600 nm内的吸光度取对数后与相应波长呈负线性关系,其斜率通常作为表征黑色素的参数,Fr.1、Fr.2和Fr.3的斜率分别为-0.005 4、-0.005 0和-0.004 6(图略),与其他黑色素类似,例如:合成多巴黑色素(-0.006 4)[15]和茶叶黑色素(-0.001 9)[16]。以往的报道[11]中,栗子壳色素在紫外区和可见光区均有吸收峰,可能与其精制程度低有关。

图2 栗子壳色素的紫外-可见光光谱
2.4 pH值对栗子壳色素分级组分的影响
3种栗子壳色素分级组分溶液的颜色均随着pH值的增大而逐渐加深,从黄棕色或红棕色逐渐变为红褐色,与其他2个分级组分相比,Fr.2颜色偏红,相同pH值下颜色最深。栗子壳色素同可可色素都属于棕色色素系列,且其紫外光谱也非常相似,都在可见光区没有吸收峰,是一条随波长增加而吸光度减小的曲线[17-19]。国家标准中以400 nm作为测定可可色素色价的波长[18],因此本研究以400 nm处的吸光度作为评价栗子壳色素分级组分稳定性的指标。从图3同样可以看出,3种栗子壳色素溶液的颜色随着pH增加而加深,这种颜色的变化是由于色素中存在大量的酸性官能团,如羧基、酚羟基等,这些官能团的解离而改变了共轭情况,从而导致颜色发生变化。
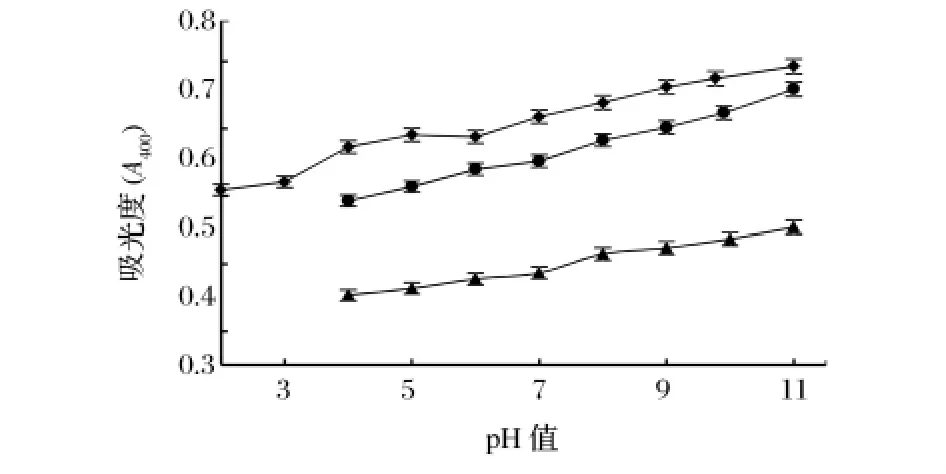
图3 溶液pH值对栗子壳色素分级组分400 nm处吸光度的影响
2.5 蔗糖对栗子壳色素分级组分的影响
栗子壳色素分级组分溶液中加入蔗糖前后的吸光度如图4所示,在加入蔗糖后各色素分级组分的吸光度没有明显变化,说明蔗糖对3种色素溶液没有明显影响。
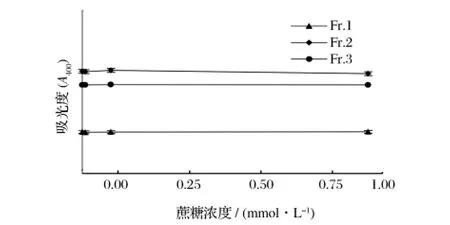
图4 蔗糖对栗子壳色素分级组分400 nm处吸光度的影响
2.6 温度对栗子壳色素分级组分的影响
在室温下栗子壳色素分级组分保持稳定,随着时间延长,其吸光度变化不大,但加热可使栗子壳色素各分级组分的吸光度增大,且随着温度的升高而更为明显(图5)。Fr.3对热最为敏感,加热后吸光度增加幅度最大,而Fr.1相对较为稳定,吸光度增加量较小。
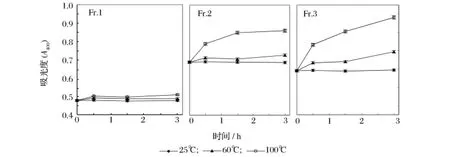
图5 栗子壳色素的热稳定性
2.7 光照对栗子壳色素分级组分的影响
在紫外光照射下3种栗子壳色素分级组分的吸光度均增大,Fr.1增幅最小,而Fr.3增幅最大(图6-A)。从图6-B可以看出,在黑暗条件下Fr.1吸光度先下降后又略有上升,但自然光照条件下吸光度的下降幅度比黑暗下更多,且在试验时间范围内表现为持续下降,因此可以认为自然光照对Fr.1具有褪色作用;对于Fr.2和Fr.3,黑暗放置亦可使吸光度升高,但其幅度不及自然光照条件下,说明自然光对这2种色素具有增色作用。

图6 紫外线(A)和自然光(B)对栗子壳色素400 nm吸光度的影响
2.8 氧化剂和还原剂对栗子壳色素分级组分的影响
在栗子壳色素分级组分溶液中加入不同浓度的H2O2或Na2S2O3,其吸光度变化如图7所示。
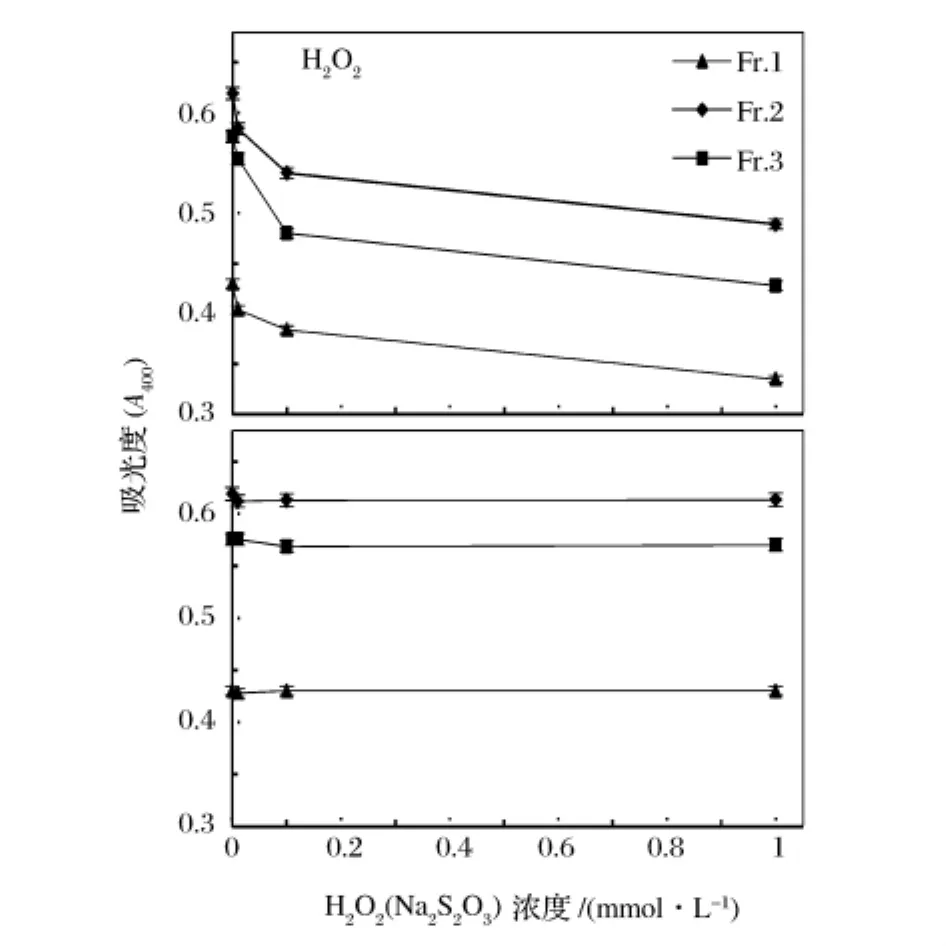
图7 氧化剂和还原剂对栗子壳色素400 nm吸光度的影响
由图7可以看出,3种色素组分均可被H2O2氧化褪色,与李永祥等[11]的研究结果一致,但张捷莉等[19]研究表明,栗子壳色素对H2O2比较稳定,这可能是他们所用的栗子壳色素未经纯化,其中含有一些还原性更强的杂质,保护栗子壳色素未受H2O2氧化褪色。还原剂Na2S2O3对色素没有明显影响,说明3种栗子壳色素均具有一定的还原性。
2.9 金属离子对栗子壳色素分级组分的影响
在栗子壳色素分级组分溶液中加入不同的金属离子后,其吸光度变化如图8所示。3种色素组分在加入Na+或Mg2+后吸光度没有显著变化。低浓度的Al3+、Ca2+、Fe2+、Fe3+和 Cu2+可使各分级组分的吸光度增大,而高浓度时发生沉淀,加入Al3+或Cu2+形成的沉淀为棕色絮状,加入Fe2+或Fe3+形成的沉淀为污黑色絮状。Zn2+的加入使3种分级组分的吸光度均增大,且高浓度可使Fr.1产生棕色沉淀。说明3种栗子壳色素分级组分均对Na+和Mg2+稳定而对Al3+、Ca2+、Fe2+、Fe3+、Cu2+和 Zn2+不稳定,可能是这些金属离子更容易与色素中的羟基、羧基等官能团络合。
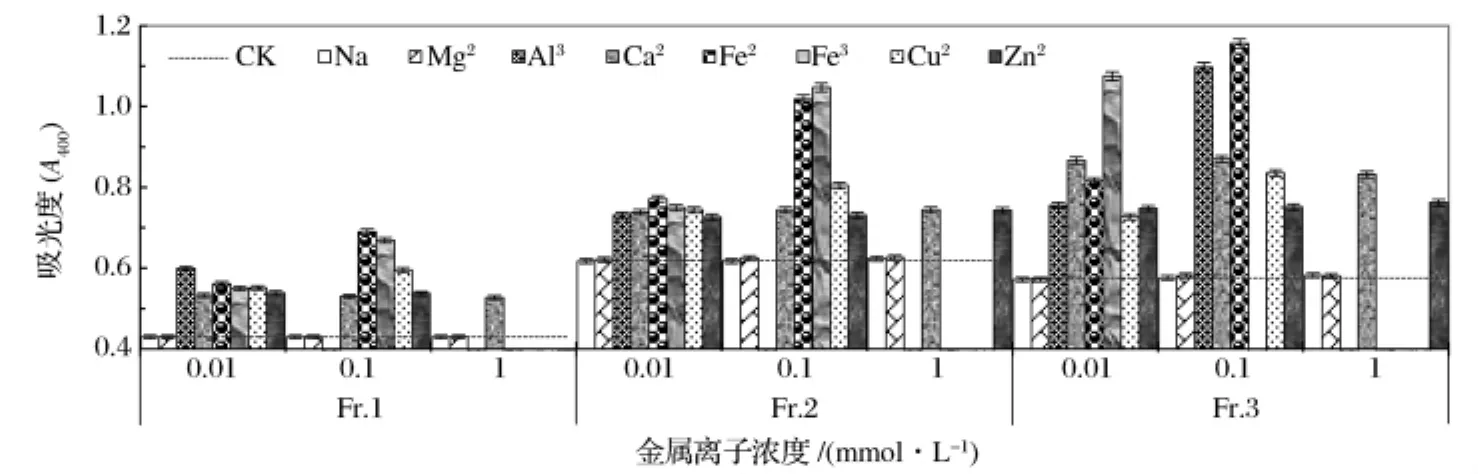
图8 金属离子对栗子壳色素400 nm吸光度的影响
3 结论
本研究根据溶解性不同,将栗子壳色素分级得到3种色素组分Fr.1、Fr.2和Fr.3。Fr.1只溶于碱性水溶液,适合在碱性条件下使用;Fr.2溶于碱性水溶液和甲醇、乙醇、丙酮等亲水性有机溶剂,在碱性条件下以及酒精饮料中均可使用;Fr.3溶在任何pH值的水溶液中都能溶解,在亲水性有机溶剂中也能溶解,除了适于碱性条件和酒精饮料外,还可在中性和酸性(如酸性饮料)条件下使用。本研究提供了一种新的、较为简单和廉价的对栗子壳色素进行分级和精制的方法,在应用中可根据不同要求选择合适的分级组分,从而拓宽了栗子壳色素的应用范围。
对3种栗子壳色素分级组分的稳定性进行了比较研究,各组分的溶液颜色均随着pH值的增大而逐渐加深,在相同浓度和pH值下,Fr.2溶液偏红,颜色最深。加热和紫外线对栗子壳色素具有增色效应,Fr 1对加热和紫外线相对较为稳定,而Fr.3最为敏感。氧化剂可使各栗子壳色素分级组分褪色,且Fr.1褪色幅度最大,Fr.2最小。各色素组分对还原剂都较为稳定。3种色素组分均对Na+和Mg2+稳定而对Al3+、Ca2+、Fe2+、Fe3+、Cu2+和 Zn2+不稳定。蔗糖对栗子壳色素没有显著影响。在食品加工过程中使用栗子壳色素作为着色剂时可根据加工工艺、包装、储存和运输条件等等选择合适的分级组分。
[1] Bridle P,Timberlake C F.Anthocyanins as natural food colours-Selected aspects[J].Food Chemistry,1997,58(1/2):103-109.
[2] FAO.FAOSTAT [EB/OL].http://faostat.fao.org/site/567/default.aspx#ancor,2010,[cited 2011-3-22].
[3] 钟建生,唐孝明,刘永成.板栗壳色素的提取及应用研究进展[J].化工中间体,2010(7):1-4.
[4] 段蕊,张俊杰.板栗壳棕色素的提取及理化性质研究[J].食品工业科技,1998(4):11-12.
[5] 陈连文,刘晶,张金良.板栗壳色素的提取及应用研究[J].江西食品工业,2005(3):13-14.
[6] 张远志.天然板栗壳棕色素提取、精制及性质研究[D].广州:华南农业大学,2004.
[7] 陈忻,陈纯馨,张俊敏,等.从板栗壳中提取棕色素及棕色素理化性质的研究[J].食品科学,2002(11):52-54.
[8] Keresteš J,Venger L A.Biologically active fraction of vegetable melanin,process for its production and its use[P].US,WO200009616-A.2002-04-11.
[9] Enochs W S,Nilges M J,Swartz H M.A standardized test for the identification and characterization of melanins using electron-paramagnetic-resonance(EPR)spectroscopy[J].Pigment Cell Research,1993,6(2):91-99.
[10] Willey R J,Radwan A,Vozzella M E,et al.Humic acid gel drying with supercritical carbon dioxide [J].Journal of Non-Crystalline Solids,1998,225(1):30-35.
[11] 李永祥,詹少华,樊洪泓,等.板栗壳色素化学性质及结构的初步研究[J].食品科学,2008,29(12):51-54.
[12] 李云雁,宋光森.板栗壳色素的提取及其主要成分定性分析[J].广州食品工业科技,2003(3):10-12.
[13] 李云雁,宋光森.板栗壳提取物抑菌作用研究[J].林产化学与工业,2004(4):61-64.
[14] Lin W P,Lai H L,Liu Y L,et al.Effect of melanin produced by a recombinant Escherichia coli on antibacterial activity of antibiotics[J].Journal of Microbiology,Immunology and Infection,2005,38(5):320-326.
[15] EL-Bassam S,Benhamou N,Carisse O.The role of melanin in the antagonistic interaction between the apple scab pathogen Venturia inaequalis and Microsphaeropsis ochracea[J].Canadian Journal of Microbiology,2002,48(4):349-358.
[16] Sava V M,Galkin B N,Hong M Y,et al.A novel melanin-like pigment derived from black tea leaves with immune-stimulating activity[J].Food Research International,2001,34(4):337-343.
[17] 张红梅.花生衣红抗氧化活性的研究[J].食品与生物技术学报,2005,24(6):96-100.
[18] GB8818-2000.食品添加剂 可可壳色素[S].
[19] 张捷莉,马天芳,李铁纯,等.板栗皮棕色素的提取与稳定性研究[J].食品科学,2005,26(9):263-266.

