明胶/CMC复合凝聚法制备微胶囊研究
张海洋 吕 怡 倪 悦 张晓鸣
(江南大学食品学院,江苏 无锡 214162)
明胶/CMC复合凝聚法制备微胶囊研究
张海洋 吕 怡 倪 悦 张晓鸣
(江南大学食品学院,江苏 无锡 214162)
以明胶和CMC(羧甲基纤维素钠)为壁材,肉桂醛为芯材,通过复合凝聚法制备球形多核微胶囊。研究明胶/CMC比例、pH、壁材浓度、芯壁比等参数对胶囊形态、粒径及包埋效果的影响。试验确定最佳工艺参数为:明胶/CMC比例9∶1,pH 4.6~4.7,壁材浓度1%,芯壁比2∶1。在此条件下制备的微胶囊球形较好,表面光滑,粒径均一。与明胶/阿拉伯胶制备的微胶囊相比,形态相似,产率较高,而壁材成本大大降低。
明胶;CMC;复合凝聚;肉桂醛
复合凝聚法是以两种高分子聚合物为壁材,在适当的条件下,使带相反电荷的聚合物发生静电吸附作用,从而包埋芯材的一种微胶囊化方法[1-2]。由于它具有很高的有效载量、基于机械力或温度的控制释放以及缓释能力[3],是一种极具特色又富有前途的微胶囊化方法[4]。
目前的复合凝聚微胶囊技术多以明胶和阿拉伯胶为壁材,对其它壁材组合的研究不多。市售的阿拉伯胶价格较高,质量也不太稳定,对微胶囊的生产影响很大。理论上带负电荷的高分子材料都可以与带正电荷的明胶发生复凝聚反应,作为复合凝聚微胶囊的壁材[5]。本试验以明胶和CMC为壁材,肉桂醛为芯材进行微胶囊化试验,以微胶囊的形态、粒径分布、包埋率为指标,对包埋条件进行优化。
1 材料与方法
1.1 材料与设备
明胶、CMC、冰醋酸、氢氧化钠:上海国药集团化学试剂有限公司;
肉桂醛标准品:成都曼思特生物科技有限公司;
肉桂醛:江西省吉安市恒诚天然香料油提炼厂;
酶固化剂:江南大学食品科学与技术国家重点实验室提供;
数显高速分散机:FJ200-S型,上海标本模型厂;
悬臂式搅拌器:RW20.n型,广州仪科实验室技术有限公司;
pH计:DELTA 320型,梅特勒-托利多仪器上海有限公司;
荧光生物显微镜:BX51型,日本奥林巴斯公司;
紫外可见分光光度计:UV-1600型,上海美谱达仪器有限公司;
激光粒度仪:Mastersizer2000型,英国马尔文仪器有限公司。
1.2 试验方法
1.2.1 复合凝聚微胶囊的制备 将一定比例的明胶和CMC在热水中搅拌溶解,加入芯材肉桂醛,10 000r/min高速分散乳化2~3min。乳状液倒入三口烧瓶中,45℃下恒温匀速搅拌,调节pH至适当值,反应一定时间。降温到15℃ 以下,调节pH至中性,加入酶固化。产品经抽滤,水洗,得到湿囊。湿囊可冷冻干燥,也可以一定固形物含量分散于水中进行喷雾干燥。
1.2.2 微胶囊形态的观测 在搅拌过程中用吸管吸取一滴微胶囊分散液置于载玻片上并铺平,使用荧光生物显微镜观察其形态并拍照。放大倍数100倍。
1.2.3 微胶囊粒径分布测量 将制备的微胶囊悬浊液搅拌均匀,用吸管吸取少许,使用激光粒度仪测定微胶囊的粒径分布,分散剂为水。
1.2.4 微胶囊包埋效果测定
(1)肉桂醛标准曲线的测定:精密吸取一定质量的肉桂醛标准品和样品,用乙醇稀释到一定浓度。以乙醇为空白,在190~350nm范围内做紫外扫描,肉桂醛标准品与样品最大吸收波长同为285nm。使用标准品制备肉桂醛紫外吸收标准曲线,得到回归方程A= 0.1627C-7×10-5(R2=0.999 8)。通过计算样品中肉桂醛含量为96.15%。
(2)微胶囊产率的测定:精确称取一定质量的微胶囊湿囊置于250mL锥形瓶中,加入50mL无水乙醇,震荡提取30min。加入无水硫酸钠去除水分,过滤,精密吸取一定量滤液并稀释,测定其在285nm的吸光值,根据标准曲线按式(1)计算微胶囊中肉桂醛的含量。

(3)微胶囊效率的测定:精确称取一定质量的微胶囊湿囊置于250mL锥形瓶中,加入30mL石油醚,震荡提取15min,过滤,加入无水硫酸钠去除水分,将滤液转移到150mL平底烧瓶中,旋转蒸发至近干,用氮气吹去剩余石油醚,用乙醇溶解肉桂醛并稀释到一定浓度,在285nm测定其吸光值,按式(2)计算微胶囊表面肉桂醛含量。

2 结果与讨论
2.1 微胶囊制备工艺优化
2.1.1 pH的选择 复合凝聚是由静电相互作用引起的两种带相反电荷胶体的凝聚反应。复合凝聚的主要应用之一即制备微胶囊[6]。当明胶/CMC比例一定时,pH会影响它们产生的复合凝聚物的量和性质。Weinbreck等[7]通过试验证实复合凝聚物的高黏度主要来源于蛋白质与多糖由于静电相互作用产生的吸引力,黏度高低主要取决于pH。
图1为明胶/CMC比例为9∶1时不同pH制备的微胶囊形态。由图1可知,pH在4.5到4.7之间可以形成球形微胶囊,其粒径随pH降低而逐渐增大。pH低至4.4时,壁材凝聚过度,形成条形、团聚等不规则微胶囊;当pH升至4.8时,复合凝聚物黏度太小,壁材凝聚不充分,无法形成球形多核微胶囊,而只形成小的条状凝聚物和梭状单核微胶囊,在此条件下壁材利用率较低,且难以通过过滤分离,无法进行下一步研究和具体的应用。
图2为明胶/CMC比例为9∶1,pH 4.5~4.7时的微胶囊产率、效率比较。由图2可知,当明胶/CMC比例一定时,微胶囊的产率随pH变动不大,效率则相差比较大。效率下降的原因可能是由于pH的改变导致复合凝聚物性质的变化。当pH偏离最佳点时,复合凝聚物与芯材的亲和力下降,对芯材的包埋效果变差,更多的芯材黏附于微胶囊表面,使效率下降。对于挥发性强的芯材,表面油含量过高会导致干燥过程中挥发损失较大,而对于易氧化的芯材,表面油容易在干燥过程中变质,所以效率下降会降低微胶囊对芯材的保护效果[8]。
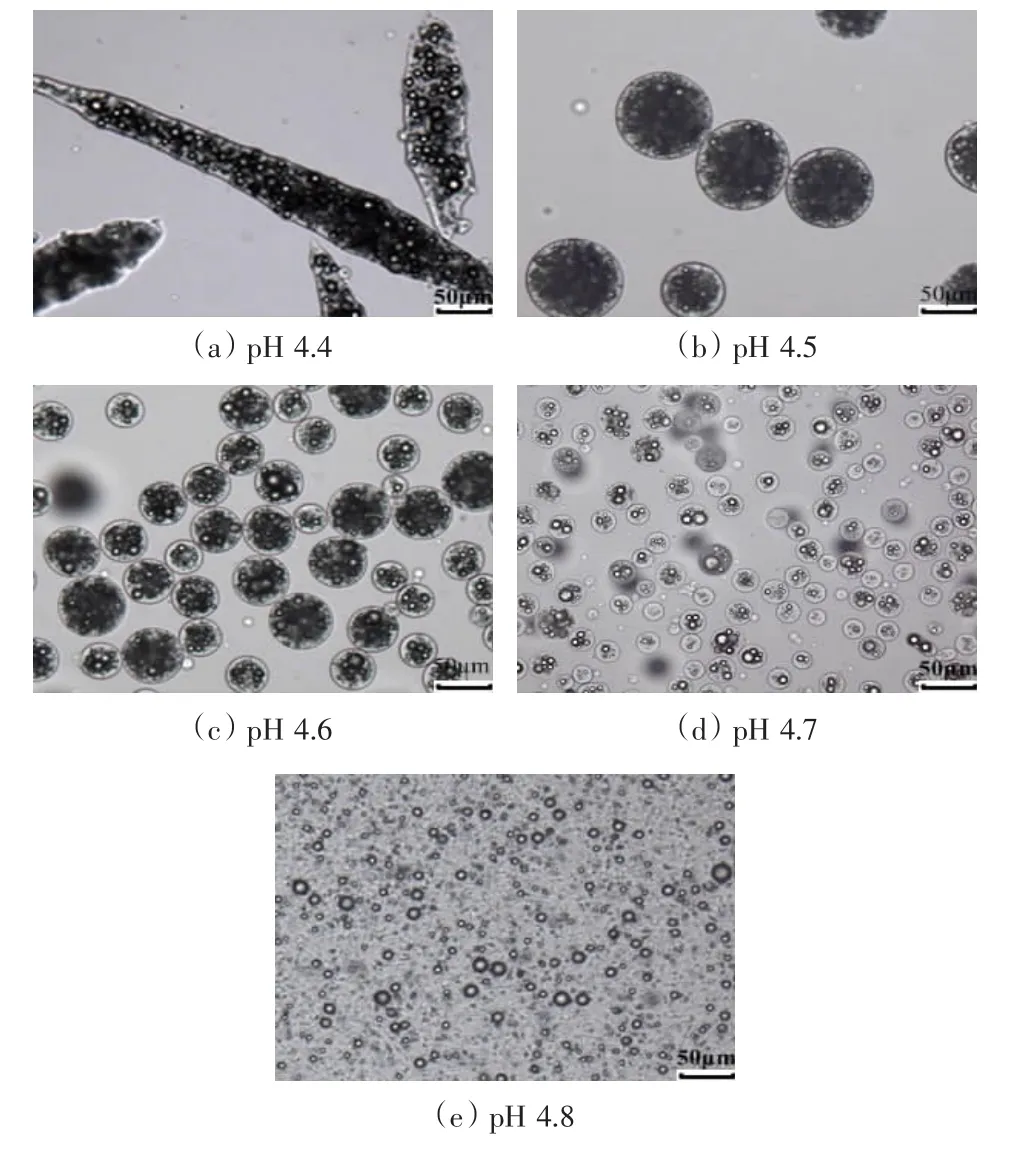
图1 pH对微胶囊形态的影响Figure 1 Effect of pH on morphology of microcapsules

图2 pH对微胶囊包埋效果的影响Figure 2 Effect of pH on the efficiency and yield of microcapsules
图3为明胶/CMC比例为9∶1时pH对微胶囊的粒径分布的影响。粒径的增加是因为pH下降使明胶带有更多的正电荷,能够同CMC发生更为强烈的相互作用,形成具有更高黏度的复合凝聚物[7],从而更容易吸附聚集形成粒径较大的微胶囊。由于pH对复合凝聚微胶囊粒径分布的影响较为显著,因此通过调节pH,能够制备具有特定平均粒径的微胶囊。

图3 pH对微胶囊粒径分布的影响Figure 3 Effect of pH on particle size distribution of microcapsules
由以上结果可看出,pH 4.6~4.7制备的微胶囊,球形较好,粒径均一,产率、效率均较高,所以选取此pH条件。
2.1.2 壁材比例的选择 明胶/CMC比例从7∶1到11∶1,在各比例的最佳pH下制备微胶囊,观察微胶囊形态,测量产、效率。图4为明胶/CMC各比例下制备得到的最佳微胶囊形态及对应pH。

图4 明胶/CMC不同比例时的最佳微胶囊形态及对应pHFigure 4 The optimal microcapsule morphology at corresponding pH in different gelatin/CMC ratio
由图4可知,从7∶1到9∶1,微胶囊达到较好形态的pH逐渐升高,而从9∶1到11∶1,在相同pH下微胶囊的粒径逐渐增大。随着明胶/CMC比例的改变,凝聚反应的最佳pH也在改变。因为复合凝聚反应是通过改变pH来调节蛋白所带的正电量,使其中和多糖所带的负电,从而形成中性的复合凝聚物来包埋芯材的。单个明胶分子所带的正电随着pH的降低而增强[9]。CMC分子在较宽的pH范围内均带负电,电量变化不大。所以当明胶/CMC比例改变时,明胶所应携带的能够中和CMC负电的正电量,以及使明胶携带此正电量的pH均会随之改变。
图5为明胶/CMC各比例下微胶囊的最高产率、效率比较。由图5可知,微胶囊的产率随壁材比例变化不大,但效率相差较大。这可能是因为改变蛋白质与多糖的比例会改变复合凝聚物的黏度[10],进而改变与芯材的亲和力。明胶/CMC比例为9∶1时,复聚物与芯材的亲和力最强,微胶囊的产率、效率均较高。

图5 明胶/CMC不同比例制备的微胶囊的最佳包埋效果Figure 5 The optimal efficiency and yield of microcapsules made in different gelatin/CMC ratio
2.1.3 壁材浓度的选择 图6为壁材总浓度对成囊效果的影响。壁材浓度为0.5%时,也可以形成球形微胶囊,但其大小不一,粒径极不均匀。这可能是因为溶液中胶体浓度下降导致体系乳化性能变差,稳定性降低,乳状液液滴容易聚集形成较大的微胶囊,之后体系中油滴密度相对变小,于是形成许多粒径极小的微胶囊和未包含芯材的空凝聚物球。这样会使壁材的利用率降低,而且粒径太小的微胶囊也会堵塞滤纸,无法进行分离及之后的操作。

图6 壁材浓度对微胶囊形态的影响Figure 6 Effect of wall material concentration on morphology of microcapsules
壁材浓度为1%时,乳状液稳定性较好,形成的微胶囊粒径均一,形态较好。当壁材浓度升至2%时,明胶与CMC形成的复合凝聚物的量大大增加,已经无法形成球形微胶囊,而是生成内含大量油滴的巨大条状凝聚物。试验表明制备微胶囊的最佳壁材浓度为1%。
2.1.4 芯壁比的选择 图7显示了芯壁比对微胶囊形态的影响。芯壁比为0时(即纯壁材明胶+CMC),复合凝聚物呈长条状;芯壁比为1∶3时,生成的微胶囊也呈长条状;芯壁比升至1∶2以上,微胶囊才呈球形。这可能是因为明胶/CMC形成的复合凝聚物与明胶/阿拉伯胶不同,必须要有足够的芯材分散油滴作为核心才可能形成球形微胶囊。芯壁比从1∶2上升至2∶1,均可形成形态较好的球形微胶囊。随着芯壁比的增加,微胶囊粒径略有增大,其中包埋的油滴密度逐渐增大,内部油滴与外壁的距离缩小。这与Green等[11]的芯材用量越大,包埋后微胶囊囊壁越薄的结论是一致的。但当芯壁比上升至2.5∶1和3∶1时,由于悬浮液中的乳状液滴数量大大增加,相互吸附作用增强,形成不规则的长条状或椭圆状微胶囊。

图7 芯壁比对微胶囊形态的影响Figure 7 Effect of core material/wall material ratio on morphology of microcapsules
图8为不同芯壁比制备的微胶囊的产率、效率比较。由图8可知,微胶囊的产率是随芯壁比的增加而上升的。芯材量低于某一特定值时,芯材壁材混合体系的黏度,或混合体系间的结合力太低,芯材无法保持于壁材聚合物颗粒中。所以微胶囊后芯材物质的保留率,基本是随着芯壁比的增加而上升的[12]。芯壁比上升,微胶囊的包埋效果变得更好。芯壁比为2∶1时制备的微胶囊形态完好,粒径均匀,芯材的保留率最高。所以选择此条件。

图8 芯壁比对微胶囊包埋效果的影响Figure 8 Effect of core/wall material ratio on the efficiency and yield of microcapsules
2.2 明胶/CMC微胶囊与明胶/阿拉伯胶微胶囊的比较
图9~10为分别以明胶/CMC与明胶/阿拉伯胶为壁材制备的微胶囊的包埋效果比较。明胶/CMC微胶囊工艺条件为:明胶/CMC比例9∶1,pH 4.6~4.7,壁材浓度1%,芯壁比2∶1。明胶/阿拉伯胶微胶囊工艺条件为:明胶/阿拉伯胶比例1∶1,pH 4.0,壁材浓度1%,芯壁比1∶1[13]。由图9可知,新壁材制备的微胶囊与明/阿微胶囊形态相似,均为球形多核微胶囊,球形完整,壁膜光滑,而且新壁材微胶囊的粒径均一性要好于明胶/阿拉伯胶微胶囊。使用明胶和CMC作为壁材时,和明胶/阿拉伯胶一样能够很好地将芯材肉桂醛包埋在微胶囊中。

图9 明胶/CMC微胶囊与明胶/阿拉伯胶微胶囊的形态比较Figure 9 Morphology of microcapsules made of gelatin/CMC and gelatin/Gum Arabic
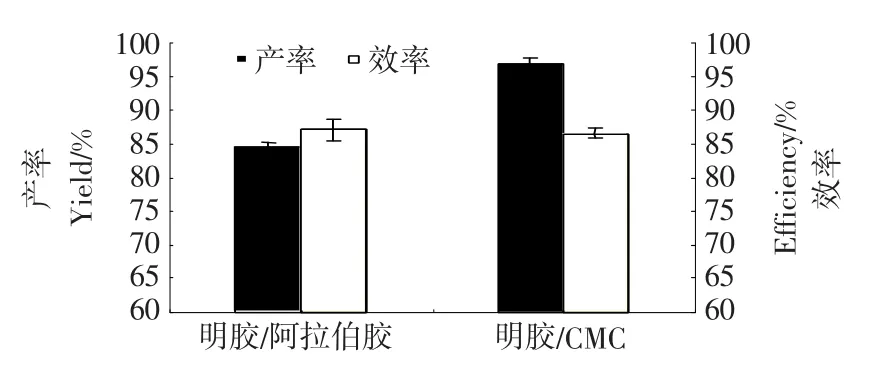
图10 明胶/CMC与明胶/阿拉伯胶微胶囊的产/效率比较Figure 10 Comparison of yield/efficiency of microcapsules made of gelatin/CMC and gelatin/Gum Arabic
由图10可知,新壁材制备的微胶囊效率与明胶/阿拉伯胶微胶囊相近,产率明显高于后者。这可能与明胶/CMC与明胶/阿拉伯胶形成的复合凝聚物与芯材的亲和力不同有关。
3 结论
使用明胶和CMC(羧甲基纤维素钠)为壁材,肉桂醛为芯材,成功制备得到球状多核微胶囊,球形完整,表面光滑,粒径均一。新壁材制备的微胶囊与明胶/阿拉伯胶微胶囊形态相近,产率有了较大的提高。并且由于用CMC取代了价格相对昂贵的阿拉伯胶,使壁材成本大大降低。不过由于固化剂用量是根据明胶量计算,壁材中明胶用量的上升导致了固化剂用量的增加,故需要寻找价格更为低廉的无毒可食用固化剂。对于新壁材制备的微胶囊对芯材的保护效果尚需进一步的研究。
1 张燕萍,谢良.食品加工技术[M].北京:化学工业出版社,2006:119~161.
2 许时婴,张晓鸣,夏书芹,等.微胶囊技术——原理与应用[M].北京:化学工业出版社,2006:30~64.
3 Usha R Pothakamury,Gustavo V Barbosa-Canovas.Fundamental aspects of controlled release in foods[J].Trends in Food Science&Technology,1995,6(12):397~406.
4 Sebastien Gouin.Microencapsulation:industrial appraisal of ex-isting technologies and trends[J].Trends in Food Science and Technology,2004,15(7-8):330~347.
5 Jacky David,Isle Sorgue,Claudine Lefrancois,et al.Microcapsules based on gelatin and polysaccharides and process for obtaining same:US,5051304[P].1991-09-24.
6 Kees de Kruif,Fanny Weinbreck,Renko de Vries.Complex coacervation of proteins and anionic polysaccharides[D].Netherlands:Utrecht University,2004.
7 Weinbreck F,Wientjes R H W.Rheological properties of whey protein/gum arabic coacervates[J].Journal of Rheology,2004,48(6):1 215~1 228.
8 朱丽云,李素芳,邵慧娟.复凝聚喷雾干燥法制备香精香料微胶囊的研究[J].食品科技2006(4):25~33.
9 Burgess D J,Carless J E.Microelectrophoretic studies of gelatin and acacia for the prediction of complex coacervation[J].Journal of Colloid and Interface Science,1984,98(1):1~8.
10 Bryan D Tarr,Missoula,Steven H,et al.Fat substitute:US,5393550[P].1995-02-28.
11 Barrett K Green,Lowell Schleicher,Dayton.Oil-containing microscopic capsules and method of making them:US,2800457[P].1957-07-23.
12 Lee S J,Rosenberg M.Microencapsulation of theophylline in whey proteins:Effects of core-to-wall ratio[J].International Journal of Pharmaceutics,2000,205(1-2):147~158.
13 黄晓丹,张晓鸣,董志俭,等.复凝聚法制备肉桂醛微胶囊的研究[J].食品工业科技,2008,29(3):63~69.
Study on microencapsulation technology by gelatin/CMC complex coacervation
ZHANG Hai-yang LV Yi NI YueZHANG Xiao-ming
(School of Food Science and Technology,Jiangnan University,Wuxi,Jiangsu214162,China)
Microencapsulation of cinnamaldehyde using complex coacervation of gelatin and CMC (carboxymethyl cellulose)was investigated.The influence was studied of such parameters as gelatin/CMC ratio,pH,wall material concentration,core/wall material ratio on the morphology,particle size distribution and embedding effect of microcapsules.The optimal technical parameters were as follows:gelatin/CMC ratio 9∶1,pH 4.6~4.7,wall material concentration 1%,core/wall material ratio 2∶1.Microcapsules made under these parameters have nice spherical shape and uniform particle size.Compared with the gelatin/Gum Arabic microcapsules,it has similar morphology,much better embedding effect,but lower cost.
gelatin;CMC;complex coacervation;cinnamaldehyde
10.3969 /j.issn.1003-5788.2010.05.013
国家科技支撑计划(编号:2006BAD27B04)
张海洋(1985-),男,江南大学在读研究生。E-mail:jndxzhy0401@126.com
张晓鸣
2010-05-11

