灰树花多糖硫酸酯化衍生物的制备与抑制HMEC迁移的作用
毛逸嵘, 张 易, 张红霞, 翁 亮, 张红锋
(华东师范大学生命科学学院,上海 200062)
灰树花多糖硫酸酯化衍生物的制备与抑制HMEC迁移的作用
毛逸嵘, 张 易, 张红霞, 翁 亮, 张红锋
(华东师范大学生命科学学院,上海 200062)
灰树花(Grifolafondose)高浓缩精粉经热水提取,95%乙醇沉淀,获得水溶性灰树花粗多糖 GFP.GFP依次经DEAE-cellulose阴离子交换树脂及SephadexG-100葡聚糖凝胶分离纯化得到 GFP1-F,GFP1-M及 GFP1-L3种不含蛋白质的葡聚糖纯品,其分子量依次为1.09×105,1.93×104和2.76×103Da.采用吡啶-氯磺酸法对其进行硫酸酯化修饰,硫酸酯化衍生物 GFP1-FS,GFP1-MS及 GFP1-LS的红外光谱分析表明,3个样品均在1236.90cm-1和811.81cm-1有硫酸酯键的特征吸收峰,13CNMR证明C-6上的羟基被酯化.并且 GFP1-FS的硫酸酯化程度最高,其取代度DS为1.07;GFP1-MS与 GFP1-LS的硫酸酯化程度相当,DS分别为0.66和0.61.划痕法实验结果表明,经1000μg/mL的 GFP1-FS,GFP1-MS及 GFP1-LS处理24h后向划痕区迁移的细胞数明显减少,分别为对照组的73.33%,34.17%和67.21%,均具有抑制人微血管内皮细胞(HMEC)迁移的活性,其中 GFP1-MS的效果最为显著,这可能与GFP1-MS所具有的复杂分支结构有关.
灰树花; 葡聚糖; 硫酸酯化衍生物; 人微血管内皮细胞; 迁移
0 引 言
在肿瘤生长、侵袭和转移的一系列过程中,血管的形成可以为肿瘤组织提供营养物质和氧气,还为肿瘤细胞的血行转移提供通路[1],因此抑制肿瘤血管的形成对于抗肿瘤具有重要意义.肿瘤血管的形成是血管内皮细胞、基底膜成分和肿瘤细胞等多种成分相互作用的结果,肿瘤细胞通过释放血管内皮生长因子(VEGF)激活内皮细胞,同时产生蛋白酶降解基底膜,促使内皮细胞增殖、迁移.目前多数学者认为肿瘤血管内皮是由周围正常组织的血管内皮增生、迁移和分化形成的[2],它是邻近肿瘤细胞的组织中的正常内皮细胞,遭受肿瘤微环境的刺激,持续不断的增生,发生形态和功能的变化而形成肿瘤血管内皮.因此血管内皮细胞成为抗肿瘤药物研究的靶点之一.本文将从灰树花(Grifolafrondosa)多糖的硫酸酯化衍生物对人微血管内皮细胞(HMEC)迁移能力的影响,来研究其抗肿瘤活性.
已有研究表明,一些多糖,如昆布多糖[3]及岩藻衣多糖[4]具有抑制血管生成的作用.KojoanagiS等[4]实验结果显示,天然的岩藻衣多糖和过硫酸酯化岩藻衣多糖都能阻断VEGF165与人脐静脉内皮细胞(HUVEC)的结合,从而抑制 HUVEC的生长、迁移、成管和新生血管的生成,其中硫酸酯化岩藻衣多糖的抑制作用更加明显.目前研究发现,经硫酸酯化修饰的灰树花多糖具有显著的抗病毒、抗炎症、抗肿瘤及抗凝血的活性[5-8].灰树花多糖硫酸酯化衍生物的抗肿瘤作用主要表现在增强免疫功能进而间接杀灭肿瘤细胞,或直接抑制肿瘤细胞生长两个方面[6,9].史宝军等[10]实验结果表明,灰树花多糖硫酸酯化衍生物 SGAP-P能抑制肿瘤细胞SGC-7901的增殖,并促使细胞凋亡.关于灰树花多糖硫酸酯化衍生物对血管内皮细胞迁移能力的影响尚未见报道.本文从灰树花高浓缩精粉水提物中获得不含蛋白且主要含有α糖苷键的3个葡聚糖组分,并对其进行硫酸酯化修饰,利用划痕法(Scratching assay)初步探讨灰树花多糖硫酸酯化衍生物对血管内皮细胞迁移的作用.
1 材料与方法
1.1 材料与仪器
灰树花高浓缩精粉由上海童童食品有限公司提供;Cellulose DE-52为Whatman产品;Sephadex G-100为上海喜润化学工业有限公司产品;T系列Dextran标准葡聚糖为Pharmacia产品;氯磺酸、吡啶、甲酰胺、三氟乙酸(TFA)、硼氢化钠和乙酸酐等试剂均为国产分析纯.
人微血管内皮细胞(HMEC)购自美国ATCC公司,用含20%胎牛血清的Mcdb131培养基进行传代培养.
紫外-可见光分光光度计UV-VIS 8500 spectrophotometer(上海天美科学仪器有限公司);HPLC色谱仪 1100化学工作站 (Beckman Corporation),色谱柱为 TSK-GEL G4000PW(XL)(TOSOH);气质联用分析仪 Thermo FINNIGAN (Thermo Electron Corporation),气相色谱柱为Rtx-5MS(15m×0.25mm×0.25μm);红外光谱分析仪NICOLET NEXUS 670 FT-IR(Thermo Electron Corporation);核磁共振波谱分析仪Bruker DRX500 (Bruke Corporation).
1.2 灰树花多糖的分离与纯化
灰树花多糖的分离纯化流程如图1所示.灰树花高浓缩精粉100g溶于1L开水中,趁热过滤,加入3倍体积的95%乙醇,4℃静置24h,倾去上清液,沉淀依次用两倍体积的无水乙醇和丙酮洗涤以脱去水分,40℃下烘干得灰树花粗多糖 GFP39.829g,得率为39.8%.取一定量 GFP溶于10倍体积的水中,离心除去不溶物后,上DEAE-cellulose阴离子交换柱.糖类化合物分子中含有许多醇羟基而具有弱酸性和极性,可与强碱性阴离子交换树脂发生离子交换作用而被吸附.中性多糖不与吸附剂交换而自然流出,酸性多糖含有羧基,吸附在纤维素离子交换树脂上,可用NaCl梯度溶液作为洗脱剂将酸性多糖从树脂上洗脱下来,达到酸性多糖与中性多糖分离提纯的目的.因此依次用水、0.1,0.2,0.4和0.8mol/LNaCl溶液洗脱,苯酚-浓硫酸法检测各管糖含量,合并各流分.减压浓缩后对蒸馏水透析(透析袋型号MD45(2000)),内液冷冻干燥,得到水洗组分 GFP1,为中性多糖,以及0.1mol/L NaCl洗脱组分 GFP2为酸性多糖,0.2~0.8mol/LNaCl洗脱时未得到其它组分(见图2).GFP1溶于0.1g/L叠氮化钠溶液中,上SephadexG-100柱(2.6cm×70cm),经0.1g/L叠氮化钠溶液洗脱,依次得到 GFP1-F,GFP1-M和 GFP1-L3个多糖组分.
1.3 多糖纯度及分子量的测定
将 GFP1-F,GFP1-M和 GFP1-L配成1mg/mL水溶液,400~200nm紫外扫描,观察在280nm处是否有紫外吸收,检测蛋白含量.
采用高效凝胶渗透色谱法(HPGPC)测定多糖分子量.HPLC色谱仪由Beckman Coulter System Gold508自动进样器,Gold 126 gradient HPLC泵及 Sedex 75 ELSD检测器构成.色谱柱为 TSK-GEL G4000 PW(XL),流动相为0.003mol/LNH4AC,流速0.5mL/min,样品浓度为0.2%(w/v),进样量10μL.用 T系列Dextran(T500,T70,T40和 T10,Pharmacia)制作标准曲线,标准曲线方程为lgM=-0.4136x+12.25,根据分子量与保留时间RT的关系,即可算出多糖的平均分子量.
1.4 糖基组成分析
取 GFP1-F,GFP1-M和GFP1-L各2mg,溶于4mL2mol/LTFA中,110℃下封管水解1.8h,加甲醇反复减蒸发缩至干.产物溶于2mLH2O中,取5μL进行TLC分析确定是否含有糖醛酸(如含糖醛酸会显示粉红色斑点).剩余部分加入25mgNaBH4,室温下还原2h,间歇振荡,用乙酸中和至无气泡产生,反复加甲醇减压蒸发至完全干燥.于100℃下干燥15min,加入2mL乙酸酐,100℃反应1h.反复加甲苯减压蒸发除去乙酸酐,产物经氯仿萃取,水洗4次,氯仿层经无水硫酸钠干燥,浓缩至50μL后进行 GC-MS分析[11].
气相分析仪为FINNIGAN Trace GC Ultra,质谱分析仪为 FINNIGAN Trace DSQ.气相色谱柱为DB-5MS毛细管柱(15m×0.25mm×0.25μm),进样量1μL,流速1mL/min.温度设定从120℃到250℃,10℃/min,在到达250℃后保持10min.
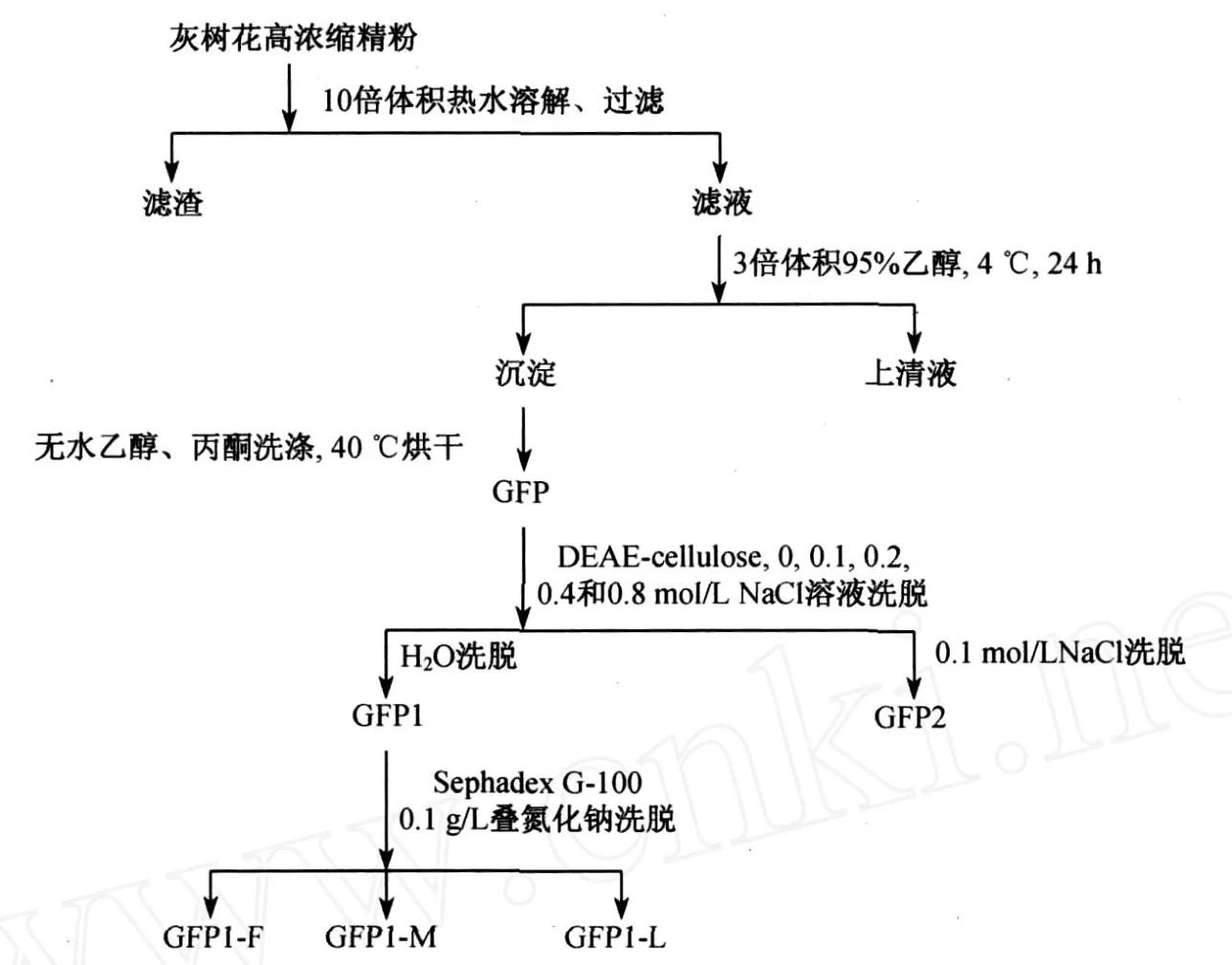
图1 灰树花多糖分离纯化流程图Fig.1 Scheme for isolation and purification of GFP1-F , GFP1-M and GFP1-L
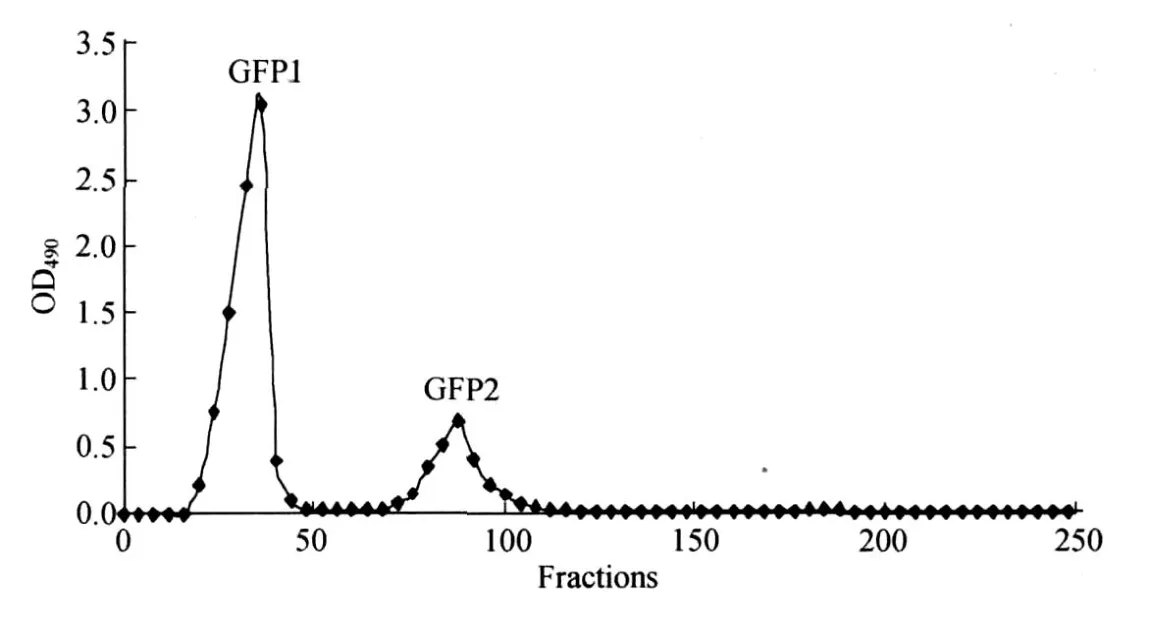
图2 GFP在DEAE-cellulose上的洗脱图Fig.2 Elution profile of GFP on DEAE-cellulose column
1.5 硫酸酯化修饰
采用吡啶-氯磺酸法对GFP1-F,GFP1-M及 GFP1-L进行硫酸酯化修饰[11],各取50mg加入5mL甲酰胺,室温下磁力搅拌15min,加入1.33mL吡啶,然后逐滴加入0.67mL氯磺酸,室温下搅拌2h.反应液于40℃下保温4h,之后加入10mL甲醇,最后用2.5mol/LNaOH调节pH至7.0.反应液对水透析,经浓缩、冻干后即得相应的硫酸酯化衍生物,分别命名为GFP1-FS,GFP1-MS和GFP1-LS.
1.6 硫酸基含量测定及取代度(DS)计算
硫酸基含量测定采用氯化钡-明胶浊度法[12].精确量取0,0.04,0.08,0.12,0.16和0.2mL标准硫酸钠溶液于具塞试管中,补加1mol/LHCl至体积为0.2mL,分别加入3.8mL3%三氯乙酸(w/v)和1mL氯化钡-明胶试剂,混匀后于室温下静置15min,以不含标准液的0号管作为空白管,测定360nm下的吸光度.以含硫的质量为横坐标,吸光度为纵坐标,得标准曲线.
称取各硫酸酯化衍生物4.5mg于具塞试管中,加入1mol/LHCl4.5mL,100℃下水解2.5h,冷却至室温后取0.2mL进行测定,后续操作同标准曲线测定过程.根据标准曲线计算出硫的含量S%.
样品取代度的计算公式为:DS=1.62×S%/(32-1.02×S%);S%为S含量.
1.7 红外光谱分析
取1mg样品,溴化钾压片,于4000~500cm-1进行红外扫描.
1.8 核磁共振分析
取 GFP1-F,GFP1-M,GFP1-L,GFP1-FS,GFP1-MS和 GFP1-LS各40mg,溶于0.5mLD2O中,置于Φ5mm核磁管中,TMS作内标,500MHz核磁仪于室温下测定.
1.9 血管内皮细胞运动能力实验(划痕法)
利用划痕法研究血管内皮细胞的迁移运动[13].HMEC细胞以8×105/孔接种至6孔板中,细胞在37℃5%CO2培养箱中常规培养1d,至细胞长满90%.换成含1%胎牛血清的培养基进行同步化处理12h.然后,用1mL的灭菌枪头进行十字划痕,划痕后用D-Hank’s液润洗两次,洗去浮起的细胞.每孔加入1mL含1%胎牛血清的培养基,实验组分别加入灰树花多糖及其硫酸酯化衍生物(用含1%血清的培养基配制),终浓度为1mg/mL.将培养板放入CO2培养箱,37℃5%CO2常规培养24h.
划痕后即刻在倒置相差显微镜下拍照,标记划痕宽度.培养24h后再次拍照,人工计数迁移至划痕区的细胞数.以空白对照组表示为100%,各实验组与对照组相比得出迁移细胞数的相对百分率.
2 结果与讨论
2.1 多糖的分离纯化与结构初探
2.1.1 多糖的分离与纯化
经过沸水提取,95%乙醇沉淀,DEAE Cellulose阴离子交换色谱分离,得到水洗组分GFP1.再经Sephadex G-100葡聚糖凝胶色谱纯化,依次获得3个组分——GFP1-F,GFP1-M和 GFP1-L.用碘-碘化钾试剂检测均不显蓝色,表明其不为淀粉.
HPGPC结果显示,GFP1-F,GFP1-M和 GFP1-L均表现为对称的单峰(见图3),说明三者都为均一组分.根据标准曲线方程和样品的保留时间,计算平均分子量,GFP1-F,GFP1-M和 GFP1-L的分子量依次为1.09×105,1.93×104和2.76×103Da(见表1).
紫外扫描的结果显示,GFP1-F,GFP1-M和 GFP1-L在280nm处均无紫外吸收,说明所得到的3个多糖组分都不含有蛋白质.
2.1.2 糖组成分析
GFP1-F,GFP1-M和GFP1-L3个样品经 TFC完全水解后,TLC分析未看到粉红色斑点,表明均不含有糖醛酸,为中性多糖.GC-MS分析结果表明,3个样品的谱图均显示一个单峰,与标准品葡萄糖的谱图对比,3个样品均完全由葡萄糖组成,即为葡聚糖(见图4).
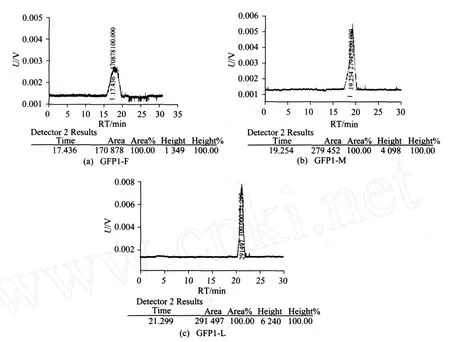
图3 GFP1-F,GFP1-M和GFP1-L的HPGPC图谱Fig.3 Fig. 3 HPGPC profile of GFP1-F , GFP1-M and GFP1-L
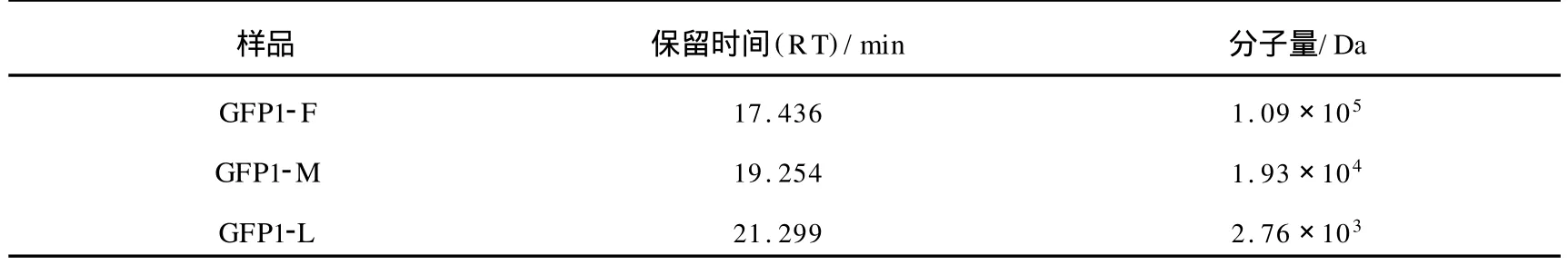
表1 GFP1-F,GFP1-M和GFP1-L在 HPGPC检测中的保留时间及相应的分子量Tab.1 The retaining time and molecular weight of GFP1-F , GFP1-M & GFP1-L in HPGPC
2.1.3 GFP1-F,GFP1-M和GFP1-L结构分析
红外光谱显示 GFP1-F在847.59cm-1处有吸收峰,1HNMR谱显示 GFP1-F的 H1信号在δ5.407ppm,表明GFP1-F为α葡聚糖.13CNMR结果显示,C-1信号在δ99.702ppm,表明为α-1,4-糖苷键.在δ60.370ppm有一个较强的C-6信号,在δ69.224ppm有一个较弱的C-6信号,说明有极少量的 C-6取代.C-4,C-3,C-5及 C-2信号分别在δ76.658ppm,δ72.788ppm,δ71.442ppm及δ70.288ppm(见图5a).由此初步判断GFP1-F具有α-1,4-糖苷键的主链和极少量α-1,6-糖苷键的分支.
1HNMR结果显示 GFP1-M 的 H1信号有3个,分别在δ5.343ppm,δ5.059ppm和δ4.917ppm.前两个信号均大于5ppm,属于α构型的特征,而第3个信号小于5ppm,属于β构型的特征[11],因此,GFP1-M的结构中α和β两种构型同时存在.GFP1-M的13CNMR结果显示,C-1信号共有 4个,依次在δ98.953ppm,δ99.173ppm,δ100.895ppm 和δ103.546ppm,前3个信号属于α构型,为α-1,4-糖苷键;而第4个信号与β-1,4-葡聚糖的C-1信号相吻合[11],进一步表明 GFP1-M含有α和β两种构型的糖苷键.C-6信号出现在δ62.019ppm和δ68.085ppm,说明 C-6位有取代.C-4,C-3,C-5和 C-2信号分别在δ78.117ppm,δ74.359ppm,δ72.659ppm和δ71.439ppm(见图5b).由此初步判断GFP1-M具有α-1,4-糖苷键的主链和少量α-1,6-糖苷键的分支以及β-1,4-糖苷键的分支.
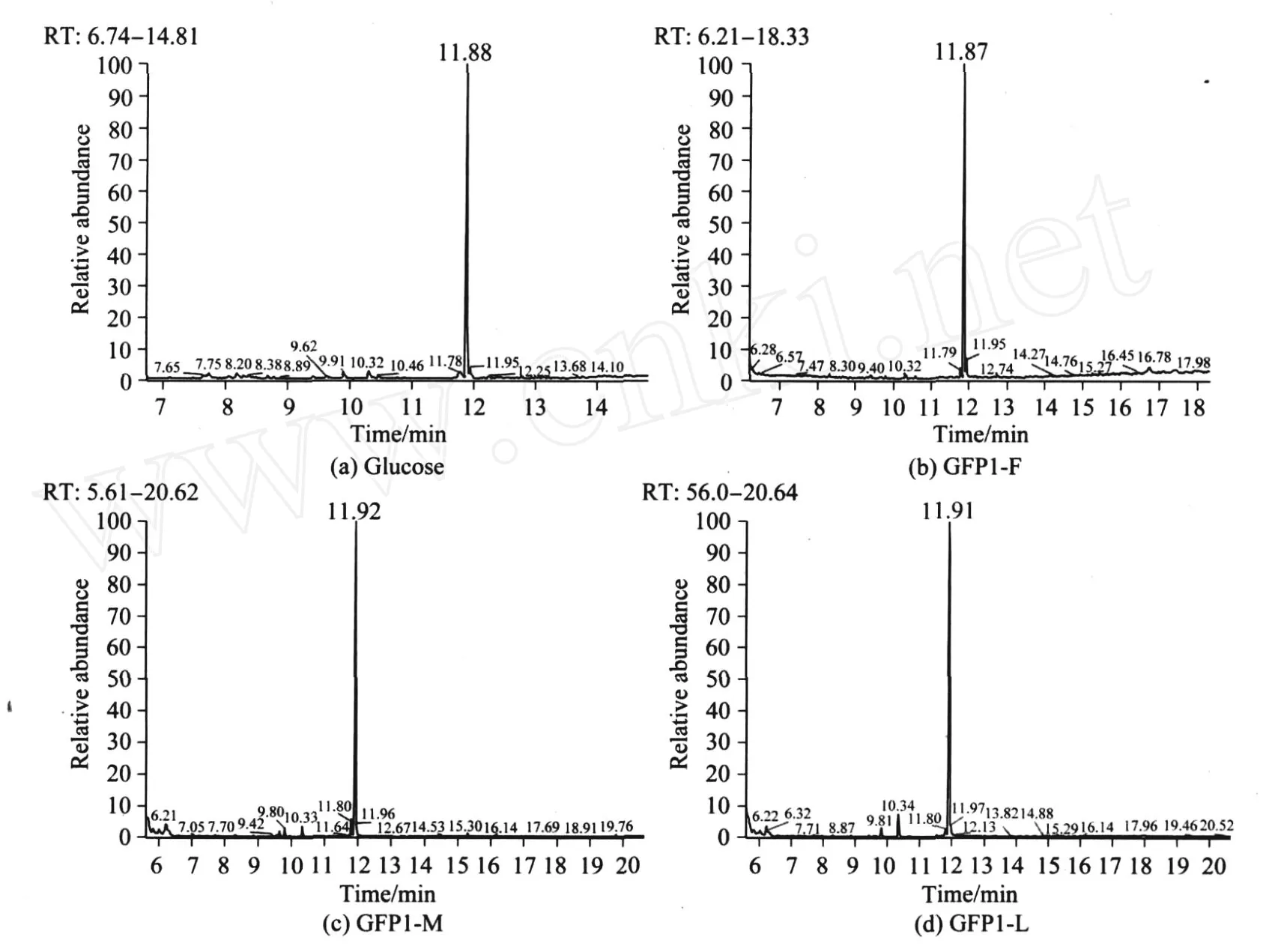
图4 标准葡萄糖,GFP1-F,GFP1-M和 GFP1-L的糖组成分析 GC图Fig.4 GC pattern of sugar composition analysis of GFP1-F , GFP1-M & GFP1-L
红外光谱分析结果显示,GFP1-L在848.34cm-1处有吸收峰,1HNMR谱结果显示GFP1-L的 H1信号在δ5.332ppm,表明 GFP1-L为α葡聚糖.GFP1-L的13CNMR结果显示C-1信号在δ101.252ppm,C-6信号在δ61.688ppm,C-4,C-3,C-5和C-2信号分别在δ79.067ppm,δ75.252ppm,δ73.958ppm和δ71.195ppm(见图5c),表明GFP1-F为α-1,4-连接的葡聚糖,但用碘-碘化钾检测无显色反应,说明不是直链的1,4葡聚糖,可能存在支链结构.ShiLei[14]等分离到一种带有1,6分支结构的α-1,4-葡聚糖,其13CNMR谱图与GFP1-L的非常相似,虽然这种葡聚糖中含有1,6糖苷键,但并未出现C6位上发生取代的信号,这可能与1,6糖苷键在整条糖链中所占的比例有关,根据文献[12]一般认为取代基含量少于5%,还是不能出现信号的.据此推测,GFP1-L可能是含有极少量1,6连接分支结构的α-1,4葡聚糖.
2.2 硫酸酯化衍生物制备
2.2.1 硫酸酯化程度分析
GFP1-F,GFP1-M和 GFP1-L经硫酸酯化后的含硫量及DS如表2所示.3个样品中,GFP1-FS的硫酸酯化程度最高,DS为1.07;而 GFP1-MS与 GFP1-LS的硫酸酯化程度相当,DS分别为0.66和0.61.
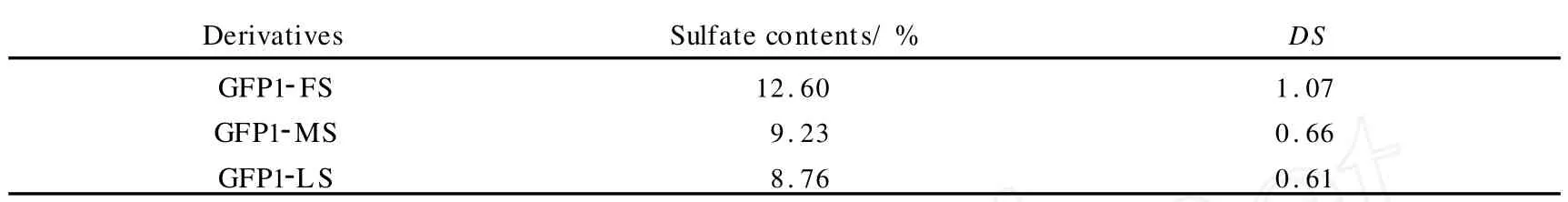
表2 GFP1-FS,GFP1-MS和 GFP1-LS的硫酸酯化程度Tab.2 Degrees of substitution ( DS) of GFP1-FS , GFP1-MS & GFP1-LS
2.2.2 硫酸酯化衍生物的红外光谱分析
比较硫酸酯化前后的红外光谱可以看出,3种硫酸酯化产物的红外光谱均在1236.90cm-1显示出不对称的S=O键振动吸收峰,在811.81cm-1显示出对称的C-O-S伸缩振动吸收峰,这些都是硫酸酯键的特征吸收峰.同时,还可以看出在3400cm-1附近的羟基吸收峰有所降低,表明部分羟基已被酯化,证明GFP1-F,GFP1-M和GFP1-L已修饰形成硫酸酯化衍生物 GFP1-FS,GFP1-MS和 GFP1-LS.
2.2.3 硫酸酯化衍生物的13CNMR分析
对比GFP1-F,GFP1-M和 GFP1-L硫酸酯化前后的13CNMR谱图,3个样品经过硫酸酯化修饰后C-6信号均由修饰前的δ61ppm左右移至δ66ppm左右的位置,且硫酸酯化前在δ61ppm的信号均完全消失(见图5),表明 GFP1-F,GFP1-M和 GFP1-L上原先未发生取代的C-6上几乎都与硫酸基成酯.
另外,GFP1-FS与 GFP1-LS的13CNMR谱图显示,这两个样品的C-1信号均向高场位移大约4ppm,提示C-2上可能发生硫酸基的取代,由此对β碳增进屏蔽,使其信号向高场方向移动[15].同时在1HNMR谱图上看到 H1信号向低场位移大约0.5ppm,还在13C NMR谱图上看到GFP1-FS与GFP1-LS的C-3信号为两个小峰,即向低场方向裂解出一个峰.这些都可能是受C-2上硫酸基取代的影响而出现的.但是C-2位上羟基的硫酸酯化修饰的相当微弱的.
从硫酸酯化产物的13CNMR结果可以看出,α-1,4葡聚糖的硫酸酯化反应中C-6位上羟基的反应活性远大于C2位置上的羟基,甚至C-6位上羟基的可以全部被硫酸酯化修饰,这与前人的研究结果一致[16].
2.3 硫酸酯化衍生物对 HMEC细胞迁移能力的影响
划痕法是一种模拟体外愈伤模型设计的考察细胞迁移运动能力的实验,可从二维水平上衡量药物对细胞迁移能力的影响[12].本文分别用1000μg/mL的 GFP1-F,GFP1-M及GFP1-L作用 HMEC细胞24h,发现各组细胞均向划痕区爬行,组间没有显著差异(照片未列在本文中),说明3个多糖组分没有抑制 HMEC迁移的作用.
分别用1000μg/mL的 GFP1-FS,GFP1-MS和 GFP1-LS作用 HEMC细胞24h,镜检记录HMEC向划痕区迁移的细胞数.由图6可以看出,Control组的划痕区基本上已经被爬出的 HEMC细胞所占据.与此相比,经 GFP1-FS,GFP1-MS和 GFP1-LS处理后向划痕区迁移的细胞数明显减少,分别为对照组的73.33%,34.17%和67.21%,其中 GFP1-MS对HMEC细胞迁移的抑制效果最为显著(P<0.01),比 GFP1-FS与 GFP1-LS的抑制效果强一倍,而且细胞爬出的距离也相对最短.
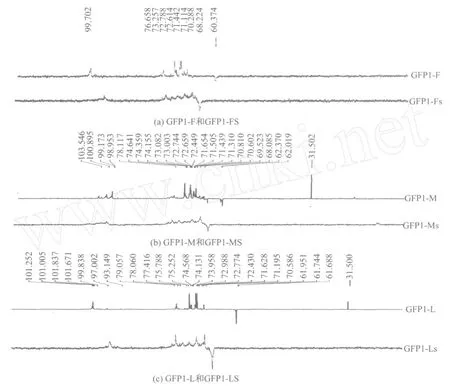
图5 GFP1-F,GFP1-M,GFP1-L及其硫酸酯化衍生物的13CNMR谱图Fig.5 13C NMR spect rums of GFP1-F , GFP1-M , GFP1-L and their sulfated derivatives
实验结果表明,3个灰树花多糖样品对 HEMC细胞迁移没有影响,而其硫酸酯化衍生物具有明显的抑制细胞迁移的作用.ChengJJ[17]等利用划痕实验发现1000μg/mL的樟芝多糖能抑制牛主动脉内皮细胞(BAEC)的迁移运动.KojoanagiS等[4]在 Transwell小室实验中发现,天然的岩藻衣多糖和过硫酸酯化岩藻衣多糖均能抑制 HUVEC的迁移,100μg/mL岩藻衣多糖处理后迁移细胞数是对照组的75.2%,100μg/mL过硫酸酯化岩藻衣多糖处理后迁移细胞数是对照组的56.1%.天然的岩藻衣多糖本身具有一定的硫酸基团,其含硫量为32.6%,由此表现出抑制细胞迁移的活性,而过硫酸酯化岩藻衣多糖的含硫量为56.7%,其抑制作用则更为明显.本文制备的灰树花多糖硫酸酯化衍生物 GFP1-FS,GFP1-MS和 GFP1-LS的含硫量分别为12.6%,9.23%和8.76%,以 GFP1-MS的抑制效果最为显著,由于 GFP1-MS是三者中分支结构最复杂的,所以结果提示,灰树花多糖硫酸酯化衍生物对细胞迁移的抑制作用不仅与硫酸酯化修饰有关,还可能与 GFP1-MS所具有的复杂分支结构有关.
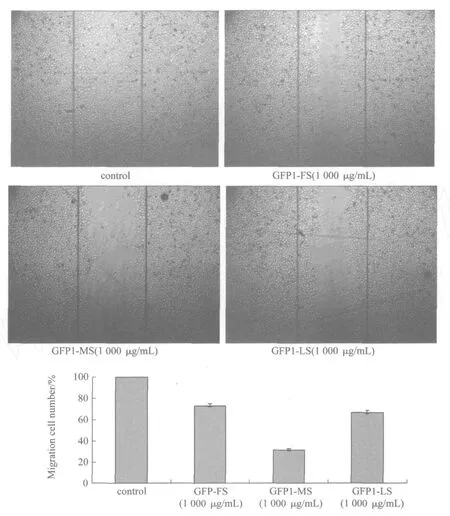
图6 灰树花多糖硫酸酯化衍生物作用24h对 HMEC细胞迁移能力的影响Fig.6 The effect of sulfated derivatives on HMEC migration after 24 h t reatment
[1] FOL KMAN J , BROWDER T , PALMBLAD J . Angiogenesis research : guidelines for t ranslation to clinical application[J ] . Thromb Haemost , 2001 , 86 : 23-33.
[2] PAN H. Tumor angiogenesis and clinical application of antiangiogenesis[J ] . Chinese Journal of Pharmaceuticals ,2006 , 37 : 133-136.
[3] 徐中平,李富川,王海仁.昆布多糖硫酸酯的抑制血管生成和抗肿瘤作用[J].中草药,1999(7):24-26.
XU Z P , LI F C , WANG H R. Anti-angiogenic and anti-t umor activities of sulfated fucoidan[J ] . Chinese Medicine, 1999 (7) : 24-26.
[4] KOJOANAGI S , TANIGAWA N , NA KAGAWA H , et al . Oversulfation of fucoidan enhances it s anti-angiogenicand antitumor activities [J ] . Biochemical pharmacology , 2003 , 65 : 173-179.
[5] 栗衍华,谭成玉,王秀武,等.硫酸酯化多糖的制备及其生物活性的研究进展[J].精细与专用化学品,2006,14:6-9.
LI Y H , TAN C Y, WANG X W , et al . Progresses on preparation of sulfated polysaccharides and it s bioactivity[J ] . Fine and Specialty Chemicals , 2006 , 14 : 6-9.
[6] 刘安,臧立华,孙庆济.灰树花多糖抗肿瘤作用临床观察[J].山东轻工业学院学报,2008,22(2):43-45.
LIU A , ZANG L H , SUN Q J . Clinical observation of effect on Gri f ola f rondosa amylose against tumor [J ] .Journal of Shandong Institute of Light Indust ry , 2008 , 22 (2) : 43-45
[7] NIE X H , LIU Y L , TAO W Y, et al . Preparation of a chemically sulfated polysaccharide derived f rom Gri f olaf rondosa and it s potential biological activities[J ] . International Journal of Biological Macromolecules , 2006 , 39 :228-233.
[8] 于广利,高昊东,杨波,等.一种水不溶灰树花菌丝体多糖(GF4A)硫酸酯化研究[J].中国海洋大学学报,2008,38(1):17-22.
YU G L , GAO H D , YANGB , et al . Study on sulfate condition of a water-insoluble mycelia polysaccharide f romGri f ola f rondosa ( GF4A) [J ] . Journal of Chinese Ocean University , 2008 , 38 (1) : 17-22.
[9] 郁皓,许泓瑜,华东.硫酸酯化灰树花多糖体外诱导胃癌细胞SGC-7901凋亡的研究[J].山东医药,2006,46(21):54-55.
YU H , XU H Y, HUA D. Study on apoptosis induction of sulfated derivatives of Gri f ola f rondosa polysaccharideon SGC-7901 in vi t ro[J ] . Shandong Medicine , 2006 , 46 (21) : 54-55.
[10] SHI B J , NIE X H , CHEN L Z , et al . Anticancer activities of a chemically sulfated polysaccharide obtained f romGri f ola f rondosa and it s combination wit h 5-Fluorouracil against human gast ric carcinoma cells[J ] . CarbohydratePolymers , 2007 , 68 : 687-692.
[11] BLACKENEY A B , HARRIS P J , HENRY R J , et al . A simple and rapid preparation of alditol acetates for monosaccharideanalysis [J ] . Carbohydrate Res , 1983 , 113 : 291-299.
[12] 张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1997.
ZHANG W J . Biochemical Research Techniques of Sugar Complex [M] . Hangzhou : Zhejiang University Press ,1997.
[13] AZNAVOORIAN S , KUBO K, AOK H N , et al . Molecular aspect s of tumor cell invasion and metastasis [J ] .Cancer , 1993 , 71 : 1368-1370.
[14] SHI L , ZHANG L N , DING K. A novel water-soluble α-(1 →4) -glucan f rom t he root of Cudrania t ricuspidata[J ] . Fitorapia , 2007 , 78 : 298-301.
[15] 葛青,张安强,孙培龙.真菌多糖结构修饰及鉴定研究进展[J].中国食用菌,2008,27(1):5-8.
GE Q , ZHANG A Q , SUN P L. Research progress in st ruct ural modifications of polysaccharide in fungi and t heiridentification[J ] . Edible Fungi of China , 2008 , 27 (1) : 5-8.
[16] 王顺春,方积年.香菇多糖硫酸酯化衍生物的制备及其结构分析[J].生物化学与生物物理学报,1999,31(5):594-597.
WANG S C , FANGJ N. Preparation and st ructural analysis of sulfated derivatives of Lentinan[J ] . Acta Biochimicaet Biophysica Sinica , 1999 , 31 (5) : 594-597.
[17] CHENGJ J , HUANG N K, CHANG T T , et al . Study for anti-angiogenic activities of polysaccharides isolatedf rom A nt rodia cinnamomea in endot helial cell s[J ] . Life Science , 2005 , 76 : 3029-3042.
Preparation of Gri f ol a f rondos a polysaccharide sulfatedderivatives and their inhibitory effects on HMEC migration
MAO Yi-rong, ZHANGYi, ZHANG Hong-xia,WEN GLiang, ZHANG Hong-feng
(School of L i f e Science , East China N ormal Universi t y , S hanghai 200062 , China)
Polysaccharides f rom Gri f ola f rondosa ( GFP) were ext racted by hot water and precipitatedby 95 % EtOH. GFP1-F ,GFP1-M and GFP1-L were further purified by DEAE-celluloseand Sephadex G-100 subsequently f rom GFP. GFP1-F , GFP1-M and GFP1-L were glucan withmolecular weight1.09×105,1.93×104and 2.76×103Da.GFP1-FS , GFP1-MS and GFP1-LSwere polysaccharide sulfates obtained f rom GFP1-F , GFP1-M and GFP1-L with chlorosulfonicacid-pyridine. The IR spect rum of GFP1-FS , GFP1-MS and GFP1-LS showed the characteristicabsorptions of sulfate ester bond at 1 230cm-1and 810 cm-1.The13C NMR result s indicated themodification mainly occurred at C-6 of the polysaccharide sulfates. GFP1-MS had the greatestsulfated degree with DS 1. 07 , while DSs of GFP1-FS and GFP1-LS were 0. 66 and 0. 61 respectively.The scratching assay suggested that 73. 33 % , 34. 17 % and 67. 21 % cells migrated toscratching area compared with cont rol af ter 24-hour t reatment of 1 000μg/ mL GFP1-FS , GFP1-MS and GFP1-LS respectively. So that all the three sulfated derivatives had inhibitory effect s onHMEC migration , especially GFP1-MS had the st rongest activity which may be related with it scomplicated branch st ructure.
Gri f ola f rondosa ; glucan ; sulfated derivative ; HMEC; migration
Q28
A
1000-5641(2010)04-0092-11
2009-04
毛逸嵘,女,硕士研究生.
张红锋,女,副教授.研究方向为细胞生物学.E-mail:hfzhang@bio.ecnu.edu.cn.

