全氟辛磺酸对于爪蟾的甲状腺激素干扰效应
刘俊奇, 刘青坡, 曹庆珍, 钱丽娟, 郭素珍, 施华宏
(华东师范大学环境科学系上海市城市化过程与生态恢复重点实验室,上海 200062)
全氟辛磺酸对于爪蟾的甲状腺激素干扰效应
刘俊奇, 刘青坡, 曹庆珍, 钱丽娟, 郭素珍, 施华宏
(华东师范大学环境科学系上海市城市化过程与生态恢复重点实验室,上海 200062)
运用两栖类变态实验(AMA)研究了全氟辛磺酸(PFOS)对于非洲爪蟾(Xenopuslaevis)蝌蚪的生长、变态和甲状腺组织结构的影响.结果显示,与对照组相比,7d后,10,50和250μg·L-1PFOS暴露组蝌蚪的后肢长分别减小了17%,11%和18%,蝌蚪的发育延缓了1~2个阶段;19d后,10,50和250μg·L-1PFOS组蝌蚪的体重分别增加了17%,10%和20%,体长分别增加了5%,4%和6%,而10μg·L-1和250μg·L-1PFOS组蝌蚪的后肢长分别减小了12%和13%;暴露组甲状腺组织结构出现滤泡数目减少、上皮细胞增生、胶质减少甚至滤泡溶通等现象.结论是,在本实验浓度下,PFOS对于非洲爪蟾的蝌蚪生长有促进作用,对于变态发育过程却有抑制作用.参照AMA的方法,可以判断PFOS为抗甲状腺激素干扰物.
甲状腺激素干扰物(TDCs); 非洲爪蟾(Xenopus laevis); 全氟辛磺酸(PFOS); 两栖类变态实验(AMA)
0 引 言
全氟辛磺酸(PFOS)作为一种新型持久性环境污染物已经受到人们的广泛关注.由于应用广泛,它已在全球范围内的环境介质和生物体内存在.我国境内水环境普遍存在PFOS污染[1].2004年,珠江中该物质的最高浓度可达99ng·L-1[2].2006年大连地区雨雪沉降物中PFOS的含量(几何均值)高达145ng·L-1[3].
PFOS可能是一种新的环境内分泌干扰物[4].有研究表明,口服PFOS能够导致成年大鼠甲状腺素水平的改变,影响甲状腺激素相关基因的表达[5,6].然而,在另一研究中,用PFOS对妊娠期和哺乳期的大鼠进行暴露,则没有对其甲状腺形态,激素水平和肝脏相关基因表达产生明显影响[7].Ankley等[8]的研究表明,3mg·L-1PFOS能导致北方豹蛙(Rana pipiens)变态时间推迟,生长减慢,而0.3~1mg·L-1PFOS对北方豹蛙蝌蚪变态没有影响.刘青坡等[9]用0.01~1mg·L-1PFOS对非洲爪蟾进行6个月的暴露,结果在2个月时观察到PFOS暴露对蝌蚪发育的抑制作用,而在4和6个月时0.01mg·L-1PFOS则表现出对发育的促进作用.可见,目前对PFOS是否具有甲状腺激素干扰效应仍存在意见分歧.因此,有必要采用更灵敏的方法对PFOS是否具有甲状腺激素干扰效应进行检测,并对其作用模式进行深入研究.
经过多轮论证之后,OECD于2008年发布了运用两栖类变态实验(AMA)筛选甲状腺激素干扰物的实验指南.AMA以非洲爪蟾蝌蚪(NF51阶段)为实验模型,暴露21d.运用AMA不仅能有效判断污染物是否具有甲状腺激素干扰效应,同时由于其评价终点是基于化合物作用模式而确定的,对污染物可能的作用模式也具有一定的分析功能.因此,AMA被认为是筛选甲状腺激素干扰物最全面和最有效的方法[10].本文将采用AMA的实验方案,对PFOS的甲状腺激素干扰效应进行检测,为PFOS的生态风险评价提供科学依据.
1 材料与方法
1.1 胚胎的获取和蝌蚪的饲养
成年非洲爪蟾购自美国Nasco公司,采用人工注射绒毛膜促性腺激素(hCG)来诱导爪蟾交配产卵,蝌蚪饲养条件如下:室温25℃,明暗周期12h/12h;自来水经活性炭和微孔过滤系统处理后进入养殖箱循环,硬度150~250mg·L-1(CaCO3),余氯低于3μg·L-1,pH 7.0~8.0,溶解氧浓度高于5mg·L-1.
1.2 暴露实验
挑选发育良好的NF51阶段蝌蚪用于实验.实验设计和数据分析均参照OECD两栖类变态实验方案[10].实验共设1个对照组和3个暴露组,每组设置4个平行.在5L的方形水培花卉缸内(20cm×20cm×18cm)加经上述方法处理过的自来水4L,每缸随机放20只NF51阶段的蝌蚪.PFOS浓度为10,50和250μg·L-1,AMA推荐优先采用流水实验方案,也可以采用静态换水实验,根据本实验室条件,本文采用半静态实验方案.实验期间不曝气,温度和光照与饲养条件相同,每天早、中和晚各喂极品七彩神仙鱼饲料(惠弘水族开发有限公司)一次,下午半换水,随蝌蚪的长大,换不同粒径的上述饲料同时逐步加大喂食量,观察蝌蚪的生长发育状况并将死亡个体及时清除.
1.3 评价指标的检测
暴露7d后,从各平行样中随机挑选5只蝌蚪,参照NF划分方式判断蝌蚪发育阶段[11],随后用2%的MS-222麻醉后,经蒸馏水冲洗后称体重(BW),让蝌蚪自然伸展,并用数码相机拍照,根据照片在Photoshop软件中测量蝌蚪的体长(SVL,即嘴到泄殖腔的长度)与后肢长(HLL).当对照组蝌蚪大部分达到NF58阶段时,将剩余的全部蝌蚪根据以上的测量方法进行第二次观测.除此之外,根据已判断的阶段,统计出对照组中蝌蚪阶段的中位数.每个平行样挑选5只该阶段蝌蚪,取其甲状腺组织按常规方法制作甲状腺组织切片.该发育阶段蝌蚪少于5只的,随机挑选该阶段上下的蝌蚪直至达到5只.
在Nikon80i光学显微镜下观察甲状腺组织结构,包括甲状腺滤泡变形、胶质减少、空泡化、增生和肥大等现象.用NikonDS-SM显微照相系统拍照,并就甲状腺滤泡数目(NOF)和滤泡变形率(IFH)做半定量分析[12].从每个样品的连续切片中,选取甲状腺横截面积最大的10片,统计每片上的甲状腺滤泡个数,以10片的平均数作为该样品的甲状腺滤泡数目.滤泡上皮细胞的排列形状出现非自然地明显弯曲时,记为滤泡变形.在计数甲状腺滤泡数目的同时计数变形的滤泡数目,滤泡变形率=变形的滤泡数目/甲状腺滤泡数目.
1.4 图像和数据的处理
图像用Photoshop7.0处理,实验数据用SPSS15.0进行统计分析.对于连续分布的指标(BW,SVL和 HLL),结果以每缸为1个平行样,数据以平均值±标准差(S.D.)表示,用Dunnett’stest检验组间数据差异性;对于非连续指标(发育阶段),用各平行样的中位数表示,用Jonckheere-Terpstra检验组间数据差异性;用OriginPro8.0作图.
2 结果与讨论
2.1 PFOS对非洲爪蟾存活和生长的影响
暴露期间,对照组和10μg·L-1PFOS暴露组蝌蚪均没有出现死亡,50μg·L-1和250μg·L-1PFOS暴露组均有3只蝌蚪死亡,存活率达96.25%.与对照组相比,7d后,暴露组蝌蚪体重和体长均无显著性变化;实验结束时,10,50和250μg·L-13个PFOS暴露组蝌蚪的体重分别增加17%,10%和20%,体长分别增加5%,4%和6%(见图1A和B).
对照组与暴露组存活率均在95℅以上,按照OECD爪蟾变态实验的标准,本实验结果可用于效应分析.同时表明,在实验浓度下PFOS对非洲爪蟾蝌蚪无明显的致死效应.从体重和体长的结果来看,7d后,PFOS对蝌蚪体长和体重没有影响,在暴露结束时能够加快蝌蚪的生长.
2.2 PFOS对非洲爪蟾后肢长和发育阶段的影响
与对照组相比,7d后,10,50和250μg·L-1三个暴露组蝌蚪的后肢长分别减小17%,11%和18%,蝌蚪的发育延缓了1~2个阶段;19d后,对照组大部分蝌蚪达到NF58阶段,参照AMA实验标准结束实验,与AMA实验相比,本文对照组蝌蚪提前了2d达到NF58阶段,最主要的原因可能是由于本文采用的是半静态实验方法,而AMA的21d是根据流水实验获得的,此外,本实验的水温较OECD的方法高2 ℃.10μg·L-1和250μg·L-1暴露组蝌蚪的后肢长分别减小12%和13%,而50μg·L-1暴露组则没有影响(见图1C),暴露组蝌蚪的发育阶段与对照组没有显著差异(见表1).
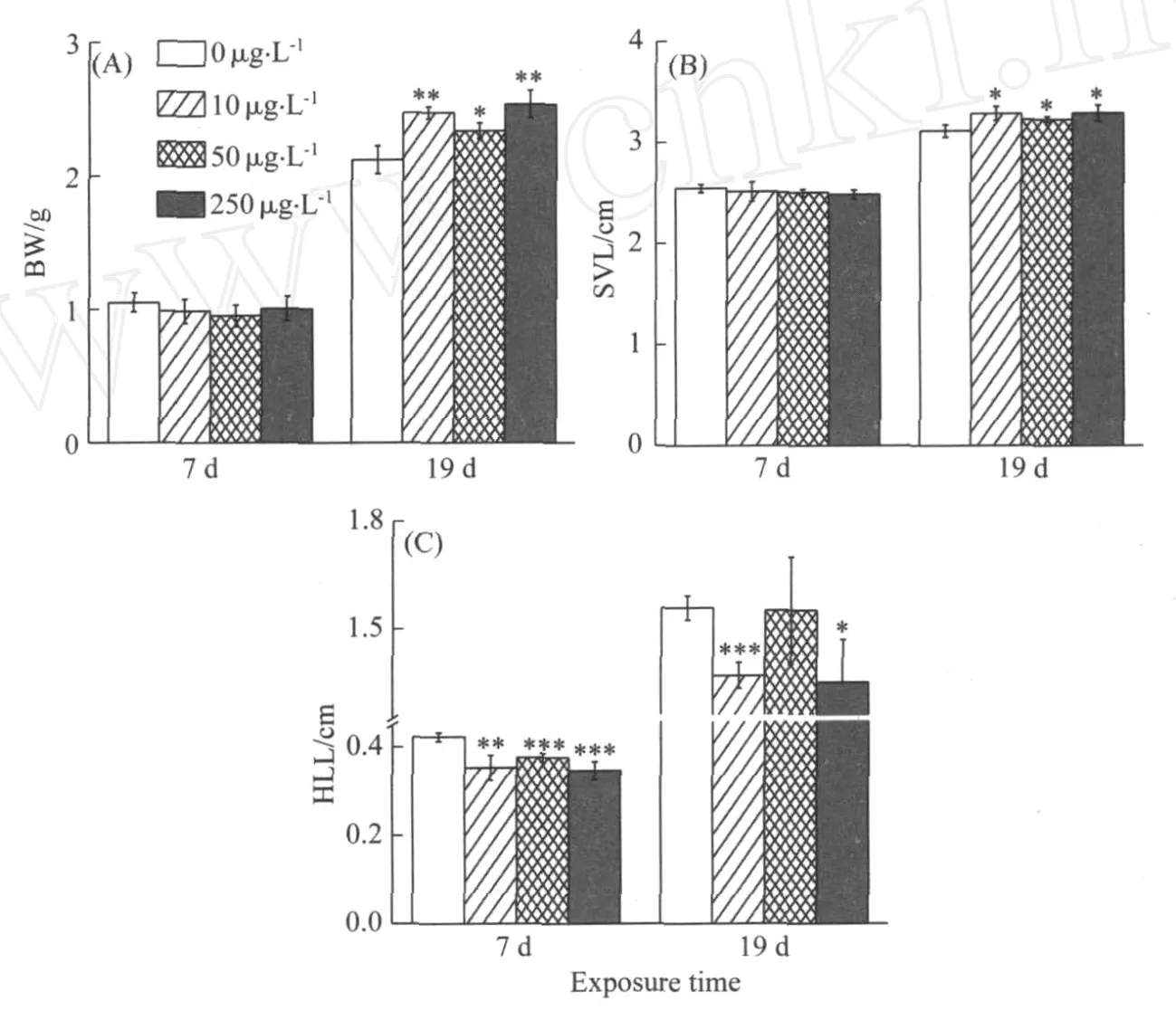
图1 PFOS对非洲爪蟾(Xenopus laevis)体重(BW)、体长(SVL)和后肢长(HLL)的影响(n=4)Fig.Effect s of PFOS on the body weight (BW) , the snout to vent length(SVL) and the hind limb length ( HLL) of Xenop us laevis ( n = 4)

表1 PFOS对非洲爪蟾(Xenopus laevis)发育阶段的影响(n=4)Tab.Effect of PFOS on the developmental stage of Xenopus laevis ( n = 4)
2.3 PFOS对非洲爪蟾甲状腺组织结构的影响
对照组爪蟾蝌蚪的甲状腺滤泡大多呈圆形或椭圆形,滤泡周围均匀分布单层的上皮细胞,细胞呈扁平状,滤泡腔内充满均匀的胶质,较少观察到滤泡的变形和胶质减少等现象(见图2A).19d后,暴露组蝌蚪甲状腺滤泡出现轻微和中等程度的变形、上皮细胞增生等现象(见图2B);在50μg·L-1暴露组甲状腺组织结构的连续切片中发现部分切片的两个滤泡界线分明,而在其它切片中这两个滤泡间的上皮细胞开始溶解,甚至消失,直至两个滤泡溶通成一个滤泡(见图2C);同时,部分滤泡出现胶质减少甚至全部消失(见图2D).与对照组相比,10μg·L-1和250μg·L-1暴露组滤泡数目显著较少(见图3A),3个暴露组滤泡变形率均显著增加(见图3B).

图2 PFOS对非洲爪蟾(Xenopuslaevis)甲状腺组织结构(H.E.染色)的影响Fig.2 Effect s of PFOS on the thyroid histology ( H. E. ) of Xenop us laevis
2.4 PFOS对非洲爪蟾的甲状腺激素干扰效应及其作用模式分析
参照OECD的AMA实验指南,判断受试物是否具有甲状腺激素干扰效应主要取决于7d和21d时后肢长(HLL)、发育阶段(NF)和甲状腺组织结构这3项指标.在发育阶段被延迟的情况下,需要综合考虑存活、生长、发育和甲状腺组织结构等多项指标[10].本文参照AMA的方法,根据所获得的实验结果对PFOS是否具有甲状腺激素干扰效应及其作用模式进行了分析(见图4).首先,本文暴露组和对照组的死亡率均低于10%,且未观察到PFOS的明显急性毒性效应,表明实验是有效的;然后,结合后肢长和发育阶段的指标,可以判断PFOS能导致蝌蚪发育延缓;同时观察到在本实验浓度下PFOS对生长具有明显的促进作用,由于影响正常发育的化合物通常会导致生长的明显加速,根据AMA的方法,PFOS对生长的促进作用可能是甲状腺激素干扰效应的表现,而甲状腺组织学结构的变化则为这一推断提供了更有力的证据.由于PFOS阻碍了蝌蚪的发育,可判断PFOS为抗甲状腺激素干扰物.
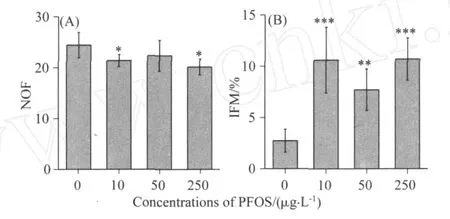
图3 PFOS对非洲爪蟾 (Xenopuslaevis)甲状腺滤泡数目(NOF)和滤泡变形率(IFM)的影响Fig.3 Effect s of PFOS on the number of follicles (NOF) and the incidence of follicle malformation ( IFM) in Xenopus laevis
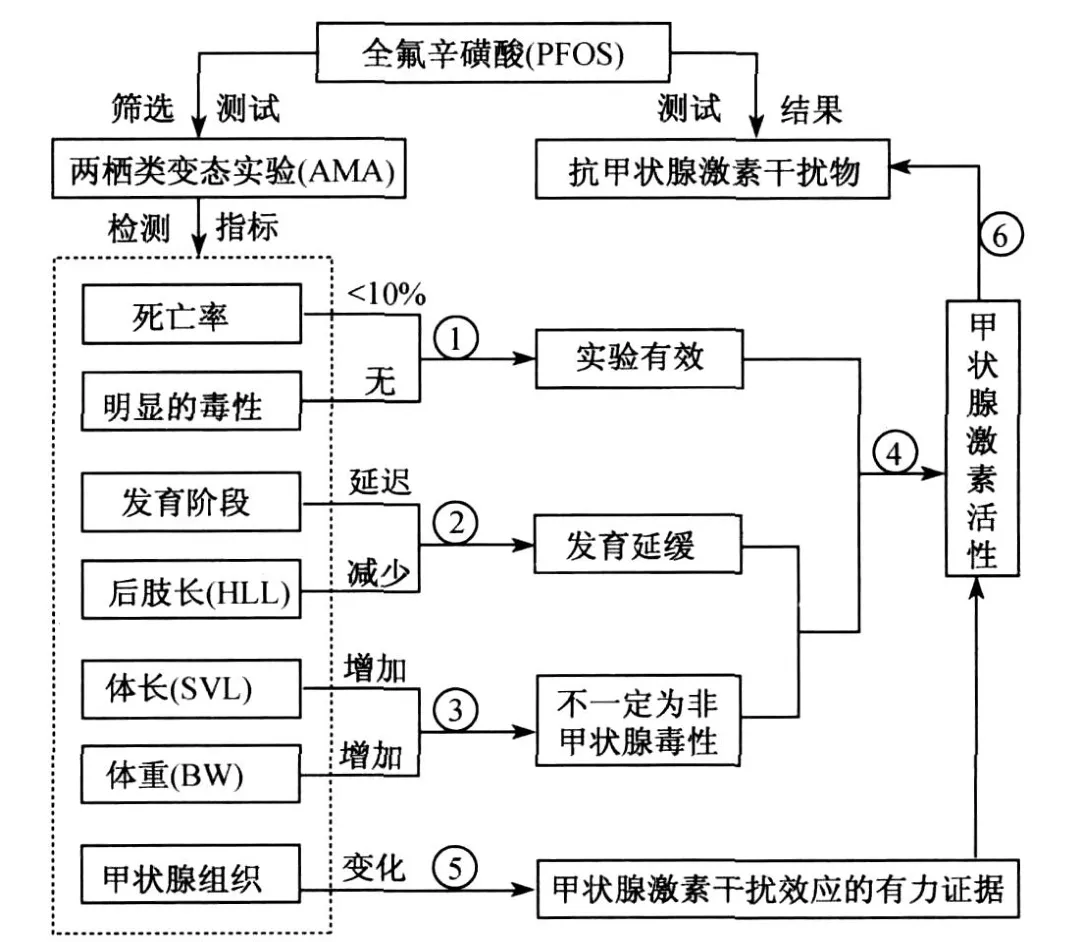
图4 运用两栖类变态实验(AMA)对PFOS甲状腺激素干扰效应的检测及其作用模式的分析Fig.4 Detection of thyroid hormone disrupting effect s and analysis of mode of action of PFOS using the amphibian metamorphosis assay (AMA)
从上述分析可知,AMA采用了多项指标,通过多个分析步骤对受测试物进行分析判断.相对于其他的实验设计[8,9],最明显的优势表现在:(1)实验有效性的控制;(2)多项指标的综合判断;(3)作用模式的解析.在本文的检测中,不仅通过合理的浓度设计和良好的实验控制确保了实验的有效性,而且发育的延缓进一步通过生长指标的变化得到了印证,二者高度一致地表征了PFOS的抗甲状腺激素特性.因此,本文通过AMA实验方法,对判断PFOS的甲状腺激素干扰效应和分析其作用模式提供了强有力的证据.
3 结 论
本文参照OECD提出的两栖类变态实验(AMA)方法,对 PFOS的甲状腺激素干扰效应进行了检测.结果表明,在本实验浓度下PFOS对于非洲爪蟾的蝌蚪生长有促进作用,对于变态发育过程却有抑制作用.参照AMA的方法,可以初步判断PFOS为抗甲状腺激素干扰物.鉴于PFOS在我国水环境中的普遍存在,同时甲状腺激素在动物生长和发育过程中的重要作用,今后应进一步加强环境浓度PFOS对水生动物的甲状腺激素干扰效应评估.而且,AMA作为筛选甲状腺激素干扰物的有效方法,可以考虑在我国推广和使用.
[1] 金一和,刘晓,秦红梅,等.我国部分地区自来水和不同水体中的PFOS污染 [J].中国环境科学,2004,24:166-169.
J IN Y H , LIU X , QIN H M , et al . The status quo of perfluorooctane sulfonate ( PFOS) pollution in tap water anddifferent waters in partial areas of China [J ] . China Environmental Science , 2004 , 24 : 166-169.
[2] SO M K, MIYA KE Y, YEUNG W Y, et al . Perfluorinated compounds in t he Pearl River and Yangtze River ofChina [J ] . Chemosphere , 2007 , 68 : 2085-2095.
[3] LIU W , J IN Y H , QUAN X , et al . Perfluorosulfonates and perfluorocarboxylates in snow and rain in Dalian ,China [J ] . Environment International , 2009 , 35 (4) : 737-742.
[4] J ENSEN A A , L EFFERS H. Emerging endocrine disrupters : perfluoroalkylated substances [ J ] . InternationalJournal of Andrology , 2008 , 31 : 161-169.
[5] YU W G, LIU W , J IN Y H. Effect s of perfluorooctane sulfonate on rat t hyroid hormone biosynt hesis and metabolism[J ] . Environmental Toxicology and Chemist ry , 2009 , 28 (5) : 990-996.
[6] CHANG S C , THIBODEAUX J R , EASTVOLD M L , et al . Thyroid hormone status and pituitary function in adultrat s given oral doses of perfluorooctanesulfonate ( PFOS) [J ] . Toxicology , 2008 , 243 : 330-339.
CHANG S C , EHRESMAN D J , BJORK J A , et al . Gestational and lactational exposure to potassium perfluorooctanesulfonate( K+ PFOS) in rat s : toxicokinetics , t hyroid hormone status , and related gene expression [J ] .Reproductive Toxicology , 2009 , 27 : 387-399.
[8] AN KL EY G T , KUEHL D W, KAHL M D , et al . Partial life-cycle toxicity and bioconcent ration modeling of perfluorooctanesulfonate in t he nort hern leopard f rog ( Rana pi piens) [J ] . Environmental Toxicology and Chemist ry ,2004 , 23 : 2745-2755.
[9] 刘青坡,钱丽娟,郭素珍,等.全氟辛磺酸(PFOS)对非洲爪蟾(Xenopuslaevis)生长发育、甲状腺和性腺组织学的影响[J].生态毒理学报,2008(3):464-472.
LIU Q P , QIAN L J , GUO S Z , et al . Effect s of perfluorooctanesulfonate on t he growt h , metamorphosis , t hyroidand gonadal histology of Xenopus laevis [J ] . Asian Journal of Ecotoxicology , 2008 , 3 (5) : 464-472.
[10] OECD. OECD guideline for t he testing of chemical s : t he Amphibian Metamorphosis Assay[ EB/ OL ] . (2008-3-11)[2009-06-21 ] .http://www.oecd.org/dataoecd/32/63/41620749.pdf.
[11] NIEUWKOP P D , FABER J . Normal Table of Xenopus laevis ( Daudin) [M] . New York : Garland Science Publishing, 1994.
[12] 王蕾,刘青坡,郭素珍,等.三丁基锡对非洲爪蟾甲状腺组织结构的影响[J].华东师范大学学报(自然科学版),2008(6):75-81.
WANG L , LIU Q P , GUO S Z , et al . Effect s of t ributyltin on t hyroid histology of Xenopus laevis [J ] . Journal ofEast China Normal University (Natural Science) , 2008 (6) : 75-81.
Thyroid disrupting effects of perfluorooctane sulfonateon Xenopus l aevis
LIU Jun-qi, LIU Qing-po, CAO Qing-zhen,QIAN Li-juan, GUO Su-zhen, SHI Hua-hong
(Department of Envi ronment Science , S hanghai Key L aboratory of Urbani z ation Processes and EcologicalRestoration , East China N ormal Universit y , S hanghai 200062 , China)
The amphibian metamorphosis assay (AMA) was used to detect thyroid disruptingeffect s of perfluorooctane sulfonate ( PFOS) . Xenopus laevis tadpoles at stage 51 were exposed to 10 , 50 and 250μg·L-1PFOS.PFOS. The growth , metamorphosis and thyroid histology were observed.Af ter 7 days of exposure , the hind limb lengths were decreased by 11 %~18 % , and 1 or 2 developmental stages were delayed in t reatment groups compared with the cont rol. After 19 days of exposure , the body weight s were increased by 10 %~20 % , the body lengths were increasedby 4 %~6 % , and the hind limb lengths were decreased by 12 %~ 13 % in t reatment group s. PFOS decreased the number of thyroid follicles , in which cell hyperplasia , colloid depletion and vacuolation were observed. These result s suggested that PFOS inhibited the development and increased the growth of X laevis . According to AMA , our result s indicated that PFOS was an anti-thyroid hormone disrupting chemical.
thyroid disrupting chemicals ( TDCs) ; Xenopus laevis ; perfluorooctane sulfonate( PFOS) ; amphibian metamorphosis assay (AMA)
Q948
A
1000-5641(2010)04-0118-07
2009-06
国家自然科学基金(20877023);上海市自然科学基金(08ZR1406900);上海市城市化过程与生态恢复重点实验室开放基金(UPER0606);长江水环境教育部重点实验室开放基金(YRWEF06003)
刘俊奇,女,硕士研究生.
施华宏,男,副教授,研究方向为生态毒理学.E-mail:hhshi@des.ecnu.edu.cn.

