隐睾下降固定术后生殖细胞的凋亡及 e NOS和i NOS的表达
石金凤 莫中成 谢远杰 黄欣琼 李美香 龙治峰 贺丽萍
目前对隐睾患者的治疗方案主要是尽早行隐睾固定术,但手术并不能使所有的隐睾患者完全恢复正常的生育能力。男性隐睾症患者和实验性动物隐睾模型中,生精细胞大量凋亡造成雄性个体生殖力下降[1]。已有研究表明一氧化氮(NO)是使实验性隐睾生精细胞过度凋亡的重要物质,为了进一步阐明隐睾复位后不育的机理,本实验通过建立大鼠隐睾下降固定模型,观察生精细胞凋亡情况与一氧化氮合酶(NOS)表达的变化,为从 NO途径治疗由生精细胞凋亡导致的不育和提高隐睾患者术后生育力提供实验依据。
材料与方法
一、动物模型的建立
45只健康雄性 SD大鼠(22日龄)随机分为隐睾组(30只)和假手术组(15只)。按参考文献[2]方法建立右侧隐睾模型:戊巴比妥钠腹腔内注射麻醉,下腹正中切口,隐睾组大鼠切断右侧睾丸引带,用 7-0无创伤线将右侧睾丸固定于腹后壁关腹;假手术组是将右侧睾丸切断引带后还纳入阴囊关腹。术后 12天将隐睾组大鼠随机均分为隐睾对照组和隐睾固定组,隐睾对照组不做处理,隐睾固定模型建立按参考文献[3]操作。术后第 24天脱颈椎处死大鼠,取血清于 -80℃冻存,硝酸还原酶法测定血清 NO含量,化学比色法测血清 NOS活性,原位末端标记法(TUNEL)结合流式细胞术(FCM)检测 3组大鼠右侧睾丸生精细胞凋亡情况,Western blot和免疫组化分别检测内皮型NOS(eNOS)、诱导型 NOS(iNOS)蛋白表达的变化。
二、试剂及仪器
兔抗鼠 eNOS IgG、兔抗鼠 iNOS IgG、SABC免疫组化试剂盒及细胞凋亡检测试剂盒均由武汉博士德公司生产;NO检测试剂盒、NOS检测试剂盒由南京建成生物工程公司生产;流式细胞仪(EPICS-XL)为美国 Beckman-Coulter公司产品。
三、实验方法
1.NO含量及 NOS活性检测 用硝酸还原酶法检测血清 NO含量,采用化学比色法测定睾丸组织中NOS活性,操作方法按试剂盒说明书进行。
2.生精细胞凋亡检测及 DNA分析 ①TUNEL法检测生精细胞凋亡:取各组大鼠右侧睾丸组织石蜡包埋切片后按照试剂盒说明书操作,光镜下胞核着棕黄色者为阳性细胞,即凋亡细胞;阳性对照是已知有大量凋亡细胞的小肠切片(由公司提供);阴性空白对照未加 TUNEL反应液。每个睾丸组织切片观察10个生精小管横断面,平均每个生精小管横断面的凋亡细胞数即为凋亡指数(AI)[4]。②流式细胞术测定生精细胞凋亡:每组取 6份 0.25cm×0.25cm大小右侧睾丸组织置于培养皿上的 240目不锈钢筛网内,用眼科组织剪将睾丸组织剪碎,用注射器的针芯轻搓组织块,边搓边滴加生理盐水,直到组织搓完,收集细胞悬液,离心(1000r/min×8min),70%乙醇固定制成单细胞悬液,处理后上机分析。
3.Western blot和免疫组化 SABC法检测 eNOS、iNOS蛋白 将 3组大鼠右侧睾丸组织裂解,提取组织蛋白,BCA试剂测定总蛋白含量,β-actin作为内对照,蛋白样品经 SDS-PAGE,电泳结束后转膜、抗体结合,荧光显影,扫描分析。取 3组大鼠右侧睾丸组织按照免疫组化 SABC试剂盒说明书操作,检测eNOS、iNOS蛋白含量,阴性对照用磷酸缓冲液代替一抗,含这两种蛋白的细胞应呈棕黄色。
四、数据处理
计量资料均采用均数 ±标准差表示,应用SPSS10.0统计软件对组间均数进行单因素方差分析。
结 果
一、NO含量及 NOS活性检测
隐睾对照组的血清 NO浓度(80.98±4.01μmol/L)、NOS活性(45.81±1.65 U/ml)明显高于隐睾固定组(60.59±4.33μmol/L、27.62±0.56 U/ml)和假手术组(38.70±5.65μmol/L、16.53±0.26 U/ml),P<0.01;而隐睾固定组这两个指标又高于假手术组(P<0.05)。
二、TUNEL法对生精细胞凋亡的检测
如图 1所示,3组睾丸内均可见到胞核为棕黄色凋亡的生精细胞,包括初级精母细胞和精原细胞,未见支持细胞呈阳性反应。隐睾对照组睾丸生精小管内出现大量凋亡细胞,凋亡指数(29.37±1.02)明显高于隐睾固定组(14.58±2.98)和假手术组(2.06±1.02),P<0.01;隐睾固定组则明显小于假手术组(P<0.05)。
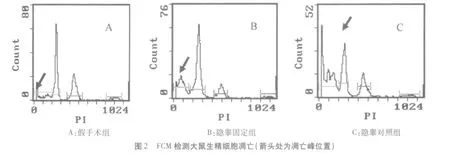
三、FCM检测大鼠睾丸生精细胞凋亡
如图 2所示,3组大鼠生精细胞在 G1期前端均出现了一个称之为凋亡峰的亚倍体峰,显示各组大鼠右侧睾丸细胞凋亡率假手术组为(7.25±1.02)%,隐睾固定组为(23.56±3.42)%,均明显低于隐睾对照组(32.98±3.41)%,P<0.05;而假手术组又低于隐睾固定组(P<0.05)。
四、免疫组化检测 eNOS、iNOS蛋白表达
免疫组化结果显示,3组大鼠右侧睾丸间质细胞及血管内皮和平滑肌细胞内均有 eNOS表达(图 3A,B),假手术组睾丸生精上皮仅见 eNOS的弱表达,隐睾固定组右侧睾丸生精上皮中有较强的 eNOS表达,以初级精母细胞为主。各组大鼠右侧睾丸间质细胞均有 iNOS表达,而血管内皮和平滑肌细胞均无 iNOS表达(图 3C,D),假手术组右侧睾丸生精上皮可见iNOS的弱表达,隐睾固定组右侧睾丸生精上皮中可见到较强的 iNOS表达。


五 、Western blot检测 eNOS、iNOS蛋白表达
如图 4所示,隐睾固定组 eNOS、iNOS蛋白表达量均增高,约分别为假手术组的 2.4倍(P<0.01)、3.3倍(P<0.01),隐睾固定组和假手术组表达均无差别(P>0.05)。

讨 论
本实验通过 SD雄性大鼠手术建立右侧隐睾模型,术后 12天再建立隐睾下降固定模型。隐睾模型大鼠手术侧睾丸内生精上皮变薄,生精细胞排列紊乱,生精细胞凋亡明显增加;隐睾固定模型,大鼠手术侧睾丸生精小管内生精细胞排列有序,凋亡的生精细胞减少;假手术组睾丸生精小管内可见到各级生精细胞且细胞排列有序,只见散在的少量凋亡生精细胞。说明实验性隐睾导致了生精细胞的大量凋亡,隐睾下降固定能明显减少生精细胞凋亡,促进生精功能的改善,但在隐睾下降固定后的短时间内比正常睾丸生精细胞凋亡率高。Matsuki等[5]研究发现高位型隐睾固定术患者的睾丸活检均为重度受损,双侧隐睾即使早期治疗,不育率仍超过 60%,单侧隐睾不育率达25%[6]。因此,隐睾会使睾丸生精细胞凋亡增加,隐睾下降固定能通过减少生精细胞凋亡而改善生精功能,部分隐睾固定术后仍不能完全恢复生育能力可能与生精细胞凋亡仍较正常睾丸高有关。
NOS是由两个分子量为 130-160kDa的相同单体组成的同型二聚体,在体内有 eNOS、神经 NOS型(nNOS)和 iNOS 3种同工酶,能催化左旋精氨酸脱胍基产生信使分子 NO和左旋瓜氨酸。NO脂溶性很强,极易通过生物膜作用于各种靶细胞,激活可溶性鸟苷酸环化酶(sGC),导致细胞内环鸟苷酸(cGMP)水平升高而发挥信使和效应分子的作用。NO的作用效应是双向的,低浓度 NO对很多组织器官起保护作用,而高浓度 NO作为一种活性氧类,除了可直接损伤 DNA、上调 p53等凋亡相关基因表达、介导细胞凋亡外[7],也可以通过与呼吸链中的铁硫键结合,导致呼吸链受损,产生活性氧,进一步损伤线粒体,同时使线粒体跨膜电位降低,钙泵活性丧失,胞质钙离子浓度显著增加,线粒体膜通透性转换孔形成,释放细胞凋亡诱导因子如细胞色素 C和凋亡蛋白酶活化因子 -1,促进细胞凋亡[8]。
NOS广泛存在于睾丸、附睾、输精管等组织中[9]。在对实验性大鼠隐睾的研究中发现,隐睾组织中 NO浓度较对侧睾丸显著增高,此时隐睾生精细胞的 AI较对侧高出 2.4倍[10],说明 NO浓度升高可能是隐睾睾丸生精细胞凋亡增加的重要原因。同时发现隐睾组织中 NOS活性显著增加,而且 NOS升高与睾丸生精细胞的凋亡呈正相关。本实验研究结果表明:隐睾对照组血清中 NO浓度、NOS活性以及生精细胞凋亡率最高,隐睾固定组则高于假手术组。Western blot检测发现隐睾固定组中 eNOS和 iNOS含量高于假手术组,免疫组化结果显示在假手术组睾丸生精上皮中仅有 eNOS和 iNOS的弱表达,而在隐睾固定组生精上皮中两者均有较强表达,说明隐睾中NOS活性增加,NO产生增多,凋亡增加,下降固定后NOS活性降低但仍比正常高,睾丸内 eNOS及 iNOS基因表达增加。本实验结合文献说明,尽管隐睾固定后 NO的产生较隐睾时低,但 NO浓度及 eNOS和 iNOS基因表达仍较正常高,局部高浓度的 NO是导致生精细胞仍然过度凋亡的重要原因。这为临床隐睾患者术后生育力的研究提供了新的实验依据。
1 Yin Y,Hawkins KL,Dewolf WC,et al.Heat stress causes testicular germ cell apoptosis in adult mice.J Andrology,1997,18(2):159 ~165.
2 赖琼,贺丽萍,谢远杰,等.p 38MAPK在 SD大鼠隐睾中的表达.中国计划生育学杂志,2004,12(11):735~737.
3 郑航,郑新民,李世文,等.大鼠隐睾、隐睾下降固定对生殖细胞发育、凋亡的实验研究.中华小儿外科杂志,2002,23(4):253~255.
4 Young KA,Zirkin BR,Nelson RJ.Testicular regression in response to food restriction and short photoperiod in white-footed miceis mediated by apoptosis.Biol Reprod,2000,62(2):347~ 354.
5 Matsuki S,Iushi Y,Ikeda Y,et al.Suppression of cytochrome c release and apoptosis in testes with heat stress by minocycline.Biolchem Biophys Res Commun,2003,312(3):843~ 849.
6 Hikim AP,Lue Y,Yamamoto CM,et al.Key Apoptotic Pathways for Heat-Induced Programmed Germ Cell Death in the Testis.Endocrinology,2003,144(7):3167~ 3175.
7 李正,王慧贞,吉士俊.实用小儿外科学.人民卫生出版社,2001:1.
8 Lue YH,Hikim AP,Swerdloff RS,et al.Singleexposure to heat induces stage specific germ cell apoptosis in rats:Role of intratesticular testosterone on stage specificity.Endocrinology,1999,140(4):1709~ 1717.
9 Burnett AL,Ricker DD,Tillman SL,et al.Localization of Nitric Oxide Synthase in the reproductive organs of the male rat.Biol Reprod,1995,52(1):1~7.
10 El-Gohary M,Awara WM,Hassar S,et al.Deltamethrin-induced testicular apoptosisin rats:the protective effect of nitricoxide synthase inhibitor.Toxicology,1999,132(1):128.

