羟基加成反应对A-T碱基对结构和质子转移过程的影响
史俊友 董丽花 刘永军
(1中国科学院西北高原生物研究所,西宁 810001;2中国科学院研究生院,北京 100049)
羟基加成反应对A-T碱基对结构和质子转移过程的影响
史俊友1,2,*董丽花1,2刘永军1
(1中国科学院西北高原生物研究所,西宁 810001;2中国科学院研究生院,北京 100049)
应用密度泛函理论在B3LYP/6-31++G(d,p)//B3LYP/6-31G(d,p)水平上对羟基化碱基对A-T的结构进行了研究,经计算共得到8种稳定的羟基化加成产物,其能量的相对顺序为8OHA-T<A-T6OH<A-T5OH<2OHA-T<4OHA-T<5OHA-T<A-T2OH<A-T4OH(数字表示羟基加成进攻的原子在腺嘌呤或胸腺嘧啶中的编号),这与其加成反应前后结构变化的大小密切相关.当羟基对腺嘌呤端进行加成时,A-T间的相互作用能略有增加,而当羟基对胸腺嘧啶进行加成时,A-T之间的相互作用能略有减小.另外,还以能量较低的加成产物8OHA-T和A-T6OH为例对羟基化碱基对中A和T之间的质子转移过程进行了研究,结果表明羟基化产物中A与T之间的质子转移机理由未加成前的分步双质子转移变为协同双质子转移,且其势垒低于未加成的A-T发生第一步(决速步骤)质子转移的势垒.
密度泛函理论;碱基对;羟基化;质子转移;单电子占据轨道
在DNA的双螺旋结构中,各个碱基之间通过氢键相互作用以A-T(腺嘌呤-胸腺嘧啶)或G-C(鸟嘌呤-胞嘧啶)的方式进行配对.由于受环境因素的影响,这些碱基对之间的结合能力可能会发生变化,甚至诱发突变.生物体系内的水分子经紫外线辐射或细胞的正常代谢后可分解产生活性基团如H·、等.这些活性基团可与核苷作用导致DNA发生一系列的变化,如单、双螺旋链结构的变化,碱基对间的错配,突变等.由于这些自由基与核苷的反应具有严重的破坏性,其反应机理已经受到人们的密切关注.
人们通过实验及理论研究发现·OH与DNA中的嘧啶(胸腺嘧啶或胞嘧啶)及嘌呤(腺嘌呤或鸟嘌呤)发生加成反应,且其相关产物已得到分离和鉴定[1-2].·OH与嘧啶的加成反应主要发生在C5及C6位,其中C5位的加成产物具有还原性,C6位的加成产物具有氧化性;·OH与嘌呤的加成反应可发生在C2、C4、C5、C8等位置,其产物中氧化性和还原性物质呈等量关系[3-5].这些加成产物仍比较活泼,不但可与其它生物分子发生反应,还可发生分子内的开环反应、分子内及分子间的抽氢反应等[5-6].通常情况下,核酸中的嘌呤和嘧啶主要以氨基和酮类的形式通过分子间氢键进行配对,但在少数情况下,嘌呤和嘧啶也以亚氨基和烯醇的形式存在(图1).后一种情况的发生是由于嘌呤与嘧啶之间发生了质子转移[7-9];它所占比例虽然很小,却可以诱发基因突变,改变遗传密码[10].
为探讨碱基对之间的质子转移及其在基因突变中的作用,人们开展了许多相关的实验及理论研究.结果表明G-C间的质子转移遵循协同双质子转移机理[11],但对于碱基对A-T间的质子转移机理,人们得到的结论并不完全一致,如Floribn[12]和Gorb[13]等认为碱基对A-T间的质子转移机理为协同双质子转移,而近期Kryachk等[14]和Villani[15]的研究发现A-T间的质子转移为分步质子转移.在分步质子转移中,首先胸腺嘧啶的H8由N3转移到腺嘌呤的N1上,形成离子型中间体A-T',然后腺嘌呤N10上的氢原子转移到胸腺嘧啶的O9上形成A'T'(图1); Kryachk等[14]在HF/6-31+g(d)水平上计算得到的分步质子转移的能垒分别为70.26和37.22 kJ·mol-1.
活性自由基与碱基相互作用的研究引起了人们的极大关注[119],但由于这些自由基活性较高,采用实验方法对其研究具有较大的局限性,于是人们采用多种理论方法对羟基与单个碱基的相互作用进行了较为深入的研究,但对于羟基与碱基对之间的相互作用及其对碱基对之间质子转移过程影响的研究还相对较少.Zhang等[20]用密度泛函方法研究了羟基自由基与G-C碱基对的加成反应及碱基之间的质子转移过程,他们发现羟基加成对于G与C之间的相互作用有轻微的影响,但加成位置对G与C之间的质子转移势垒有不同的影响.到目前为止,对于羟基自由基与碱基对A-T之间的加成反应尚未见文献报道.因此本文用密度泛函理论[21-22]对羟基加成后碱基对的结构变化以及A-T间的质子转移过程进行了研究,以期加深对DNA损伤和修复过程的理解.
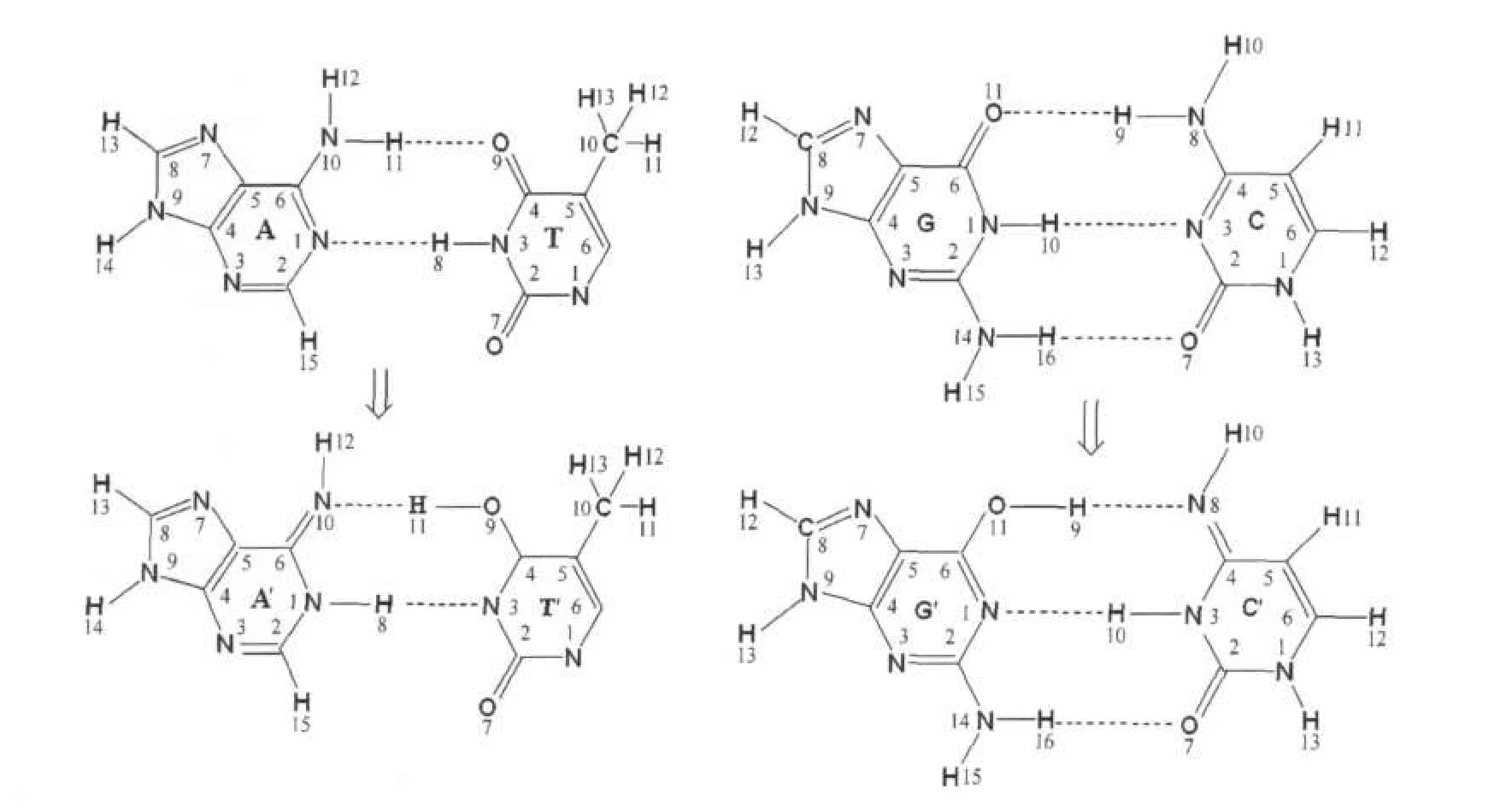
图1 碱基对A-T和G-C及其质子转移产物的原子编号标注示意图Fig.1 Atom numbering scheme ofA-T and G-C base pairs and their proton transfer products
1 计算方法
因本文研究体系涉及到较多的氢键相互作用,我们采用已被证明对氢键体系十分有效的B3LYP方法[23-24]在6-31G(d,p)水平上对可能的羟基化产物及其质子转移过程涉及到的各驻点的构型进行了全优化,并通过频率计算加以确认;所有的局域最小点没有虚频,而相应的过渡态只有一个虚频;过渡态还通过内禀反应坐标(IRC)加以确认,自然布居通过自然键轨道分析(NBO)得到.为使计算过程中所涉及的复合物、过渡态及产物的能量更加准确,在B3LYP/6-31++G(d,p)水平上对各优化构型进行了单点计算,下文中提到的能量都是指B3LYP/ 6-31++G(d,p)单点计算后所得到的能量(包含零点能校正).全部计算采用Gaussian 03程序包[25]完成.
为从本质上阐述A-T碱基对之间质子转移势垒变化的原因,本文还计算了有关羟基化碱基的质子亲和势(PA)与去质子焓(DPE).
对于质子化过程:B+H+→BH+
反应的吉布斯自由能变化通过下式计算:
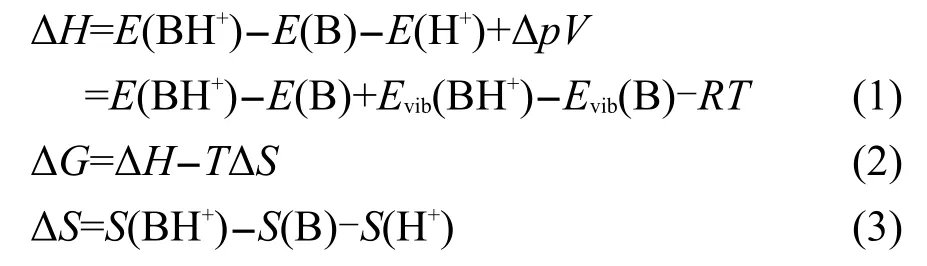
其中E(i)、Evib(i)和S(i)分别代表各物种i的总能量、零点振动能及熵;T和R分别为物质的绝对温度及气体常数;质子亲和势PA为吉布斯自由能变化(ΔG)的负值.对于质子化过程来说,PA的值越大,则该碱的碱性越强.
对于去质子化过程:BH→B-+H+
其焓变计算公式与式(1)相似:
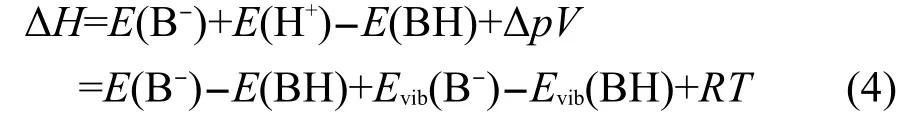
去质子焓DPE为该过程函变(ΔH)的负值.一般情况下,去质子焓越小表明该物质(BH)的酸性越强.
本文中所涉及的原子编号始终与图1中A-T的编号一致.依据羟基加成位置的不同本文将·OH与A-T的加成产物命名为MOHA-T或A-TNOH,前者代表羟基加成到腺嘌呤上,后者代表羟基加成到胸腺嘧啶上,M和N分别代表羟基加成进攻的原子在腺嘌呤和胸腺嘧啶中的编号,MOHA-T(Ts/P)和A-TNOH(Ts/ P)分别代表质子转移过程的过渡态或转移后的产物.
2 结果与讨论
2.1 加成产物的结构
对A-T碱基对中所有可能与·OH发生加成反应的不饱和原子进行了尝试,包括腺嘌呤(A)中的2-8位原子,胸腺嘧啶(T)中的2-6位原子.经计算得到了8种稳定的加成产物,分别是2OHA-T、4OHA-T、5OHA-T、8OHA-T、A-T2OH、A-T4OH、A-T5OH和A-T6OH.
表1中列出了羟基氧原子与被加成原子所形成键的键长及相关原子上的电子自旋密度.可以看出,羟基氧原子上的电子自旋密度都很小,表明其单电子已经转移到被加成碱基上;羟基与被加成原子形成了稳定的化学键,键长在0.1398-0.1445 nm之间.
表2列出了8种羟基化产物的总能量和相对能量,其中8OHA-T的能量最低,A-T4OH能量最高,其能量由低到高的顺序为8OHA-T<A-T6OH<A-T5OH<2OHA-T<4OHA-T<5OHA-T<A-T2OH<A-T4OH.在腺嘌呤端的4种加成产物中,8OHA-T的能量最低,2OHA-T次之,而4OHA-T和5OHA-T的能量较高.在胸腺嘧啶端的4种产物中, A-T6OH的能量最低,A-T5OH次之;而A-T2OH与A-T4OH能量相当高,它们分别比8OHA-T的能量高144.42和153.20 kJ·mol-1,这与在溶液中未得到A-T2OH和A-T4OH的实验结果[3-5]相一致.由于羟基的加成位置对产物的稳定性有较大的影响,我们对腺嘌呤和胸腺嘧啶加成产物的结构分别进行了讨论.

表1 羟基化碱基对中相关原子的电子自旋密度及X—OH的键长Table 1 Electron spin density of related atoms and bond length of X—OH for hydroxylated base pairs
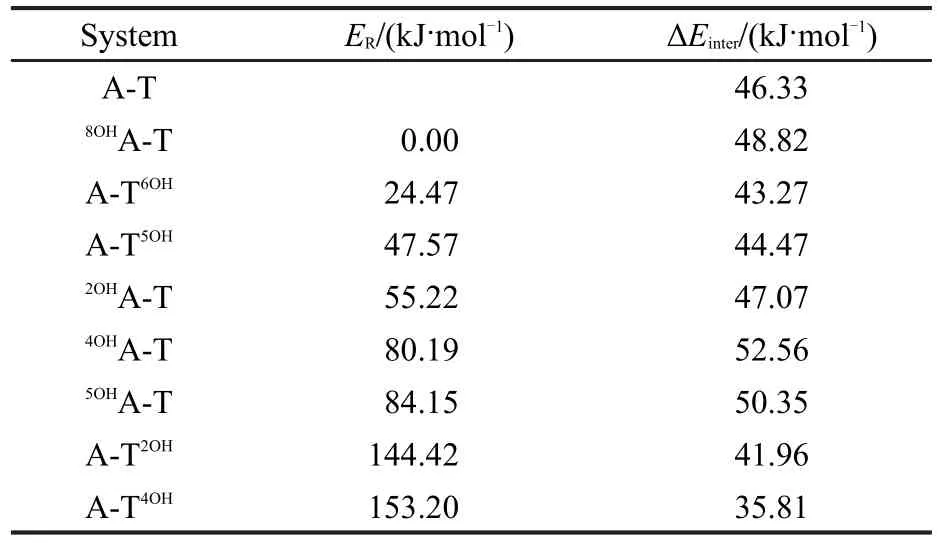
表2 羟基化碱基对A-T的相对能量(ER)及相应碱基间的相互作用能(ΔEinter)Table 2 Relative energies(ER)of hydroxylatedA-T and interaction energies(ΔEinter)between related bases
2.1.1 腺嘌呤端的加成产物
图2列出了4种腺嘌呤端加成产物的结构.8OHA-T是·OH与腺嘌呤的C8加成反应的产物,其能量在·OH与腺嘌呤端的加成产物中最低.当·OH进攻C8时,C8的杂化方式由sp2转化为sp3,C8与N7间的距离由0.1310 nm增长到0.1459 nm,即C8与N7间的化学键由双键变为单键.在8OHA-T中,尽管C8上的氢原子向嘌呤环外发生扭曲,但嘌呤环的整体构型改变很小,仍基本保持Cs对称性.2OHA-T的情况与8OHA-T类似,腺嘌呤部分的结构变化不大,基本保持Cs对称性.而在4OHA-T和5OHA-T中,由于桥连碳原子C4和C5的杂化方式由sp2转化为sp3,嘌呤环结构变化较大,五元环与六元环间呈蝶形扭曲.
羟基与腺嘌呤发生加成后,碱基对A-T间的氢键键长稍有变化.在8OHA-T、2OHA-T、4OHA-T和5OHA-T中,氢键N10—H11…O9较A-T(氢键为0.1930 nm)中分别缩短了0.0020、-0.0013、0.0030和0.0019 nm,氢键N3—H8…N1基本未变,其相应的相互作用能分别增加了2.49、0.74、6.23和4.02 kJ·mol-1(表2).这说明羟基对腺嘌呤C8、C2、C4和C5的加成对A-T间的氢键有增强作用.
2.1.2 胸腺嘧啶端的加成产物
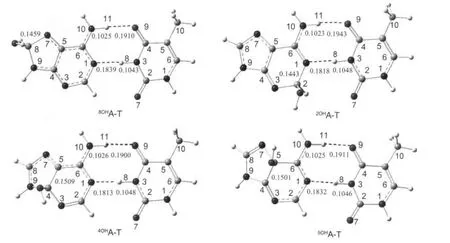
图2 B3LYP/6-31G(d,p)水平上优化得出的四种MOHA-T的相关构型Fig.2 Four structures ofMOHA-T optimized at the B3LYP/6-31G(d,p)levelThe unit of bond length in this figure and the following figures is nm.

图3 B3LYP/6-31G(d,p)水平上优化得出的四种A-TNOH的构型Fig.3 Four structures ofA-TNOHoptimizedat the B3LYP/6-31G(d,p)level
图3为胸腺嘧啶端加成产物的结构.在A-T5OH的胸腺嘧啶端,C5的杂化方式由sp2转化为sp3,C5与C6间的距离由0.1364 nm增长到0.1489 nm,二面角C2—N3—C4—C5与C2—N1—C6—C5分别由0°增加到10.67°和22.63°,表明C5已经脱离嘧啶环所在平面.而二面角N1—C2—N3—C4和C6—N1—C2—N3仅为4.32°和0.51°,表明胸腺嘧啶环中的其它五个原子仍基本保持共平面.A-T6OH与A-T5OH类似,C6脱离原嘧啶环所在平面,其它五个原子仍基本保持共平面,这说明A-T5OH与A-T6OH中的碱基T的结构变化较小.当羟基与胸腺嘧啶的C2与C4加成时引起碱基T的结构变化较大.在A-T2OH和A-T4OH中,C2与C4脱离嘧啶环所在的面,而O7与O9向面的另一侧扭曲,其中C2—O7和C4—O9间的距离分别由0.1220和0.1235 nm增长到0.1323和0.1381 nm.在A-T4OH中,由于腺嘌呤中氨基与已扭曲的O9之间的氢键相互作用,导致嘌呤环和嘧啶环由共面变为异面,这可能导致DNA链的扭曲.
在A-T5OH、A-T6OH、A-T2OH和A-T4OH中,氢键N10—H11…O9较 在 A-T中 分 别 变 化 了 0.0033、0.0029、-0.0015和0.0067 nm,氢键N3—H8…N1的键长分别增长了0.0000、0.0009、0.0062和0.0051 nm,相应的相互作用能分别降低了1.86、3.06、4.37、10.52 kJ·mol-1.这表明羟基对胸腺嘧啶C5、C6、C2和C4的加成对A-T间的氢键有削弱作用.
通过分析8种加成产物的构型与能量发现,当加成产物的结构在A-T基础上变化较大时,其能量较高,反之能量较低.当A发生羟基化时,碱基间的相互作用增强,而T发生羟基化时,相互作用减弱.
2.1.3 A-T羟基加成产物的电子结构
图4列出了羟基与单个碱基和碱基对加合时产物的单电子占据轨道(SOMO)的能量值.与各单体加成产物的单电子占据轨道比较,碱基对A-T加成产物的单电子占据轨道能量普遍增高.复合物4OHA-T、5OHA-T及8OHA-T中单电子轨道的能量分别升高了0.003、0.006和0.005 a.u.,而2OHA-T的单电子轨道能量基本不变.A-T2OH、A-T4OH、A-T5OH和A-T6OH中的单电子占据轨道能量分别升高了0.032、0.010、 0.007和0.027 a.u..在腺嘌呤的四种加成产物中,5OHA-T的单电子轨道能量较高,易失去电子,其还原性较强.与之相反,2OHA-T和4OHA-T单电子轨道能量较低,易得到电子,具有较强的氧化性.胸腺嘧啶的四种加成产物中,A-T5OH的单电子占据轨道能量较高,具有较强的还原性;A-T2OH和A-T6OH的单电子占据轨道能量较低,氧化性较强,这与文献报道的结果[16]一致.
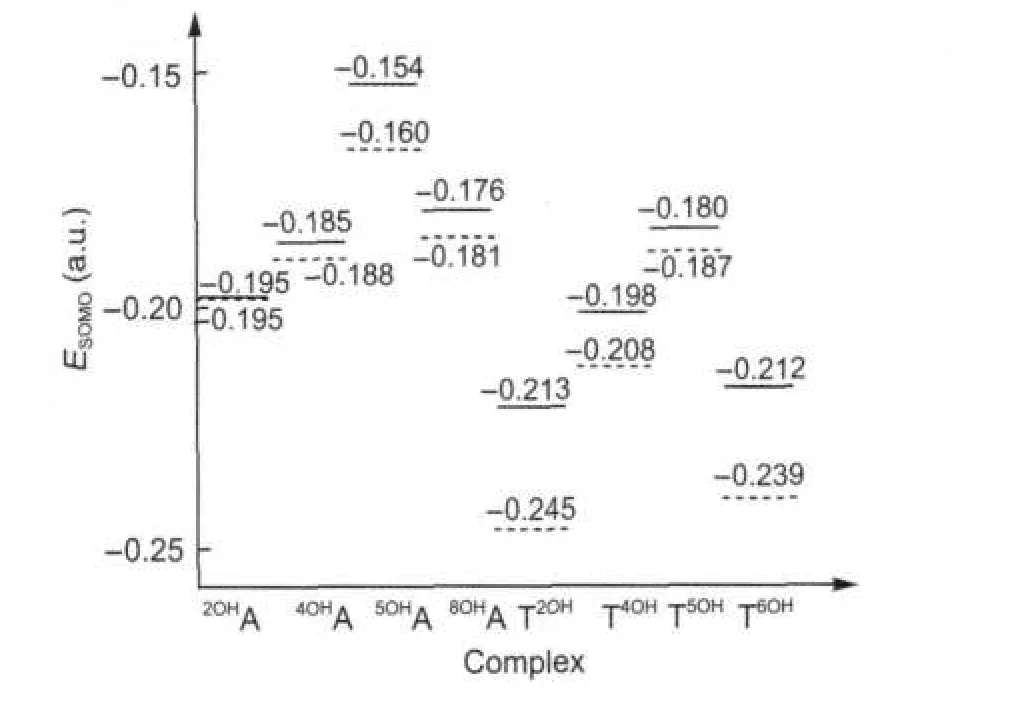
图4 羟基化碱基单体OH-A/T(虚线)与相应的羟基化碱基对OH-A/T(实线)的单电子占据轨道(SOMO)的能量Fig.4 Singly occupied molecular orbital(SOMO) energies of monomers OH-A/T(dashed)and corresponding hydroxylation adducts OH-A/T(solid)
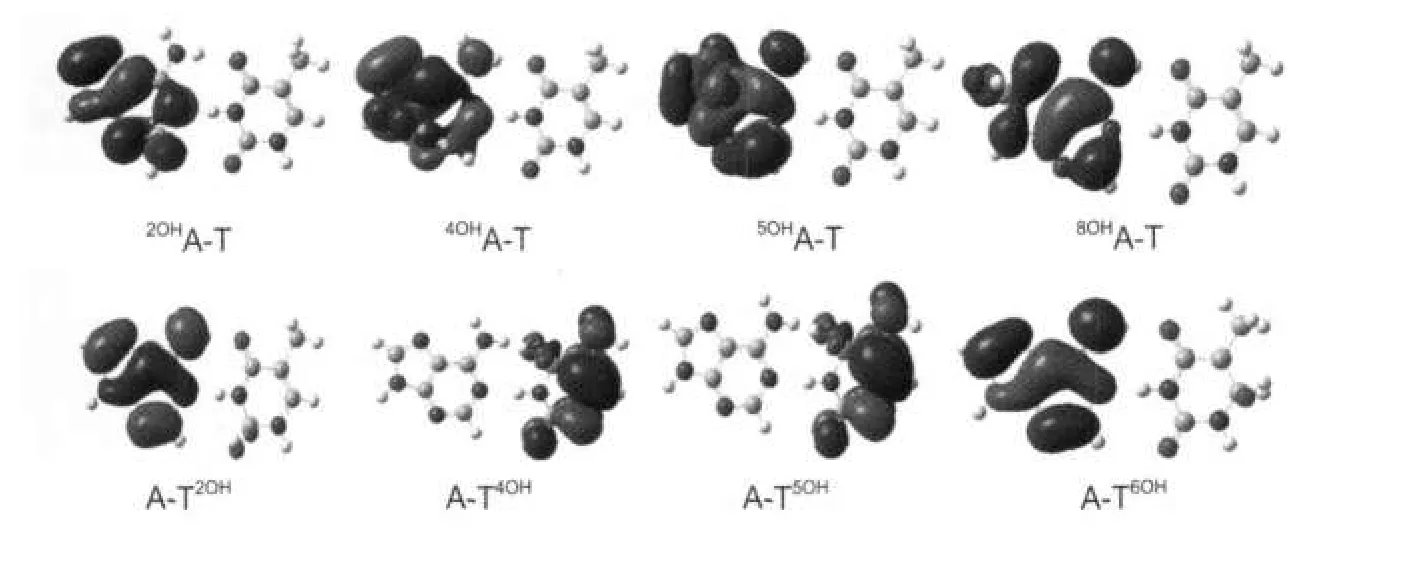
图5 复合物MOHA-T和A-TNOH的单电子占据轨道图Fig.5 SOMO populations of adductsMOHA-T andA-TNOH
图5给出了8种羟基化产物SOMO的分布情况.当碱基对中的腺嘌呤羟基化加成时,SOMO主要分布在腺嘌呤一侧;但是当羟基对胸腺嘧啶加成时,SOMO的分布情况与加成位置有很大关系,如 A-T4OH和A-T5OH的SOMO主要分布在胸腺嘧啶一侧,而A-T2OH和A-T6OH的SOMO主要分布在腺嘌呤一侧.2OHA、4OHA、5OHA和8OHA的SOMO的能量分别为-0.195、-0.188、-0.160和-0.181 a.u.,远高于胸腺嘧啶的最高占据轨道(HOMO)的能量(-0.241a.u.),故当它们与胸腺嘧啶的HOMO作用时,SOMO主要分布在腺嘌呤一侧.T2OH、T4OH、T5OH及T6OH的SOMO能量分别为-0.245、-0.208、-0.187和-0.239 a.u.,由于T4OH和T5OH的SOMO能量高于腺嘌呤的HOMO能量(-0.216 a.u.),故A-T4OH和A-T5OH的SOMO主要分布在胸腺嘧啶一侧,而A-T2OH和A-T6OH的SOMO能量低于腺嘌呤的HOMO能量,因此它们的SOMO主要分布在腺嘌呤一侧.
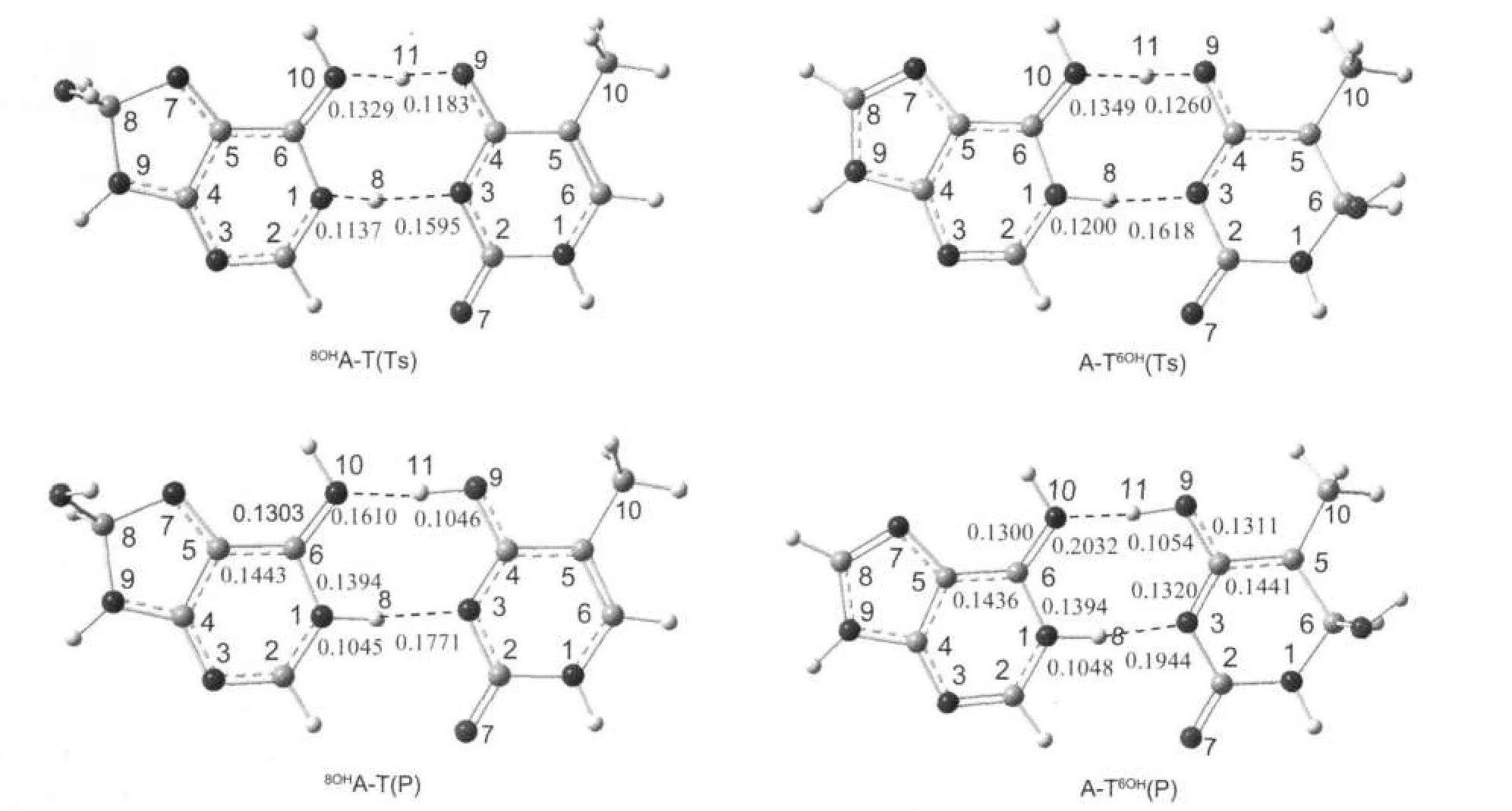
图6 8OHA-T与A-T6OH质子转移过程所涉及的过渡态与产物的优化构型Fig.6 Optimized structures of transition states and products of8OHA-T andA-T6OH corresponding to the proton transfer reaction

表3 8OHA-T与A-T6OH质子转移过程所涉及的能垒和反应热Table 3 Calculated activation barriers and reaction energies for the proton transfer reactions of 8OHA-T andA-T6OH
2.2 质子转移的反应机理
本文以能量较低的两种加成产物8OHA-T和A-T6OH为例对羟基化A-T间的质子转移过程进行了研究.为便于比较,在B3LYP/6-31++G(d,p)//B3LYP/ 6-31G(d,p)水平上对未羟基化A-T间的质子转移过程进行了研究,发现A-T间的质子转移为分步质子转移,其能垒分别为62.31和48.78 kJ·mol-1,与Kryachk等人的计算结果[14]基本一致.
图6显示了羟基化碱基对之间质子转移的过渡态及产物的构型.表3中列出了8OHA-T与A-T6OH质子转移过程所涉及的能垒和反应热.我们对质子转移过程中可能存在的离子型中间体进行了优化,但未能找到稳定的中间体,即整个质子转移过程是协同进行的.本文对所得到的过渡态的结构进行了振动频率计算,并通过IRC路径分析予以确认.
计算表明羟基化A-T间的双质子转移发生在氢键N10(A)··O9(T)及N1(A)··N3(T)之间,H11由腺嘌呤转移到胸腺嘧啶的O9上,同时胸腺嘧啶的H8向腺嘌呤的N1转移.当8OHA-T和A-T6OH形成过渡态时过渡态的构型更接近产物.此结果符合Hammond假设[26],即若质子转移的过程为吸热过程,反应的过渡态与产物的构型更相近.
表3表明,8OHA-T和A-T6OH发生协同双质子转移时,其势垒分别为42.01和50.27 kJ·mol-1,均低于A-T发生第一步质子转移(决速步骤)的能垒,这说明羟基对于腺嘌呤的8号位和胸腺嘧啶的6号位的羟基加成有利于A-T间质子转移的进行.另外,两种加成产物质子转移后的产物比质子转移前的能量高48.34和55.67 kJ·mol-1,且与质子转移过渡态的能量相差极小,所以它们质子转移的产物极不稳定.8OHA-T和A-T6OH发生质子转移的势垒之所以比A-T发生第一步质子转移的势垒低,与碱基对中碱基酸碱性的变化有关.表4中列出了A/T及8OHA/T6OH中相关位置的质子亲和势与去质子焓.在8OHA中,8OHA端N10H11的去质子焓为1420.51 kJ·mol-1,与碱基A相比减小了25.92 kJ·mol-1,表明其酸性增强;N1位的质子亲和势仅减小了13.74 kJ·mol-1,这表明此位置的碱性基本不变.在T6OH中,N3位的去质子焓与T相比减小17.41 kJ·mol-1,酸性增强;但O9位置质子亲和势仅降低4.08 kJ·mol-1,碱性基本不变.在对应碱基不变的情况下,羟基化碱基的碱性基本不变,酸性增强,质子更易解离,故经羟基加成后A-T间的质子转移势垒降低.
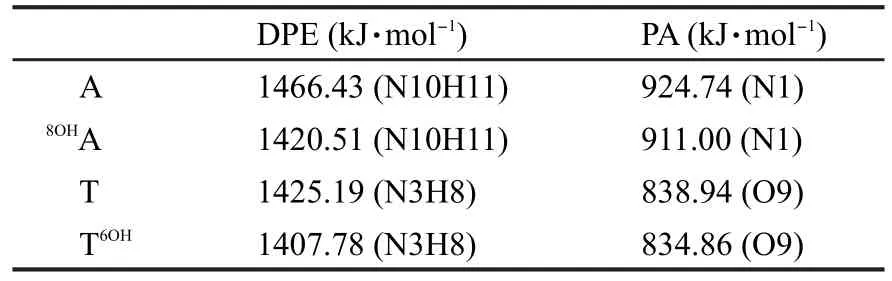
表4 A/T及8OHA/T6OH中相关位置的去质子焓与质子亲和势Table 4 Deprotonation enthalpies(DPE)and proton affinities(PA)for the relative positions ofA/T and8OHA/T6OH
3 结论
应用密度泛函理论在B3LYP/6-31G(d,p)水平上对羟基化碱基对A-T的结构进行了研究,并在B3LYP/6-31++G(d,p)水平上对相关结构进行单点能计算.经优化后共得到8种稳定的羟基化产物,产物能量的高低与加成发生前后的结构变化有密切关系,能量的相对顺序为8OHA-T<A-T6OH<A-T5OH<2OHA-T<4OHA-T<5OHA-T<A-T2OH<A-T4OH.当羟基进攻腺嘌呤时,碱基对间的相互作用增加;而当羟基进攻胸腺嘧啶时,其相互作用减弱.在腺嘌呤端的4种加成产物中,2OHA-T和4OHA-T具有较强的氧化性,5OHA-T具有较强的还原性;在胸腺嘧啶端4种加成产物中,A-T5OH的还原性较强,A-T2OH和A-T4OH的氧化性较强;经羟基化后A-T的质子转移机理由分步双质子转移变为协同双质子转移,且其势垒低于A-T发生质子转移的势垒.
1 Breen,A.P.;Murphy,J.A.Free Radical Bio.Med.,1995,18: 1033
2 Burrows,C.J.;Muller,J.G.Chem.Rev.,1998,98:1109
3 Steenken,S.;Novais,H.M.J.Phys.Chem.,1987,91:426
4 Vieira,A.J.S.C.;Steenken,S.J.Am.Chem.Soc.,1990,112: 6986
5 Steenken,S.Chem.Rev.,1989,89:503
6 Colson,A.O.;Sevilla,M.D.J.Phys.Chem.,1996,100:4420
7 Lowdin,P.O.Adv.Quantum Chem.,1965,2:213
8 Piccirilli,J.A.;Krauch,T.;Moroney,S.E.;Benner,S.A.Nature, 1990,343:33
9 Benderskii,V.A.;Makarov,D.E.;Wight,C.A.Chemical dynamic at low temperature:advances in chemical physics.New York:Wiley&Sons,1994
10 Zhanpeisov,N.U.;Leszczynski,J.J.Phys.Chem.A,1998,102: 6167
11 Truhlar,D.G.Chem.Phys.Lett.,1998,294:45
12 Floribn,J.;Hrouda,V.;Pave1,H.J.Am.Chem.Soc.,1994,116: 1457
13 Gorb,L.;Podolyan,Y.;Dziekonski,P.;Sokalski,A.;Lexzczynski, J.J.Am.Chem.Soc.,2004,126:10119
14 Kryachk,E.S.;Sabin,J.R.Int.J.Quantum Chem.,2003,91:695
15 Villani,G.Chem.Phys.,2005,316:1
16 Xie,H.;Xia,F.;Cao,Z.J.Phys.Chem.A,2007,111:4384
17 Zhang,J.D.;Schaefee III,H.F.J.Chem.Theory Comput.,2007, 3:115
18 Grand,A.;Morell,C.;Labet,V.;Cadet,J.;Eriksson,L.A. J.Phys.Chem.A,2007,111:8968
19 Li,L.;Wang,H.;Niu,X.J.;Li,Z.H.Chem.J.Chin.Univ.,2009, 30:1596 [李 澜,王 竑,牛晓娟,李宗和.高等学校化学学报,2009,30:1596]
20 Zhang,R.B.;Eriksson,L.A.J.Phys.Chem.B,2007,111:6571
21 Hohenberg,P.;Kohn,W.Phys.Rev.B,1964,136:864
22 Feller,D.J.Chem.Phys.,1990,93:579
23 Lee,C.;Yang,W.;Parr,R.G.Phys.Rev.B,1988,37:785
24 Becke,A.D.J.Chem.Phys.,1993,98:5648
25 Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 03. Revision B.03.Pittsburgh,PA:Gaussian Inc.,2003
26 Hammond,G.S.J.Am.Chem.Soc.,1955,77:334
August 2,2010;Revised:September 13,2010;Published on Web:October 18,2010.
Effect of Hydroxylation on Structures and Proton Transfer of A-T Base Pairs
SHI Jun-You1,2,*DONG Li-Hua1,2LIU Yong-Jun1
(1Northwest Institute of Plateau Biology,Chinese Academy of Sciences,Xining 810001,P.R.China;
2Graduate University of Chinese Academy of Sciences,Beijing 100049,P.R.China)
The structures and proton transfer processes of hydroxylated A-T base pairs were theoretically studied at the B3LYP/6-31++G(d,p)//B3LYP/6-31G(d,p)level.Our calculations revealed that hydroxyl radical could react with A-T at different positions to form eight stable adducts.The order of these adducts in energy is8OHA-T<A-T6OH<A-T5OH<2OHA-T<4OHA-T<5OHA-T<A-T2OH<A-T4OH(the number denotes the label of the atom in the A/T which is attacked by hydroxyl),which relates well with their structural changes upon the addition of hydroxyl radical.The interaction energy between A and T would increase slightly when hydroxyl radical reacts with the adenine,but it would decrease when the radical reacts with thymine. To study the proton transfer processes of the hydroxylated A-T base pairs,the most stable adducts,8OHA-T and A-T6OH,were selected to give calculations.The calculated results indicate that the proton transfer processes of8OHA-T and A-T6OHfollow the concerted mechanism,which is different from the stepwise mechanism of A-T.What is more,its energy barrier is lower than the corresponding energy of the latter's first step(rate-determining step).
Density functional theory;Base pair;Hydroxylation;Proton transfer;Singly occupied molecular orbital
O641
∗Corresponding author.Email:shijunyou123@126.com;Tel:+86-15809781546.
The project was supported by the Program of“One Hundred Talents Program”of the ChineseAcademy of Sciences.中国科学院“百人计划”研究项目资助

