制备方法对CuO/CeO2-ZrO2催化CO低温氧化活性的影响
杨志强 毛东森 郭强胜 顾 蕾
(上海应用技术学院化学与环境工程学院,上海 200235)
制备方法对CuO/CeO2-ZrO2催化CO低温氧化活性的影响
杨志强 毛东森*郭强胜 顾 蕾
(上海应用技术学院化学与环境工程学院,上海 200235)
采用微波加热分解法(一步法)和微波加热处理共沉淀+浸渍法(两步法)制备了CuO/CeO2-ZrO2催化剂,并对其进行了X射线衍射、低温氮气吸附/脱附和程序升温还原等表征,采用色谱流动法考察了催化剂的催化CO低温氧化性能.结果表明,一步法比两步法更有利于使催化剂表面CuO高度分散,CuO与CeO2-ZrO2间的相互作用更强,CuO更容易被还原,从而具有更高的催化CO氧化活性.与CeO2-ZrO2有相互作用的高分散和小颗粒CuO有利于催化剂活性的提高,与CeO2-ZrO2无相互作用的大颗粒CuO对催化剂的活性有抑制作用.
催化活性;CuO/CeO2-ZrO2;CO氧化;微波加热
随着人们环境保护意识的不断增强,CO低温催化氧化已经成为催化研究的一个热点问题[1-2].目前,用于CO低温氧化的催化剂主要包括贵金属催化剂和非贵金属催化剂两大类.由于贵金属资源稀少且价格昂贵,因此开发出具有优良催化活性的非贵金属催化剂成为研究的焦点.CuO/CeO2复合氧化物因具有优良的催化活性而受到广泛的关注[3-4].近年来,CuO/CeO2-ZrO2催化剂因比CuO/CeO2催化剂具有更高的热稳定性[5-7]和更长的使用寿命[7]而得到了广泛的研究[5-17].研究表明CuO/CeO2-ZrO2催化剂的反应性能不仅与其组成有关,而且还与其制备方法密切相关.目前,CuO/CeO2-ZrO2催化剂的制备方法主要可分为两种:一种是采用共沉淀、溶胶-凝胶、水热晶化和微乳等方法先制得CeO2-ZrO2复合氧化物,然后再采用浸渍法将CuO负载在CeO2-ZrO2复合氧化物的表面,即所谓的两步法[5,7-15].另一种是采用柠檬酸溶胶-凝胶法或表面活性剂模板法直接得到CuO-CeO2-ZrO2催化剂[6,15-19],即所谓的一步法.
洪庆红等[15]分别采用柠檬酸溶胶-凝胶法和柠檬酸溶胶-凝胶+浸渍法制备了CuO质量分数为2.5%的CuO/CeO2-ZrO2催化剂,并考察了它们对CO氧化反应的催化活性,结果表明一步法制备的催化剂活性明显大于两步法的催化剂活性,其CO转化率为90%时所需的反应温度分别为92和105ºC.
本文利用氢氧化四氨合铜(Cu(NH3)4(OH)2)能够加热分解为Cu(OH)2或CuO的特点,通过共沉淀法得到铈、锆氢氧化物沉淀,采用微波加热回流使混合液中的Cu(NH3)4(OH)2分解,在铈、锆氢氧化物沉淀物的表面负载一层Cu(OH)2或CuO,然后通过高温焙烧得到CuO/CeO2-ZrO2催化剂,该制备方法尚未见文献报道.作为对比,又采用微波辅助加热处理共沉淀+浸渍的方法(即两步法)制备CuO/CeO2-ZrO2催化剂,并通过X射线衍射(XRD)、程序升温还原(TPR)和氮气吸附/脱附等技术对上述样品进行表征,通过活性评价考察它们催化氧化CO的活性并与物理化学性质表征结果进行关联.
1 实验部分
1.1 催化剂的制备
采用两种方法制备CuO/CeO2-ZrO2催化剂.
一步法:在n(Ce):n(Zr)=3:2的(NH4)2Ce(NO3)6和Zr(NO3)4·5H2O混合水溶液中加入Cu(NO3)2·3H2O水溶液,在快速搅拌下将上述混合液缓慢滴入到盛有稀氨水的三口烧瓶中,在此过程中,铈和锆生成氢氧化物沉淀、铜生成Cu(NH3)4(OH)2.滴加结束,保证pH=10左右,并继续搅拌1 h.之后将反应混合物放入微波炉中,微波功率定为300 W,磁力搅拌下进行微波加热.随着混合液中NH3的不断挥发,体系的pH值会逐渐降低,当pH=7时,将微波功率调为800 W,继续加热10 min.冷却到90ºC后过滤,分别用去离子水和无水乙醇洗涤滤饼.把滤饼放入微波炉中于900 W功率下加热干燥3 min,制得催化剂的前驱体.将该前驱体置于马弗炉中在一定温度(500,600, 700和800ºC)下焙烧2 h得到CuO/Ce0.6Zr0.4O2催化剂,记为CuO-CZ-t,t为焙烧温度(ºC).
两步法:将(NH4)2Ce(NO3)6和Zr(NO3)4·5H2O按n(Ce):n(Zr)=3:2的比例配成透明的混合水溶液,在快速搅拌下将其缓慢滴入到盛有稀氨水的三口烧瓶中.滴加结束,使pH=10左右,并继续搅拌1 h.之后其反应混合液所用微波加热及微波干燥的操作步骤同上.将微波干燥的前驱体于500ºC焙烧2 h,得到橙黄色铈锆复合氧化物.称取一定量的铈锆复合氧化物样品并倒入一定体积的Cu(NO3)2水溶液中,充分搅拌混合,室温静置4 h.然后放入烘箱中于80ºC低温烘干,再在一定温度下焙烧2 h得到催化剂CuO/Ce0.6Zr0.4O2,记为CuO/CZ-t,t为焙烧温度(ºC).
以上所有催化剂中CuO的质量分数均为10%,所用试剂均为分析纯,购自国药集团上海化学试剂有限公司.
1.2 催化剂的表征
XRD测试在荷兰X′Pert Pro型X射线衍射仪上进行.采用Cu Kα辐射源,λ=0.15418 nm,管电流和管电压分别为40 mA和40 kV,扫描范围为20.0°-90.0°,扫描速率为8(°)·min-1.根据CeO2(111)晶面的衍射峰分别采用Scherrer公式和Bragg方程计算CeO2的晶粒尺寸和晶胞参数.
样品的比表面积和孔容在美国Micromeritics公司生产的ASAP-2020M+C型自动物理化学吸附仪上以N2为吸附质、77.3 K下进行测定,测试前样品先于473 K下抽真空预处理4 h以除去所吸附的杂质.使用日本电子株式会社的JEM-2100型透射电子显微镜观察样品的晶粒大小及形貌.
H2-TPR测试在常压微型石英管反应器上进行,样品的用量为50 mg,以体积分数为10%H2-90%N2混合气为还原气,气体流速为50 mL·min-1,升温速率为10ºC·min-1.升温过程中H2的消耗量用浙江温岭福立公司生产的GC 9750型气相色谱仪的热导池检测器进行检测.
1.3 催化活性的评价
CO氧化反应在常压微型固定床流动反应装置上进行[20].将0.2 g大小为40-60目的催化剂颗粒与0.6 g粒度大小相当的石英砂混合后,装入内径为6 mm的不锈钢反应管中.在200ºC下用流速为45 mL·min-1的N2气吹扫30 min,然后切换为反应混合气,其体积组成为1%CO、10%O2,其余为N2,流速为45 mL·min-1.反应前后的气体组成用浙江温岭福立公司生产的GC 9790A型气相色谱仪进行在线分析,热导池检测器,碳分子筛色谱柱.
2 结果与讨论
2.1 N2吸附/脱附表征
表1列出了由一步法和两步法制备催化剂样品的比表面积和孔容数据.由此可见,随着焙烧温度的升高,两个系列样品的比表面积和孔容均逐渐减小,尤其是当焙烧温度升高至大于600ºC时,降低的幅度更大.这是由于随着焙烧温度的升高,催化剂样品开始烧结.另外,对于同一焙烧温度制备的催化剂,一步法样品的比表面积和孔容均大于两步法样品的比表面积和孔容,而且其随焙烧温度升高而降低的幅度要小于两步法制备的样品,说明一步法制备样品的抗烧结能力要大于两步法制备的样品.
一步法制备催化剂时,溶液中的Cu(NH3)4(OH)2经微波加热分解生成的CuO均匀分散于铈、锆氢氧化物沉淀表面使沉淀物颗粒彼此分开,起到了阻止颗粒烧结的作用.而两步法在干燥浓缩浸渍液过程中,硝酸铜颗粒在载体表面或孔道内的沉积量会出现梯度效应,致使孔道部分堵塞,经高温焙烧,CuO颗粒团聚使得CeO2-ZrO2载体颗粒之间不能很好地“隔离”进而发生烧结,比表面积和孔容也就相应减小.
上述结果表明,不同的制备方法对CuO/CeO2-ZrO2催化剂的比表面积和孔容产生了一定的影响,而且可能会影响到CuO在铈锆复合氧化物中的分散程度.
2.2 XRD分析
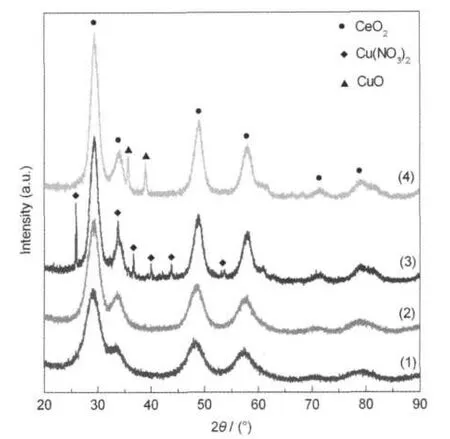
图1 两种不同方法制备样品的XRD谱Fig.1 XRD patterns of samples prepared by the two different approaches(1)sample prepared by one-step approach and dried;(2)sample prepared by one-step approach and calcined at 300ºC;(3)sample prepared by two-step approach and dried;(4)sample prepared by two-step approach and calcined at 300ºC
图1是采用两种方法制备样品的XRD谱.从图1可以看出,采用一步法制备的样品经干燥后,即生成了较纯的铈锆固溶体,没有铈、锆的氢氧化物和ZrO2等杂峰出现,也没有CuO的特征衍射峰出现,与300ºC焙烧样品的XRD谱非常相似.很显然,铈锆固溶体是在反应混合液中生成的.这是由于采用微波辐射加热时水分子随高频变换的微波能量场的作用高速振动,分子之间碰撞摩擦产生大量的热,使溶液温度急剧上升,甚至出现“过热”现象,这种分子水平的“搅拌”作用将微波能量传递至铈、锆氢氧化物分子,加速其脱水过程,促进了铈锆固溶体的生成.而同样的原因,随着氨气的放出,铜氨络合物分解为Cu(OH)2后,微波能量的传递亦加速其脱水过程,生成的CuO便沉积于铈锆固溶体表面.由于在微波作用下,CuO生成的速度远大于其晶粒生长的速度,因此在XRD谱上看不到晶相CuO特征峰,说明生成了高分散或粒径较小的CuO.而采用两步法制备的前驱体有较多Cu(NO3)2衍射峰出现,经300 ºC焙烧2 h后这些衍射峰完全消失,出现了CuO的特征衍射峰,说明该方法不利于CuO在载体表面的均匀分散.这是因为浸渍硝酸铜溶液的铈锆固溶体在干燥过程中,随着水分子的蒸发,硝酸铜溶液逐渐浓缩,下层载体表面沉积的硝酸铜颗粒数目就会高于上层,出现梯度沉积现象,这更有利于硝酸铜晶体的生长,加热分解亦会生成大颗粒的CuO.
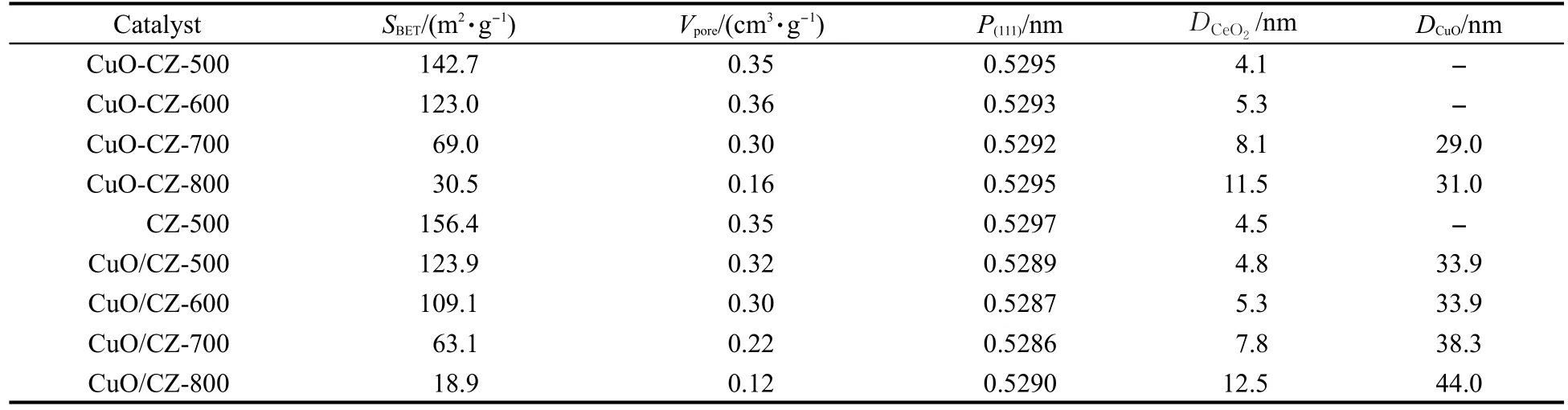
表1 一步法和两步法制备催化剂的比表面积(SBET)、孔容(Vpore)、晶胞参数(P(111))和晶粒大小(D)Table 1 Specific surface area(SBET),pore volume(Vpore),lattice parameter(P(111)),and crystallite size(D)of the catalysts prepared by one-step approach and two-step approach
图2是样品在不同温度焙烧后的XRD谱.由图2可见,两种方法制备的CuO/CeO2-ZrO2催化剂都呈CeO2的萤石型立方晶相结构,且都没有出现晶相ZrO2的特征衍射峰,说明Zr4+取代了部分Ce4+进入到CeO2的晶格中形成了CeO2-ZrO2固溶体结构[20].随焙烧温度的不断升高,衍射峰的峰形逐渐变窄,峰高逐渐增强.尤其是当焙烧温度大于600ºC时,样品的衍射峰骤然变得尖锐,峰强度显著增强.说明当焙烧温度大于600ºC时,铈锆复合氧化物开始发生明显的烧结,晶化程度增强,粒径变大,这与上述的比表面积和孔容的测定结果相一致.此外,所有样品的衍射峰都没有出现分裂,表明CeO2和ZrO2没有出现偏析.
表1中列出了由Scherrer公式计算得到的各个样品中CeO2的晶粒尺寸.可以看到,经过500和600 ºC焙烧的催化剂,其粒径变化不大,而且与载体CeO2-ZrO2比较接近,但经过700和800ºC焙烧的催化剂,其粒径明显增大,说明此时催化剂都已发生了明显的烧结.此外,两种不同方法制备的催化剂其CeO2的晶粒尺寸基本相同,说明制备方法对催化剂中CeO2的晶粒尺寸无明显影响.
由表1可见,催化剂的晶胞参数随焙烧温度由500ºC升高到700ºC而逐渐减小,且均比CZ-500的晶胞参数小.这是由于Cu2+的半径(0.079 nm)小于Ce4+的半径(0.097 nm)和Zr4+的半径(0.084 nm),少部分Cu2+取代Ce4+或Zr4+进入Ce-Zr-O固溶体后生成了Cu-Ce-Zr-O固溶体,从而导致晶格的收缩[21].然而当焙烧温度进一步升高至800℃时,晶胞参数反而增大,表明进入晶格中的Cu2+又从固溶体中析出,从而致使晶胞参数变大.王建强等[22]采用柠檬酸溶胶-凝胶法制备的Cu0.1Ce0.6Zr0.3Ox催化剂也发现当焙烧温度从500ºC升高到800ºC,晶胞参数由0.5324增大至0.5328 nm.
比较图2(A)和2(B)发现,两种方法制备的催化剂,其CuO衍射峰的差别较大.一步法中CuOCZ-500和CuO-CZ-600样品没有出现CuO的特征衍射峰,表明CuO高度分散于铈锆复合氧化物的表面或进入其晶格中形成了Cu-Ce-Zr-O固溶体,此外部分铜也可能以微小的CuO颗粒存在而无法被XRD所检测到.当焙烧温度升至700和800ºC时,在2θ为35.6°和38.8°处开始出现晶相CuO的特征衍射峰,由Scherrer公式计算得到粒径分别为29.0和31.0 nm(表1).两步法制备的所有样品都出现了晶相CuO的特征衍射峰,而且随焙烧温度的升高,衍射峰的强度逐渐增强,表明CuO颗粒发生了烧结,从而其粒径逐渐增大.从表1可知,其晶相CuO的粒径介于33.9和44.0 nm之间,均明显大于一步法制备的CuO颗粒的粒径.
上述结果表明采用一步法制备催化剂时,其CuO的分散性更好,且其CuO颗粒随焙烧温度的升高相对于两步法更不容易烧结和长大.
2.3 TEM表征
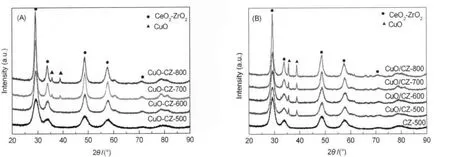
图2 一步法(A)和两步法(B)制备催化剂的XRD谱图Fig.2 XRD patterns of the catalysts prepared by one-step approach(A)and two-step approach(B)

图3 焙烧温度为600ºC时一步法(A)和两步法(B)制备催化剂的TEM照片Fig.3 TEM images of the catalysts prepared by one-step approach(A)and two-step approach(B)and calcined at 600ºC
图3为600ºC焙烧样品的透射电镜照片,从图3 (A)可以看到载体颗粒的大小及分散都较为均匀,粒径分布较窄,皆在6 nm左右,未观察到CuO颗粒,这与上述XRD的测试结果相一致.图3(B)中除载体外还观察到大颗粒的CuO粒子,其粒径为30-35 nm,与用XRD计算的尺寸(表1)基本一致.
2.4 TPR测试
图4(A)是一步法制备样品的H2-TPR谱.从图中可以看到,焙烧温度为500和600ºC时催化剂都有两个还原峰(α和β).当焙烧温度升高至700和800ºC时,催化剂的TPR曲线开始出现肩峰,700ºC焙烧的样品出现右肩峰(γ),800ºC焙烧的样品出现左肩峰(β);也就是说这两个催化剂样品都出现了三个还原峰,其分峰处理结果如图4(A)中所示,800ºC焙烧样品的γ峰明显大于700ºC焙烧的样品.图4(B)是两步法制备样品的H2-TPR谱.由图可见,每个催化剂的TPR谱都出现了三个明显的还原峰(α、β和γ),表明该系列催化剂中均存在三种不同类型的铜物种.
有关CuO/CexZr1-xO2催化剂中CuO还原性的研究已有不少报道.Wang等[5,9]发现采用沉淀+浸渍法制备的CuO质量分数为5%的CuO/Ce0.8Zr0.2O2催化剂分别在172.1和278.5℃处存在2个还原峰,并将其归属于高分散CuO和体相CuO的还原.洪庆红等[15]采用柠檬酸溶胶-凝胶法和柠檬酸溶胶-凝胶+浸渍法制备的CuO质量分数为2.5%的CuO/Ce0.7Zr0.3O2催化剂均在190-200和250ºC处存在2个分别为高分散CuO和存在于CeO2晶格中Cu物种的还原峰. Wang等[7]在研究采用水热晶化+浸渍法制备的CuO质量分数为5%的不同铈锆比的CuO/CexZr1-xO2催化剂时发现在179、201和245ºC处存在3个还原峰,分别对应与载体强相互作用的高分散的CuO、与载体弱相互作用的较大颗粒的CuO和晶相CuO的还原. Ma等[23]也报道了CuO/Ce0.8Zr0.2O2催化剂的H2-TPR谱中分别归属为高分散CuO、中等颗粒CuO和大颗粒CuO还原的3个耗氢峰.根据上述文献及前述的XRD结果,我们认为本文CuO/Ce0.6Zr0.4O2催化剂中的α峰应归属于催化剂表面高度分散CuO的还原,β峰应归属于存在于铈锆晶格中的Cu物种或催化剂表面较小颗粒(XRD无法检测)CuO的还原,γ峰应归属于催化剂表面较大颗粒(XRD能够检测)CuO的还原.
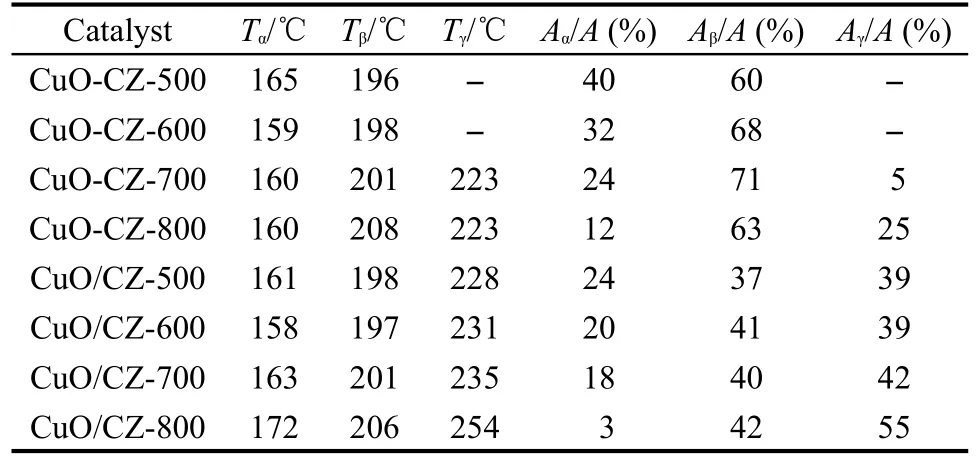
表2 一步法和两步法制备催化剂还原峰的温度和面积Table 2 Temperatures and areas of reduction peaks of the catalysts prepared by one-step and two-step approach
图4中各还原峰的温度和峰面积数据列于表2.由表中数据可知两种不同方法制备的催化剂存在以下的差别.(1)一步法中除500ºC焙烧样品的α峰的还原温度为165ºC之外,其它三个样品的α峰的还原温度都在159-160ºC之间,表明随着焙烧温度的升高,高分散CuO的还原性基本不变.而两步法制备样品α峰的还原温度随催化剂焙烧温度的升高有逐渐升高的趋势,表明随催化剂焙烧温度的升高,高分散CuO的还原性逐渐减弱.(2)一步法制备的催化剂中仅700和800ºC焙烧的样品才有γ峰出现,而且其峰温相同,而两步法制备的所有样品均出现γ峰且其峰温随催化剂焙烧温度的升高而逐渐升高,表明其还原性逐渐变差.(3)对于相同焙烧温度制备的催化剂,两步法制备样品的γ峰温要明显高于一步法制备样品的γ峰温,而且其峰面积所占的比例也显著高于一步法制备的样品,这表明两步法样品中CuO的还原性较差,CuO的颗粒较大而且大颗粒CuO的数量相对较多.该结果与上述XRD的表征结果相一致.
2.5 催化CO氧化活性
图5(A)给出了一步法制备催化剂的CO转化率与反应温度的变化曲线.由图可见,CuO-CZ-500至CuO-CZ-800的T100(CO转化率达到100%时所需的反应温度)分别为90、85、90和105ºC.图5(B)是两步法制备催化剂的活性评价结果,CuO/CZ-500至CuO/CZ-800的T100分别为100、93、95和110ºC.上述结果表明,在两个系列催化剂中,600ºC焙烧样品的CO氧化活性均最高,700和500ºC焙烧的样品次之,800ºC焙烧样品的活性最差.Wang等[5,9]在用共沉淀+浸渍法制备的CuO质量分数为5%的CuO/ Ce0.8Zr0.2O2催化剂时也发现当焙烧温度为600ºC时样品的CO氧化活性最高.此外,对于相同焙烧温度制备的催化剂,一步法制备催化剂的活性均明显好于两步法制备催化剂的活性.
研究表明,CuO/CeO2-ZrO2催化CO氧化反应的活性与其CuO的存在形式和还原性密切相关.蒋晓原[8]、Wang[9]和Zhu[14]等都认为高分散CuO是反应的活性中心,而体相的CuO具有副作用.此外,我们之前在研究制备载体Ce0.6Zr0.4O2过程中前躯体的处理方式对CuO/Ce0.6Zr0.4O2催化活性的影响时发现,催化剂中的CuO越容易还原,则CuO越容易和CO反应生成CO2,催化活性越高[11].在本文中,当焙烧温度由500ºC升高到600ºC时,两种方法制备的催化剂中CuO的还原温度均有所降低,表明其还原性略有增强,故催化剂的活性也相应地提高.当焙烧温度进一步升高到700和800ºC时:(1)一步法催化剂中虽然高分散CuO的还原温度基本相同,但其含量逐渐减少,并出现了晶相的CuO而且其含量逐渐增大(表2),故催化剂的活性也相应地逐渐减弱;(2)两步法催化剂中α、β和γ峰所对应CuO的还原温度均逐渐升高,表明其还原性逐渐变差,此外,高分散CuO的含量减少而大颗粒CuO的含量明显增大(表2),故催化剂的活性也相应地逐渐减弱.
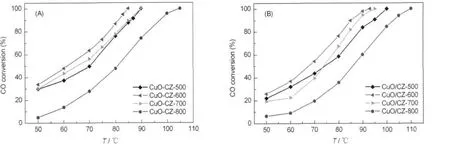
图5 一步法(A)和两步法(B)制备催化剂的CO氧化活性Fig.5 Activity for CO oxidation of the catalysts prepared by one-step approach(A)and two-step approach(B)
对于两种不同方法制备的催化剂,(1)当焙烧温度较低(500-700ºC)时,虽然高分散及小颗粒CuO的还原温度基本相同,但一步法制备样品中高分散及小颗粒CuO的含量要显著高于两步法样品(表2).此外,一步法样品仅在700ºC焙烧时才出现大颗粒的CuO,而且其还原温度显著低于两步法样品,颗粒的大小和相对数量也均明显低于两步法样品,故其催化活性都明显高于两步法样品.(2)当在800ºC焙烧时,一步法制备样品中高分散及小颗粒CuO的还原温度均明显低于两步法样品,晶相CuO颗粒的大小和含量也均显著低于两步法样品,故其催化活性明显高于两步法样品.
3 结论
一步法样品中CuO的分散性和均一性均好于两步法样品,前者只有当焙烧温度高于600ºC时才开始出现晶相的CuO,而后者在任一焙烧温度下都有晶相的CuO存在,分散性较差.
一步法样品催化CO氧化的活性均高于两步法样品.催化剂表面与CeO2-ZrO2相互作用的高分散及小颗粒CuO的数目愈多、还原性愈好,愈有利于催化活性的提高,晶相CuO的颗粒愈大数目愈多、还原性愈差,愈不利于催化活性的提高.
当焙烧温度较高(800ºC)时,催化剂中的CuO发生明显的烧结、颗粒显著增大,与CeO2-ZrO2相互作用显著减弱,故其催化活性明显变差.
1 Liu,Y.;Meng,M.;Yao,J.S.;Zha,Y.Q.Acta Phys.-Chim.Sin., 2007,23:641 [刘 咏,孟 明,姚金松,査宇清.物理化学学报,2007,23:641]
2 Yu,J.;Wu,G.S.;Mao,D.S.;Lu,G.Z.Acta Phys.-Chim.Sin., 2008,24:1751 [俞 俊,吴贵升,毛东森,卢冠忠.物理化学学报,2008,24:1751]
3 Zheng,X.C.;Wang,X.Y.;Yu,L.H.;Wang,S.R.;Wu,S.H. Prog.Chem.,2006,18:159 [郑修成,王向宇,于丽华,王淑荣,吴世华.化学进展,2006,18:159]
4 Liang,F.X.;Zhu,H.Q.;Qin,Z.F.;Wang,G.F.;Wang,J.G. Prog.Chem.,2008,20:1453 [梁飞雪,朱华青,秦张峰,王国富,王建国.化学进展,2008,20:1453]
5 Wang,S.P.;Zheng,X.C.;Wang,X.Y.;Wang,S.R.;Zhang,S. M.;Yu,L.H.;Huang,W.P.;Wu,S.H.Catal.Lett.,2005,105: 163
6 Wang,S.P.;Wang,X.Y.;Huang,J.;Zhang,S.M.;Wang,S.R.; Wu,S.H.Catal.Commun.,2007,8:231
7 Wang,S.P.;Zhang,T.Y.;Su,Y.;Wang,S.R.;Zhang,S.M.;Zhu, B.L.;Wu,S.H.Catal.Lett.,2008,121:70
8 Jiang,X.Y.;Zhou,R.X.;Chen,Y.;Lou,L.P.;Zheng,X.M. J.Zhejiang Univ.:Science Edition,2001,28:653 [蒋晓原,周仁贤,陈 煜,楼莉萍,郑小明.浙江大学学报:理学版,2001,28: 653]
9 Wang,S.P.;Wang,X.Y.;Zheng,X.C.;Wang,S.R.;Zhang,S. M.;Huang,W.P.;Wu,S.H.React.Kinet.Catal.Lett.,2006,89: 37
10 Luo,M.F.;Zheng,X.M.Acta Chem.Scand.,1998,52:1183
11 Yang,Z.Q.;Mao,D.S.;Zhu,H.L.;Lu,G.Z.Chin.J.Catal., 2009,30:997 [杨志强,毛东森,朱慧琳,卢冠忠.催化学报, 2009,30:997]
12 Martinez-Arias,A.;Fernandez-Garcia,M.;Galvez,O.;Coronado, J.M.;Anderson,J.A.;Conesa,J.C.;Soria,J.;Munuera,G. J.Catal.,2000,195:207
13 Chen,H.L.;Zhu,H.Y.;Wu,Y.;Gao,F.;Dong,L.;Zhu,J.J. J.Mol.Catal.A,2006,255:254
14 Zhu,J.;Zhang,L.L.;Deng,Y.;Liu,B.;Dong,L.H.;Gao,F.; Sun,K.Q.;Dong,L.;Chen,Y.Appl.Catal.B,2010,96:449
15 Hong,Q.H.;Song,Y.P.;Jia,A.P.;Pu,Z.Y.;Luo,M.F.J.Mol. Catal.(China),2008,22:429 [洪庆红,宋宇鹏,贾爱平,普志英,罗孟飞.分子催化,2008,22:429]
16 Wang,E.G.;Chen,S.Y.J.Chin.Rare Earth Soc.,2001,19:17 [王恩过,陈诵英.中国稀土学报,2001,19:17]
17 Wang,E.G.;Chen,S.Y.J.Rare Earths,2002,20:533
18 Wang,J.P.;Wang,E.G.;Chen,S.Y.Coal Conv.,2000,23:88 [王建平,王恩过,陈诵英.煤炭转化,2000,23:88]
19 Cao,J.L.;Wang,Y.;Zhang,T.Y.;Wu,S.H.;Yuan,Z.Y.Appl. Catal.B,2008,78:120
20 Yang,Z.Q.;Mao,D.S.;Zhu,H.L.;Lu,G.Z.Chin.J.Inorg. Chem.,2009,25:812 [杨志强,毛东森,朱慧琳,卢冠忠.无机化学学报,2009,25:812]
21 Cai,C.;Xue,P.J.Ningxia Univ.:Natural Science Edition,2005, 26:345 [蔡 超,薛 屏.宁夏大学学报:自然科学版,2005, 26:345]
22 Wang,J.Q.;Shen,M.Q.;Wang,J.;Wang,W.L.;Jia,L.W.Acta Phys.-Chim.Sin.,2010,26:2249 [王建强,沈美庆,王 军,王务林,贾莉伟.物理化学学报,2010,26:2249]
23 Ma,L.;Luo,M.F.;Chen,S.Y.Appl.Catal.A,2003,242:151
August 1,2010;Revised:October 8,2010;Published on Web:October 29,2010.
Effect of Preparation Method on the Activity of CuO/CeO2-ZrO2Catalysts for Low Temperature CO Oxidation
YANG Zhi-Qiang MAO Dong-Sen*GUO Qiang-Sheng GU Lei
(School of Chemical and Environmental Engineering,Shanghai Institute of Technology,Shanghai 200235,P.R.China)
CuO/CeO2-ZrO2catalysts were prepared by microwave heating decomposition(one-step approach)and by microwave heating treatment of co-precipitation followed by impregnation(two-step approach).The catalysts were characterized by X-ray diffraction(XRD),low temperature N2adsorption/ desorption,and H2-temperature-programmed reduction(H2-TPR).The catalytic activities of the catalysts for low temperature CO oxidation were investigated using a microreactor-gas chromatograph.The results showed that the one-step approach was more beneficial to CuO dispersion on the catalyst surface because of a strong interaction between CuO and CeO2-ZrO2and to the improved reducibility of CuO, which resulted in higher catalytic activity.We conclude that finely dispersed and small CuO particles strongly interact with CeO2-ZrO2are responsible for the high catalytic activity toward CO oxidation and that large CuO particles that do not interact with CeO2-ZrO2inhibit the catalytic activity.
Catalytic activity;CuO/CeO2-ZrO2;CO oxidation;Microwave heating
O643
∗Corresponding author.Email:dsmao@sit.edu.cn,dsmao1106@yahoo.com.cn;Tex/Fax:+86-21-64941386.
The project was supported by the Leading Academic Discipline Project of Shanghai Education Committee,China(J51503)and Research Foundation of Shanghai Institute of Technology,China(KJ2008-01).
上海市教委重点学科建设项目(J51503)及上海应用技术学院科学技术发展基金项目(KJ2008-01)资助

