移动式微波全身加热的理论模型与温度预示
贾得巍 刘 静,2*
1(清华大学医学院生物医学工程系,北京 100084)
2(中国科学院理化技术研究所,北京 100190)
引言
全身热疗是通过全身均匀温和升温的发热作用来摧毁肿瘤细胞,继而控制癌细胞转移的治疗方法[1]。欧美国家自上世纪80年代开始进行全身热疗设备的研制,及肿瘤全身热疗的临床应用,经过20多年研究和发展,逐步建立了初步的全身热疗理论基础[2-3]。2000年美国 FDA 批准了全身热疗(WBH)用于恶性肿瘤的临床治疗。与局部高温的肿瘤热消融形成对比,全身热疗摧毁肿瘤的方式多为生化性[4]或免疫性[5-7],而非直接消融。因此,建立严格的全身热疗标准显得极为重要。目前公认的治疗标准为全麻状态下体核温度(食道下段)达到41.8℃并恒温维持60 min。
然而当前能实施全身热疗的方法并不多,主要包括致热源注射、机体表面直接接触传热、红外线辐射式加热及体外循环等方法。它们在风险或效果上均存在一定不足,而且无法对治疗温度严格控制,使得全身热疗的应用受到了一定制约。这就要求全身热疗在实施前,应该对温度进行预测,进而对可达到的效果加以评估,并在此基础上,对热疗过程中可预知的风险采取相应保护措施。另一方面,则应改进全身热疗的方式,使患者在开放空间接受尽可能短时间的热疗。为此,本研究针对移动加热的微波全身热疗过程[8]进行了评估,进一步结合已验证的人体温度模型对微波电磁场作用下人体的温度响应提出了预测方法,并基于前人采集的数据进行分析,提出一种对移动微波进行全身热疗评估和验证的方法。
1 移动热源式全身热疗原理及理论建模
1.1 微波的组织热吸收原理
微波热疗机的热疗实验装置如图1(a)所示,通过顶置微波聚束发射大剂量球面微波,再经聚束装置,形成高功率远场微波束,可由局部治疗转为全身治疗,其工作频率为915 MHz,标称有效透热深度为10 cm。在915 MHz的微波频段,微波对电介质的加热主要通过介质内的离子如各种盐类的自由电荷极化振动[9],引起机体热吸收和升温,从而影响到身体其他器官的正常工作,如图1(b)所示。值得注意的是,工作频率为915 MHz的热疗机的加热机制与高频工作的家用微波炉不同,并非基于水分子共振,而是介质中自由电荷极化。

图1 移动式微波全身热疗装置和模型。(a)热疗机热疗实施装置;(b)915 MHz微波热疗体内产热机制;(c)48房室人体热学模型-微波作用Fig.1 Equipment and theoretical model for moveable microwave whole body hyperthermia.(a)Schematic of moveable microwave whole body hyperthermia apparatus;(b)Human body heat absorption mechanism for 915 MHz microwave;(c)48 compartments human thermal model and the interaction with microwave
1.2 微波功率发射及传播远场
在热疗过程中会实时显示微波发射的功率,将此功率转化为空间微波场内人体实际吸收的功率以计算人体热响应,如图1(c)的作用模型所示。根据微波热疗机的设计原理和功率控制技术[10-12]可知,微波热疗机产生微波震荡的关键元件在于磁控管,其原理为:阴极发射的有利电子在高电压下漂移,在与微波场作同步运动的过程中减速从而将自身的直流位能交给微波,并由阳极收集,如图2(a)所示。因此,微波机的工作功率为

式中,η为转换效率,Va是加在磁控管阴极和阳极之间的电压,Ia是磁控管内由阴极到达阳极的电子流形成的阳极电流。热疗机运行通过调节 Ia进行发射系统内部的PID在线控制,若要能对热疗患者的温度场进行估计,必须建立从发射功率到温度吸收和温度分布响应之间的作用机制。文献[13]通过电磁波透射和发射的手法曾对微波和人体的热穿透作过一定探讨,研究了微波在人体电磁阻抗中传播的衰减深度,提出了微波能量向人体热能转化依赖于微波能量空间传播特性这一结论,但没有进一步对人体的温度响应做出研究。实际上,对于频率为915 MHz的微波,其波长为32.75 cm,与人身体尺度相当,在这一特征尺度内,电磁波的传播特征占据了主导地位[14],为了得到真实的温度分布,必须求解耦合电磁场。

图2 微波振荡在磁控管内的建立及发射后远场的形成① 图片得到Encyclopedia Britannica的非商业使用授权。(a)磁控管内微波震荡建立过程;(b)微波远场传播波形Fig.2 Establishment of microwave propagation in magnetron and far field formation.(a)microwave establishment insidethemagnetron;(b)farfield propagation of microwave
热疗机辐射器治疗头与皮肤间需要保持30 cm左右的距离,电磁波由球面波随着曲率的减小,变为平面波,如图2(b)所示,形成微波远场。远场(Fraunhoffer区域)电磁场能量伴随着电磁波向前传播的过程中,电场和磁场的方向与传播方向垂直,强度反比于发射距离。根据Thumb定律,微波远场指与微波源相距大于2d2/λ的微波辐射,式中的 d为辐射发射头的特征尺度。对于微波全身热疗,此临界尺度为0.0067 m,远小于热疗操作中发射探头距离,说明热疗过程中患者处于持续的微波远场辐射中。远场微波场的传播能量可由坡印亭矢量(Poynting vector)计算得出,单位为单位W/m2,其表达式为

远场中微波能量密度反比于发射距离的平方,可由此计算出位于微波远场的人体上表面能流密度

从空气到人体,两种介质之间存在强烈的反射,可以通过反射因数来刻画反射的微波功率。透射因数取决于反射截面两边的材料,其值等于反射微波强度与界面上表面入射微波强度的比值。由于微波垂直入射,反射因数可写作[15]
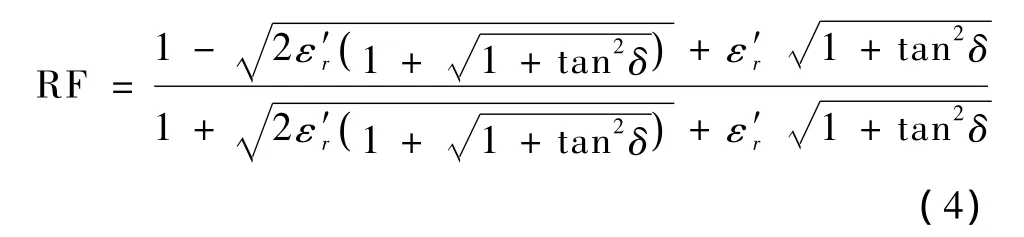
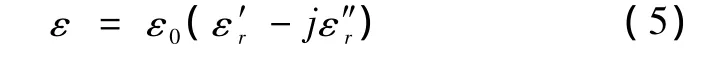
式中,ε0是自由空间的介电常数又称介电损失因数,表征了电磁波在电介质中的电磁能损失(lossiness of dialectic),即电介质吸收微波的能力。式中的 εr=又称为相对介电常数。
反射后剩余的微波能量透射进入人体,为体内微波传输的初始值

由式(3)和式(6)可以估计出进入人体后的初始场强。
1.3 微波传播理论
进入人体后的电磁波,可从基本电磁方程出发求解。在人体这一电介质空间电磁场中,Maxwell基本方程组简化为Helmholtz方程[16]

由于微波为正弦波,根据方程解的理论,对远场平面波,电磁场的完全形式可写作

式中,pd(z)是穿透深度(penetration depth),穿透深度通常可看作常数pd计算[17]

电磁场中的热量吸收通过比吸收率SAR(specific absorption rate)刻画,表示单位质量体积吸收并转化电磁能到热能的量值。对于稳态正弦电磁场SAR可写作
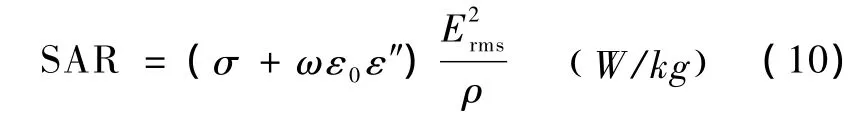
式中,Erms是电场强度有效值,由于正弦微波平方根值和最大值之间存在换算关系,因此必须严格区分两值的使用,采用平方根值可以避免计算周期平均ejωt,从而简化计算微波传播的时间特性,文中未经说明使用的电场强度均为有效值。由微波源移动产生的时间特性在此SAR基础上做随移动周期的线性而递减。本研究分析中所采用的组织电磁学参数见表1。

表1 人体组织电磁学参数Tab.1 Electromagnetic parameters of human tissue
对于移动式的微波热源,微波照射到的地方将发生热吸收,基于SAR求出体积分后可以计算人体内某一组织的总吸收

2 基于多房室异质参数的全身温度响应模型
为了描述全身热疗过程中,患者在接收微波热辐射后,身体各部分的温度响应规律,可采用房室模型的集总参数表示全身热量、代谢和温度调控的平衡。基于热量和能量平衡,本研究房室模型将全身分为12个区段,每个区段4层分别代表4种不同组织的热物性和生理参数,由外到内分别为体表、脂肪、肌肉和体核,如图1(c)所示。因此,人体的总体热行为可以通过这48个组织房室外加一个血液房室描述。48个组织房室之间的热平衡由下式表示
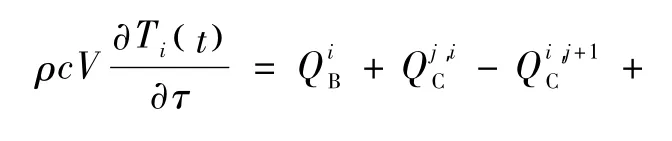

式中,ρ、c、V和 Ti分别表示第 i个房室组织的密度、比热、体积、温度;右边几项分别表示局部组织与灌注血液、相邻组织层间的热交换、代谢产热、呼吸散热、体表散热;热疗过程中经由微波探头导入体内相应房室的热量。前六项的相关计算及参数参见文献[20-21],此处不再重复。血液房室的热量平衡由其与全身各区段热交换的总和计算

热疗状态下人体除了被动维持能量平衡外,还存在体温调节系统的控制作用,通过中枢感温系统直接对人体的新陈代谢,血流量和汗液蒸发做出调整,从而将体温维持在一定的范围。人体温度控制系统中,调控的偏差信号ei定义为每一个房室当前温度相对于在基础状态下的调定温度的偏差,人体表面蒸发率、血液灌注率 ω′、代谢产热会随着偏差信号改变,见表2,详细推导可参考文献[20]。

表2 人体温度主动调节控制系统模型Tab.2 The active control model of human temperature regulation system
3 结果与讨论
3.1 热疗效果计算结果与升温特性评估
用作与计算结果对比分析的3例患者数据均来源于文献[8],系于2004年4月至2004年5月间在北京大学第一医院肿瘤中心参加全身热疗治疗的存档病例。其中,女2例(分别为43岁和60岁,患有肺癌并已发生转移),男1例(67岁,肺癌)。3例患者中,第3例男性患者首次参加热疗,热剂量适中,没有热耐受性,体型与计算模型相当,此处选为主要分析对象。
如图1(b)的计算模型所示,几何参数参见文献[20]。热疗过程中微波的发射平均功率为622.9 W,据此得出患者体表能流密度后,可由空间微波的连续性边界条件计算透射场场强。该电磁场在体内发生热吸收,相应组织的吸收可由微波传播控制方程求解式以及空间吸收的表达式(12)计算。热疗过程中微波探头以8 mm/s的速度来回在胸腹部长度为32.84 cm的区域内移动,根据远场特性忽略导入非胸腹部房室的热量,胸腹部各房室能量在一个周期移动内线性增减。热疗过程中采取冰敷进行脑保护作为向头部皮肤层注入10W冷量的外热源。将得到的所有空间热量作为外部产热代入每一房室的热量方程,49个房室的热平衡方程(包括48个房室和1个血液房室)联立求解,可以得到各个房室的初始温度值,求解结果即为设定点的温度。对于加热过程中的瞬态模型采用前向差分离散控制方程,总加热时间为9000 s,时间步长设为10 s。
图3显示了该男性患者的理论和实际温度响应。热疗中的实际测温点位于直肠末端[8],属于腹腔体核层,因此升温情况应该与该层相当。测试时为防止背景噪声干扰和异常在直肠末端放置两个独立测温探针,两测温点之间的温度基本相同;整个升温过程实测温度沿理论曲线上升的过程略有波动,尤其是在加热初期波动较明显。

图3 男性病例的直肠实测温度和腹腔体核及肌肉层预测温度Fig.3 Rectum temperature and abdomen core and muscle temperatures of the male patient
将3例患者的两个测温点的温度序列将时间平均后,再将三位患者的温度在每一时间点做统计分析,可以得到基于此三例患者的平均升温情况和偏差,如图4所示。综合评价与男性患者单一案例的评估相似,理论曲线和实测数据基本吻合,每位患者的升温初期都会有较大的体温波动。虽然理论模型对实际温度的预测性较强,还是可以发现整条理论曲线除30~60 min的部分数据点之外,无论是起点还是终点都位于实测曲线之下。这一点主要是因为人体个体差异性严重,理论模型中用到的人体电磁特性、几何尺寸和热学参数难以准确调整。其中,计算中所采用的几何参数尺寸偏大,三例患者中,最后一位为男性患者,与计算模型的几何参数基本相当,因此理论和实测最高温分别为40.7℃和40.8℃,升温幅度也基本相同,由38.1℃和38.0℃的初始温度开始变化,误差在0.01℃的量级。而对于前两位女性患者,由于其实际体积和重量均小于计算模型,获取热量后分布耗散也少,相同热量可以上升到更高的实际温度,因此出现了较大差异。热疗结束时,两位女性患者的实际体温分别可以达到41.5℃和41.1℃。

图4 3例患者温度响应统计分析与理论预测对比Fig.4 Temperature comparison between the experimentalresults of3 patients and theoretical analysis
由此可以知道,如果在采用理论模型预测前,针对每一例患者几何尺寸、电磁特性和热学参数加以调整,可以大幅提高模型预测的准确性。对于复杂的有限元模型,采集几何参数需要通过螺旋CT得到,为患者增加了时间和经济成本,而房室模型作为集总参数模型,在人体全尺寸的温度分布方面不需要局部几何细节,可以在很大程度上简化获取几何参数的步骤和成本。电磁特性的获取可以通过关键点电阻抗分析得到,一般来说这种方法是有损的,但另一方面,配合在临床中采集到的大量样本制作成数据库系统,对病例进行几何扫描和简单的参数分析后进行智能数据匹配,有可能从模型内部增加其鲁棒性,从而减少病人痛苦。
另一个给预测带来困难的原因是微波发射系统一直在伺服控制系统的调定下工作,微波实际发射功率不稳定,如图3所示。在前两例女性患者的热疗过程中,甚至有患者机体在108~124 min时出现41.6℃高温后,发射电源长达16 min被自动切断的发射间隙。
3.2 体表温度及红外热图像评估
全身热疗中部分患者皮肤各处可有不同程度的烫伤,特别是经体表加热,局部皮肤血液循环不良或散热不佳,可引起局部皮肤烫伤。穿透深度低的加热方式中,热量难以导入深部组织和较低的体核温度,而采用加大热剂量则会造成体表烫伤和脂肪组织过热。因此在对体核温度进行提高和检测的同时,对体表温度加以预测和监控也是极其重要的。红外热成像仪作为全身热疗辅助测温工具,可以精确获得体表温度。
红外图像给出了直观的体表温度分布情况,临床医师可由此根据温标的最高值和高温区大致确定体表的热状态。但为了对图像进行计算,还必须提取出目标器官单位面积上有效的温度信息进行加权

为此,首先必须将目标器官的图像提取出,根据红外温标的编码规则,将背景定义为最低温度,以避免在随后的计算中影响结果。如图5所示,获得的红外图像通过RGB图像编码空间的颜色分配表对温度进行定标显示,编码区间由黑色的最低温到红色的最高温。处理中,首先需要提取出目标组织的信息;其次,根据编码规则将图像转化为 HSV编码,进一步提取出与温度一一对应的亮度信息。原始的RGB编码图像通过R、G、B三个通道的二维数据存储图像,任何一个通道的图像均与温度值没有对应关系。而HSV编码中,通过等自由度的H、S、V三个通道二位数据存储,可以得到等信息量的与温度对应的图像亮度信息,温度越高,亮度值愈大。与此同时,由于原采得红外图像为线性定标,根据原图像的温度区间可以换算出目标器官表皮的温度平均值。
分别对手部和足部的红外图像进行评估,得到热疗前后手部平均温度由26.8℃变为25.7℃,相应的足部温度由27.6℃变化为28.8℃,温度变化趋势和幅度和人眼直观判断一致。这样处理的好处有:红外图像的采集通常采用平面CCD系统,采集图像的时间长,极易产生运动伪影,运动伪影部分在边界低温区尤其明显,产生的画质一般不高。区域加权后由于伪影数据点的这种低温特性使得评估性能受伪影负面影响大幅度降低。受CCD成像特性的制约,目标器官区域边缘物体发射率低,使图像评估结果往往比真实平均体表温度略低,但并不影响热疗前后、不同身体部位红外图像之间的数据比对。在需要和一般温度数据进行比对的情况下,可以通过对评估结果增加一定平台期温度来实现。

图5 手部目标组织红外图像(温标单位:℃,数据取自文献[8])。(a)热疗前;(b)热疗后Fig.5 Infrared thermalimageofhand segment(Unit:℃),data from[8]).(a)before hyperthermia;(b)after hyperthermia
图6是根据预测模型得到的面部、胸部和足部皮肤的理论温度响应。这三个体表温度的变化分别表示了热疗过程中三种典型的体表温度行为:(1)脸部由于采取主动降温,平均温度由36.4℃ 降低到了35.0℃,有1.4℃的平均降温,与红外热图1.2℃的变化差异在误差范围内;且变化趋势均匀,在热疗过程中曲线没有拐点。(2)胸部皮肤一开始受到了大量微波辐射和强烈的热作用,因此在20 min内温度迅速上升,然而随着散热机制被调动,曲线依次出现拐点和极点,在加热695 s时出现最高温度35.6℃,进而在外部热源和散热机制的制衡中,伴随着患者的大量出汗,在热疗结束后最终温度为35.4℃。(3)在末梢循环不畅的足部,由于自我调节机制缺乏,因此温度在热疗过程中一直上升,由35.2℃到37.1℃,发生了1.9℃的平均升温;虽然在热疗初期,足部远离因加热作用点而出现明显迟滞,但在后期却因毛细血管扩张有限,微循环受限而散热不佳。对比红外评估中,足部1.2℃的平均增温,可能的原因是受评图像的伪影明显,虽然红外评估结果仍可以反映大致趋势,但在做精确定量评估时还是会受影响。

图6 局部皮肤的理论温度响应Fig.6 Theoretical temperature response of local skin
值得注意的是,虽然根据红外图像,脸部温度明显降低,但这并不意味着颅腔内组织有效的降温。理论计算中,颅内脂肪层和肌肉层温度有所降低,但颅内软组织温度一直在升高。事实上,考虑到脑内没有有效的散热机制,血脑屏障虽然阻挡了传质,却无法有效阻挡传热,仅仅靠冷敷时体表由内而外的热传导和微量对流散失热量,内层组织的升温是制约全身热疗的大剂量输送的重要因素。因此,仅仅靠红外成像仪对体表温度进行监测和少数点的温度采集是远远不够的,全身热疗需要更加精准的温度刻画和控制来确保其有效性和安全性,也说明了建立从热疗机制到温度分布重建的高效模型的必要性和紧迫性。
4 结论
本研究从移动式微波全身热疗系统的微波发射机理出发,分析了微波场的发射和传输特性,以及和人体的作用效果及热转化机制,进而对人体内温度分布和预测提出了理论模型。从理论分析和计算的过程知道,一定剂量的微波会因为人体的介电特性被吸收,从电磁能的形式转变为体内热能。热量进而在人体热物理特性和主动生理调控的作用下在全身范围内带来温升。
人体作为一个大系统,对整体热行为,房室模型是一个很好的定量化预测手段,可以在热疗实施前期采集重要患者信息,如几何尺寸和物理参数,再经微波物理场的分析之后,通过房室模型预示出全身各组织、器官的温度分布,从而可以有效的评估各敏感部位的温度,同时也便于与实验值对比剖析,是一种十分重要的辅助临床治疗和检测的方法。在此基础上,医师们可在临床实践中有计划的采集所需数据,建立、完善相应数据库和病例系统,为更好的实施全身热疗做指导。
[1]Calderwood SK,Khaleque MA,Sawyer DB,et al.Heat shock proteins in cancer:chaperones of tumorigenesis[J].Trends in Biochemical Sciences,2006,31(3):164-172.
[2]Kleef R,Jonas WB,Knogler W,et al.Fever,cancer incidence and spontaneousremissions [J]. Neuroimmunomodulation,2001,9(2):55-64.
[3]Reiter B,Kleef R.Hyperthermia-symposium on occasion of the 80th annual congress of the conference of Nobel Prize for medicine[J].Advanced Complimentary Medicine,2007,14(6):365-370.
[4]Snyder SA,Dewhirst MW,Hauck ML.The role of hypoxia in canine cancer [J].Veterinary and Comparative Oncology,2008,6(4):213-223.
[5]Hiraoka M,Hahn GM.Comparison between tumor pH and cell sensitivity to heat in RIF-1 tumors [J].Cancer Research,1989,49(14):3734-3736.
[6]Bezabeh T,Evelhoch JL,Thompson P,et al.Therapeutic efficacy as predicted by quantitative assessment of murine RIF-1 tumourpH and phosphorous metabolite response during hyperthermia:an in vivo 31 P NMR study[J].International Journal of Hyperthermia,2004,20(4):335-357.
[7]Spees WM,Evelhoch JL,Thompson PA,et al.Defining the pH(i)-hyperthermia sensitivity relationship for the RIF-1 tumor in vivo:A P-31 MR spectroscopy study[J].Radiation Research,2005,164(1):86-99.
[8]吕永钢,刘静,闫井夫.红外热图监测微波辐照式全身热疗中体表温度的变化[J].中国组织工程研究与临床康复,2007,11(35):7019-7023.
[9]Metaxas AC,Meredith RJ.Industrial microwave heating[M].London:Peter Peregrinus Ltd.,1983.
[10]王祝盈,翦知渐.大功率微波热疗机输出功率的PID控制[J].电子技术应用,2001,27(3):40-42.
[11]牛斌,孙永志,陈冬冬,等.高功率微波源功率输出自动控制系统[J].电子器件,2006,29(1):279-281.
[12]林志宏.微波热疗机模糊控制器设计[J].真空电子技术,2000,2(2):15-20.
[13]王祝盈,董卉慎,刘珈,等.肿瘤热疗技术中平面电磁波与人体相互作用的研究[J].北京生物医学工程,2006,25(3):288-292.
[14]Durney CH, Christensen DA. Basic introduction to bioelectromagnetics[M].Boca Raton:CRC Press,2000.169.
[15]Curet S,Rouaud O,Boillereaux L.Microwave tempering and heating in a single-mode cavity:Numerical and experimental investigations[J]. ChemicalEngineering and Processing:Process Intensification,2008,47(9-10):1656 -1665.
[16]Rattanadecho P.Theoretical and experimental investigation of microwave thawing of frozen layer using a microwave oven(effects of layered configurations and layer thickness)[J].International Journal of Heat and Mass Transfer,2004,47(5):937-945.
[17]Akkari E,Chevallier S,Boillereaux L.A 2D non-linear“greybox”model dedicated to microwave thawing:Theoretical and experimental investigation [J]. Computers and Chemical Engineering,2005,30(2):321-328.
[18]Taoukis P,Davis EA,Davis HT,et al.Mathematical modeling of microwave thawing by the modified isotherm migration method[J].Journal of Food Science,1987,52(2):455 -463.
[19]Saito K,Taniguchi T,Yoshimura H,et al.Estimation of SAR distribution of a tip-split array applicator for microwave coagulation therapy using the finite element method[J].IEICE Transactions on Electronics,2001,84(7):948-954.
[20]Xiang Shihai,Liu Jing. Comprehensive evaluation on theheating capacities of four typical whole body hyperthermia strategies via compartmental model[J].International Journal of Heat and Mass Transfer,2008,51(23-24):5486 -5496.
[21]项士海.基于血管介入技术的肿瘤全身热疗方法研究[D].北京:中国科学院理化技术研究所,2008.173.

