猪圆环病毒2型Cap蛋白在杆状病毒表面的展示
邢福珊,许信刚,童德文,王志昇,张彦明
(西北农林科技大学动物医学院,陕西杨凌712100)
猪圆环病毒2型(porcine circovirus type 2,PCV2)是断奶仔猪多系统衰竭综合征(post-weaning multisystemic wasting syndrome,PMWS)的主要病原。PCV2可以引起断奶仔猪发生衰竭、死亡,还与仔猪先天性震颤(CT)、成年猪皮炎肾炎综合征(PDNS)和呼吸道疾病综合征(PRDS)有关。PCV2基因组为环状、单链DNA,全长1 767 bp~1 768 bp,PCV2基因组含有11个ORF,分别命名为ORF1~ORF11。研究表明,ORF2编码病毒的核衣壳蛋白(Cap),是主要的免疫原,能诱导中和抗体的产生[1],对猪圆环病毒疫苗的研究有较大的意义。杆状病毒对昆虫细胞的吸附和侵入与病毒的囊膜糖蛋白gp64有重要关系。gp64由N-末端信号肽和成熟蛋白(跨膜区TM和胞质区CTD)组成[1]。gp64被开发成杆状病毒表面展示系统来展示不同的目的蛋白,外源基因片段插入到病毒囊膜蛋白的信号肽与成熟蛋白之间,表达加工时信号肽被切除,形成的N端融合蛋白借助杆状病毒稳定地表达并展示于感染细胞或病毒粒子的表面,筛选得到表达有目的蛋白的重组杆状病毒。目前,杆状病毒表面展示系统已经被开发用于进行基因工程亚单位疫苗的研制[2-3]。本试验基于Cap蛋白是PCV2的主要免疫原,以杆状病毒表面展示系统构建表达PCV2 Cap蛋白的重组杆状病毒,免疫金电子显微镜检测重组Cap蛋白在杆状病毒的囊膜上进行了展示,为进一步研究猪圆环病毒亚单位疫苗奠定了基础。
1 材料与方法
1.1 质粒、菌株、病毒和细胞 含有PCV2 ORF2基因的质粒pGEM-ORF2由西北农林科技大学动物医学院兽医病理学实验室分离/克隆并保存;pGEM-T购自 Promega公司;表面展示转座载体pBacSC、Sf9细胞、大肠杆菌 DH 10Bac(Gibco-BRL)、大肠杆菌DH5α由西北农林科技大学动物医学院兽医病理学实验室保存并提供。
1.2 主要试剂 PCV2阳性血清由中国动物卫生与流行病学中心惠赠;HRP标记羊抗猪IgG、胶体金标记的兔抗猪IgG,Cellfectin转染试剂购自Invitrogen公司;各种内切酶、T4 DNA 连接酶、Taq DNA多聚酶、d NTP购自Promega公司;昆虫细胞培养基TNM-FH购自Sigma公司;胎牛血清GIBCOBRL公司。其他试剂均为国产分析纯。
1.3 实验动物 6周龄雌性BALB/c小鼠购自于解放军第四军医大学实验动物研究中心。
1.4 重组转座质粒p BacSC-ORF2的构建和筛选以pGEM-ORF2为模板,PCR扩增ORF2基因。上游引物P1 5′-GCTCTCGAGATGAATGGCATC TTC-3′(下划线为 Xho I酶切位点),下游引物 P2 5′-GGGCTGCAGAAGTGGGGGGTCTTTAAG-3′(下划线为Pst I酶切位点)。扩增片段为579 bp,扩增的片段为缺失N端的41个氨基酸的核定位信号区的ORF2基因。PCR产物双酶切回收后定向插入转座载体p BacSC的限制性酶切位点处,得到重组转座载体p BacSC-ORF2。将此质粒转化大肠杆菌DH5α工程菌,进行筛选鉴定,并对重组质粒中的ORF2基因进行序列测定。
1.5 重组杆状病毒的获得与鉴定 重组质粒的转座、DH 10Bac阳性菌落的筛选与纯化、重组杆状病毒DNA的提取、转染、PCR模板的制备、重组病毒的扩增、病毒滴度测定均按照Invitrogen公司Bacto-Bac表达系统操作手册进行。以上过程均以不含ORF2基因的转座质粒pBacSC作为阴性对照。重组蛋白杆状病毒命名为 BacSC-ORF2,而不含ORF2基因转座质粒pBacSC得到的重组杆状病毒命名为BacSC。
1.6 重组杆状病毒的纯化及Western-blot检测重组病毒感染Sf9细胞,收获重组杆状病毒。病毒的纯化用蔗糖密度梯度超速离心法,具体参考文献[4]的方法进行,纯化后的病毒进行 Western-blot检测分析。第一抗体为猪抗PCV2阳性血清(1∶500),第二抗体为 HRP标记羊抗猪 IgG(1∶4 000)。最后暗房进行底物化学发光(ECL)法反应,胶片显影分析。
1.7 重组杆状病毒的免疫电镜(IEM)分析 纯化的重组杆状病毒进行免疫电镜分析,具体操作参考文献[4]方法进行。第一抗体为猪抗PCV2阳性血清(1∶100),第二抗体为胶体金标记兔抗猪 IgG(1∶100)。
2 结果与分析
2.1 重组转座载体的构建和筛选 重组质粒p BacSC-ORF2经双酶切后得到大约6 800 bp和579 bp 2个片段,分别与载体和去掉核定位信号区ORF2基因长度一致(图1)。测序结果表明,载体p BacSC和ORF2基因接头连接处正确,大小和读码框架正确完整。
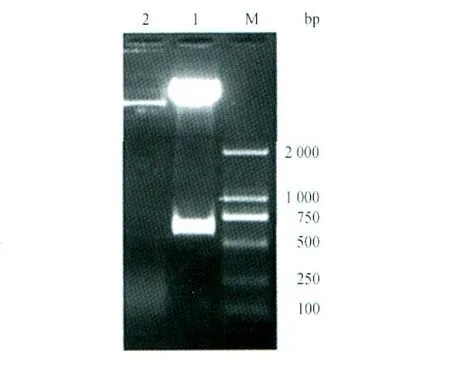
图1 重组质粒p BacSC-ORF2的酶切鉴定
2.2 重组杆状病毒的获得 重组转座载体p Bac-SC-ORF2转化大肠杆菌DH 10Bac进行同源重组,经过“三抗”平板3轮筛选,然后提取重组DNA,用脂质体转染试剂盒转染 Sf9昆虫细胞。转染3 d后,Sf9细胞出现明显的CPE变化,细胞裂解、死亡,说明产生了具有感染活性的重组杆状病毒。
2.3 重组杆状病毒的Western-blot检测重组杆状病毒纯化后Western-blot检测结果见图3。由图3可见,抗PCV2阳性血清检测到大约为 27 ku的Cap蛋白,表明 Cap蛋白在重组杆状病毒中成功表达。
2.4 免疫电镜分析Cap蛋白在杆状病毒囊膜上的展示 免疫电镜分析结果见图4,金粒子结合到重组杆状病毒的囊膜上(图4B,箭头所示),而阴性重组杆状病毒对照组没有金粒子结合(图4A),表明Cap蛋白在重组杆状病毒囊膜上得到展示。

图2 脂质体介导的重组DNA转染Sf9细胞后出现的CPE

图3 Western-blot分析纯化重组杆状病毒
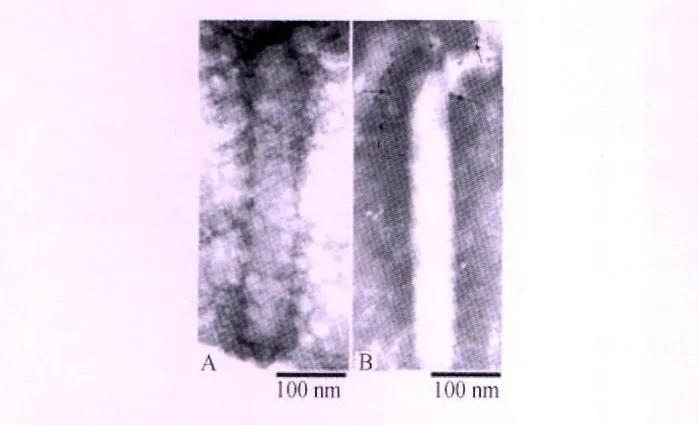
图4 免疫电镜分析Cap蛋白在重组杆状病毒囊膜上的展示
3 讨论
目前PCV2在世界范围内广泛存在,由其引发的疾病给养猪业带来巨大的经济损失。PCV2商品化疫苗主要有全病毒灭活苗和亚单位疫苗,在我国还未见关于防治该病疫苗已商品化的报道。由于体外培养PCV 2比较困难,病毒培养成本高、周期长[5],因此发展传统的灭活疫苗前景不大,亚单位疫苗是PCV2疫苗研究的方向[5],但是传统的杆状病毒表达系统产生的目的蛋白质只能分泌到培养基上清中,目的蛋白的纯化非常费时费力,纯化费用昂贵,不能大规模化生产。人们迫切希望找到一种同时提供表达量大、蛋白活性高、易于纯化、易于规模化生产的新型疫苗来预防和控制PCV2的流行。杆状病毒表面展示系统可以用来解决目的蛋白纯化代价昂贵、程序复杂的问题。用杆状病毒表面展示系统生产目的蛋白,纯化过程特别简单,只需要超速离心得到重组杆状病毒即可同时获得目的蛋白,纯化费用低、操作简单、可以规模化生产,解决目前蛋白纯化费时费力,代价昂贵的现状[6]。
PCV2的ORF2基因编码病毒的核衣壳(Cap)蛋白具有良好的免疫原性,是构建重组疫苗的首选基因。本试验将PCV2 Cap蛋白插入到杆状病毒表面展示转座载体中,感染Sf9细胞,获得重组杆状病毒BacSC-ORF2。用重组病毒BacSC-ORF2感染Sf9细胞后,收获重组杆状病毒,进行Western-blot检测,能够检测到Cap蛋白的表达。免疫胶体金电子显微镜检测更直接的观察到金粒子展示在重组杆状病毒的囊膜上,这说明Cap蛋白最终是定位展示在重组杆状病毒粒子囊膜上。表面展示有PCV2 Cap蛋白的重组杆状病毒的成功构建,为猪圆环病毒病基因工程亚单位疫苗的研发奠定了基础。
[1] Rumenapf T,Stark R,Meyers G,et al.Structural proteins of hog cholera virus expressed by vaccinia virus:further characterization and induction of p rotective immunity[J].J Virol,1991,65(2):589-597.
[2] Van Zijl M,Wensvoort G,de Kluyver E,et al.Live attenuated pseudorabies virus expressing envelope glycoprotein E1 of hog cholera virus protectsswine against both pseudorabies and hog cholera[J].JVirol,1991,65(5):2761-2765.
[3] König M,Lengsfeld T,Pauly T,et al.Classical swine fever virus:independent induction of proteciveimmunity by two structural glycoproteins[J].JVirol,1995,69(10):6479-6486.
[4] Yang D G,Chung Y C,Lai Y K,et al.Avian influenza virus hemagglutinin display on baculovirus envelope:cytoplasmic domain affects virus properties and vaccine potential[J].Mol Ther,2007,15(5):989-996.
[5] 赵东升,刘有昌,林亲广,等.猪圆环病毒 2型疫苗的应用现状[J].养猪,2009,2:62-64.
[6] 许信刚,童德文,刘宏仁.猪瘟病毒囊膜蛋白在杆状病毒表面的展示及展示蛋白的免疫原性试验[J].西北农林科技大学学报:自然科学版,2009,37(12):73-79.

