中药复方对热刺激大鼠空肠热休克蛋白70的影响
董 虹,杨 凯,程 飞,余 进,刘凤华,许剑琴
(1.北京农学院兽医学(中医药)北京市重点实验室,北京昌平102206;2.北京农学院 农业应用新技术北京市重点实验室,北京昌平102206;3.北京农学院动物科技系,北京昌平102206;4.中国农业大学动物医学院,北京海淀100193)
应激状态下,机体将发生一系列保护性反应,热休克基因的激活和表达所产生的热休克蛋白(heat shock protein,HSP)作为“分子伴侣”而参与蛋白质的折叠、转位及生物合成等过程,使细胞和机体产生热耐受。高温刺激后,随着机体受热时间的延长,各组织细胞受不同程度的热作用后均有HSP的合成,其中以Hsp70的合成量最多,其合成量与受热程度和受热时间有关。随着Hsp70的增多,细胞存活率增高,受损减轻,这显示出 Hsp70对细胞的保护作用。Hsp70增加有助于机体尽可能快地获得热适应,增强热耐受力[1]。由石膏、苍术、黄柏、藿香组成的抗热应激中药复方,具有清热泻火、解暑和中、燥湿健脾之功效,用于防治动物在夏季高温高湿环境感受湿热之邪后出现的湿热证[2-4]。本文从分子和蛋白水平检测了该方对Hsp70表达的影响,以期探讨该方的抗热应激机理。
1 材料与方法
1.1 中药复方 藿香(Herba Agastachis)、苍术(Rhizoma Atractylodis)、黄柏(Cortex Phelloden-dri)、石膏(Gypsum Fibrosum)按 1∶1∶1∶0.5比例组成,自制合剂。
1.2 实验动物 SD大鼠30只,200±20 g,雌雄各半,购自北京维通利华实验动物技术有限公司。随机分为对照组、热应激组和中药组,每组各10只。对照组和热应激组大鼠按3.0 mL/只灌服灭菌生理盐水,中药组按3.0 mL/只(6.25 g/kg体重)灌服给药,连续5 d,第5天,热应激组和中药组大鼠放于人工气候仓中进行热应激处理,热应激条件为41℃,60%湿度,2 h后大鼠脱颈椎处死,分离空肠组织,用预冷的生理盐水冲洗干净后,液氮速冻,-80℃保存备用。
1.3 Real-time PCR检测Hsp70的表达
1.3.1 总RNA提取及RT-PCR 按照TRIZOL总RNA提取试剂盒说明书提取空肠组织中的RNA,提取完成后,用紫外分光光度计检测RNA的纯度,1.2%甲醛变性胶电泳检测其完整性。RNA检测合格后用M-MLV反转录酶合成cDNA:取2.0μL Oligo-d T18(10 mmol/L)与 2.0μL d NTPs(10 mmol/L)加入到有2.0μL RNA(1μg/μL)的0.2 mL Eppendof管中,75℃变性 5 min,立即置冰上冷却。然后每管中加入2.0μL M-MLV反转录酶(200 U/μL),8.0μL 5×反转录酶反应缓冲液(10 mmol/L),0.8μL RNA 酶抑制剂(50 U/μL),用灭菌的0.1%DEPC处理水补足总体积至40μL 37℃反应2 h,95℃灭活反转录酶5 min,立即使用或-20℃保存。
1.3.2 荧光定量PCR 根据Genbank提供的序列,引物使用Primer premier 5.0设计,由上海生工生物工程技术服务有限公司合成,引物参数见表1。应用Stratagene公司的荧光定量PCR试剂,反应体系如下:cDNA:1.0 μL,引物1.0 μL,Briliant SYBR Green QPCR master Mix:10 μL,补水至 20 μL,每组3个重复。反应条件:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸40 s,40个循环。溶解曲线条件为:95℃1 min,56℃30 s,95℃30 s。各基因的表达水平由β-actin进行均一化,ΔΔCT法检测实时定量PCR试验中Hsp70基因在各组表达的相对差异。

表1 引物序列
1.4 Hsp70在空肠组织中的蛋白表达 根据凯基全蛋白提取试剂盒(南京凯基生物)从100 mg空肠组织中提取总蛋白,样品-80℃保存备用;按照Hsp70检测试剂盒(美国 RB)说明,采用双抗夹心ELISA法,利用核酸检测蛋白仪(美国 BIO-RAD)检测大鼠空肠组织总蛋白中 Hsp70蛋白的表达。用Hsp70蛋白表达和总蛋白的比值代表Hsp70在空肠组织中的表达。
1.5 数据统计 SPSS 10.0统计软件One-way ANOVA分析。
2 结果
2.1 大鼠临床症状及体温变化 对照组大鼠在整个热应激试验期间,精神状态良好,食欲正常及活动正常;热应激组大鼠在热应激过程中表现精神烦躁不安,大量出汗以致浑身湿透,且张口呼吸,饮水增加,食欲减少;中药组大鼠在热应激过程中也表现出烦躁不安,饮水增加,头及全身出汗。应激后立即测大鼠肛温、体温均升高,超过了40℃,和对照组比较差异均极显著,说明均达到了高温刺激的效果。结果见表2。

表2 大鼠热应激后肛温变化
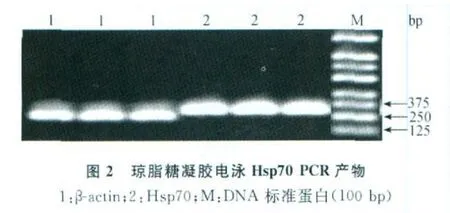
2.2 空肠组织Hsp70 mRNA的表达变化 Hsp70的溶解曲线峰值在90℃,β-actin的溶解曲线峰值在86℃,两个曲线的溶解温度均一,峰的形状也较锐利,见图1A。其PCR产物经2%琼脂糖凝胶电泳后所得产物是目的条带,见图2。从图B可以看出,与对照组相比,热应激组和中药组大鼠空肠组织中Hsp70 mRNA的表达均显著升高(P<0.01),且中药组和热应激组比较差异显著(P<0.01)。
2.3 空肠组织中Hsp70的蛋白表达 从图3可以看出,与对照组相比(7.37±2.12),热应激组(8.65±3.01)和中药组(11.22±2.04)大鼠空肠组织中Hsp70蛋白表达显著升高(P<0.01),且中药组显著高于热应激组(P<0.01)。
3 讨论
热刺激HSP是一组生物体在应激情况下由热休克基因所编码合成的序列,能对抗更为严重的应激损伤。Hsp70是HSP中最保守和最重要的HSP家族。一般认为,Hsp70可以通过分子伴侣、抗氧化作用、协同免疫等作用增强热耐受性[5]。由于Hsp70的多功能性,因此如何通过药物作用增强Hsp70 mRNA的转录已成为当今研究的热点。陈威巍等[6]研究发现,运动颗粒(主要成分为红参、黄芪、红景天等)可增强热适应机体肝与心肌细胞Hsp70的表达强度,减轻热适应和应激组机体的热损伤。马得莹等[7]研究显示,女贞子、五味子和四君子汤都能显著提高热应激蛋鸡肝脏Hsp70基因表达,从而达到抗热应激的作用,本试验证明,自制中药复方不仅能提高 Hsp70 mRNA的表达,也能提高Hsp70的蛋白表达。

图1 中药复方对Hsp70 mRNA表达的影响

环境高温高湿所产生的热应激在中医理论中属温热症,因此用药上以清轻凉润、甘寒、咸寒为主,分别采用解表、清热、凉血、滋阴等方法。本试验采用中药复方由石膏、苍术、黄柏、藿香组成,方中石膏清热泻火,解热镇痛,利尿利胆,苍术燥湿健脾;黄柏清湿热、泻火毒,有利胆、利尿、扩张血管等作用;藿香芳香化湿[8]。四药合用具有清热泻火、解暑和中、燥湿健脾功效的功效。前期试验研究已证明,本中药复方能缓解高温导致的猪和鸡的热应激反应[2-4]。本研究结果表明,中药复方抗热应激的原理,可能是诱导体内Hsp70的蛋白和基因的高表达,Hsp70再启动一系列反应而达到抗热应激的作用。
[1] Feder M E,Hofmann G E.Heat-shock p roteins,molecular chaperones,and the stress resp onse:evolutionary and ecological phy siology[J].Annu Rev Physiol,1999,61:243-282.
[2] 刘凤华,许剑琴,胡艳欣,等.清凉冲剂对鸡肠黏膜IgA~+的动态影响[J].中国兽医学报,2006,26(5):525-527.
[3] 王自力,于同泉,朱晓宇,等.中药复方对热应激下猪肠道组织IL-2,IL-10和黏液IgA含量影响[J].中国兽医杂志,2007,43(9):83-85.
[4] 宋小珍,鲁琳,刘凤华,等.高温应激对仔猪小肠上皮脂质过氧化的动态影响[J].动物营养学报,2008,20(1):75-79.
[5] Boshoff T,Lombard F,Eiselen R,et al.Diferential Basal Synthesis of HSP70/Hsc70 Contributes to Interindividual Variation in HSP70/Hsc70 inducibility[J].Cell Mol Life Sci,2000,57(8-9):1317-1325.
[6] 陈威巍,朱国标,胡宗海.运动颗粒对热适应+应激大鼠的保护作用与热休克蛋白70表达的关系[J].成都中医药大学学报,2002,25(3):62-66.
[7] 马得莹,单安山.几种中草药抗蛋鸡热应激作用分子机制的初步研究[J].动物营养学报,2007,19(3):283-288.
[8] 朱惠京,张红英,马玉莲,等.关苍术正丁醇萃取物对大鼠心肌缺血及缺血-再灌注损伤的保护作用[J].中国中医药科技,2000,7(3):173-174.

