兰索拉唑肠溶微丸胶囊的制备
张倩,张晶,周欣,阙剑云,于西全,宋洪涛#(1.福建医科大学药学院,福州市50004;.南京军区福州总医院药学科,福州市 5005;.厦门大学医学院药学系,厦门市 61005)
兰索拉唑肠溶微丸胶囊的制备
张倩1*,张晶2,周欣2,阙剑云3,于西全2,宋洪涛2#(1.福建医科大学药学院,福州市350004;2.南京军区福州总医院药学科,福州市 350025;3.厦门大学医学院药学系,厦门市 361005)
目的:制备兰索拉唑肠溶微丸胶囊。方法:采用流化床包衣技术,在空白丸芯上依次包以主药层、隔离层和肠溶层,制备成兰索拉唑肠溶微丸,将肠溶微丸装入普通胶囊制成兰索拉唑肠溶微丸胶囊,并考察3批制剂的载药率及在人工肠液和人工胃液中的释放情况。结果:所制微丸圆整度高,外观亮泽,载药均匀、载药率高(平均值在96%以上),包衣效果好;其在人工肠液中45min的体外累积释放率大于(94.3±0.76)%,在人工胃液中2h的释放量小于(6.2±1.6)%。结论:所制兰索拉唑肠溶微丸胶囊工艺可行,重现性良好,质量稳定可靠,具有良好的体外释药性和耐酸力。
兰索拉唑;肠溶微丸胶囊;制备;流化床包衣;释放
兰索拉唑(Lansoprazole)是第2代质子泵抑制剂,可选择性、非竞争性地抑制胃壁细胞中的质子泵H+/K+-(三磷酸腺苷)ATP酶,从而阻断胃酸分泌的终末环节,产生强烈而持久的抑酸作用[1]。本品为弱碱性苯并咪唑类化合物,对湿、热、光不稳定,特别是在酸性溶液中降解更快[2,3]。目前上市的兰索拉唑口服制剂有肠溶片以及采用肠溶胶囊壳分装药物粉末而制备的普通肠溶胶囊,这2种剂型均存在以下缺点:一旦肠溶衣或胶囊壳破损将失去其肠溶作用,导致药物在胃液中释放并降解,从而降低或失去药效,并增加副作用的发生。而肠溶微丸具有优越的制剂学性质,个别微丸的损坏不会影响整体制剂的释药性质,可以克服上述2种剂型的缺点,且目前尚未见有关兰索拉唑肠溶微丸制剂的报道。本试验采用流化床包衣技术制备了兰索拉唑肠溶微丸胶囊,并对制剂处方和工艺进行了优化。
1 仪器与试药
UV-2501型紫外分光光度计(日本岛津公司);FA1004型电子天平(上海天平仪器厂);HJ-180-GC型多功能制粒包衣机(重庆荣凯机械制造有限公司);ZRS-6型智能药物溶出仪(天津大学无线电厂)。
兰索拉唑标准品(中国药品生物制品检定所,批号:100709-200501,供含量测定用);兰索拉唑原料药(桂林华信制药有限公司,批号:080102,含量:99.0%);兰索拉唑肠溶微丸胶囊(福建医科大学药学院,规格:每粒30mg);空白丸芯(杭州高成生物营养技术有限公司,粒径:1.0mm);羟丙基甲基纤维素(HPMC,山东泰安瑞泰纤维素有限公司,黏度:5mPa·s)。
2 方法与结果
2.1 兰索拉唑含量测定方法学考察
2.1.1 线性范围。称取兰索拉唑标准品(按无水物计算)约10mg,精密称定10.1mg,置于100mL容量瓶中,加甲醇溶解,并稀释至刻度,摇匀。分别精密量取上述溶液0.3、1.0、2.0、3.0、5.0、6.0mL置于25mL容量瓶中,加甲醇稀释至刻度,摇匀,得到质量浓度分别为 1.21、4.02、8.04、12.06、20.10、24.12μg·mL-1的标准品溶液。照紫外-可见分光光度法,于284nm波长处测定各溶液的吸光度[4],以吸光度A对浓度C(μg·mL-1)进行线性回归,得回归方程:A=0.025C+0.143(r=0.9999)。结果表明,兰索拉唑检测浓度线性范围为1.21~24.12μg·mL-1。
2.1.2 精密度试验。取“2.1.1”项下标准品溶液(20.10μg·mL-1)于284nm波长处测定其吸光度,重复测定6次,结果RSD=0.06%,表明精密度良好。
2.1.3 回收率试验。取兰索拉唑标准品约10.0、12.5、15.0mg各3份,精密称定,分别置于100mL容量瓶中,分别加入空白丸芯90.0、112.5、135.0mg,再加入甲醇适量,超声完全溶解后定容,于284nm波长处测定兰索拉唑吸光度。结果平均回收率为99.6%,RSD=0.99%,表明回收率较高,方法可靠。
2.1.4 稳定性试验。取“2.2”项下供试品溶液分别在0、0.5、1.0、2.0、3.0、4.0、6.0、8.0h时于284nm波长处测定吸光度,结果其RSD=0.19%。表明供试品溶液在8h内稳定。
2.2 体外释放度的测定
取兰索拉唑肠溶微丸胶囊,照《中国药典》2005年版二部附录ⅩD溶出度测定法第一法装置进行试验。以盐酸溶液(9→1000,模拟的人工胃液)1000mL为溶出介质,温度37℃,转速100r·min-1,在2h时,立即将转篮升出液面,将盐酸溶液弃去,随即移入预先热至37℃的pH 6.8的磷酸盐缓冲液(PBS,模拟的人工肠液)1000mL,继续依法操作,定时吸取溶出液20mL,滤过,精密量取续滤液10mL至20mL棕色容量瓶中,用pH 6.8的PBS稀释至刻度,摇匀,得供试品溶液,于284nm波长处测定吸光度;另精密称取兰索拉唑标准品15mg,置于20mL棕色容量瓶中,加甲醇溶解并稀释至刻度,摇匀;取2.0mL,置于100mL棕色容量瓶中,加pH 6.8的PBS稀释至刻度,摇匀,于284nm波长处测定吸光度,计算每粒的释放度,限度为标示量的75%[5]。
2.3 酸中释放量的测定
以盐酸溶液(9→1000)1000mL为溶剂,温度37℃,转速100r·min-1,在2h时,立即将转篮升出液面,取残留颗粒,用水洗净表面的盐酸溶液,用滤纸吸干,置于100mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,滤过,精密量取续滤液1.0mL,置于20mL棕色容量瓶中,用甲醇稀释至刻度,摇匀,作为供试品溶液;另精密称取兰索拉唑标准品适量,加甲醇溶解并定量稀释成每1mL中约含15μg的溶液,作为标准品溶液。在284nm波长处测定吸光度,计算每粒的含量A,(1-A)即为酸中释放量,应不得大于标示量的10%[5]。酸中释放量越小表明制剂的耐酸力越强。
2.4 肠溶微丸的制备
2.4.1 主药层包衣。取纯化水适量,搅拌下,缓慢加入处方量HPMC作为黏合剂,溶解完全后,分别依次加入处方量无水碳酸钠作为酸碱调节剂,加入聚山梨酯-80作为增溶剂,溶解完全后再加入二甲基硅油作为助悬剂,避光加入处方量的兰索拉唑,将纯化水加至足量,搅拌得均匀的混悬液。取1kg空白丸芯置于流化床包衣装置中进行底喷上药包衣。进风温度50℃,雾化压力Ⅰ0.2MPa,雾化压力Ⅱ0.05MPa,物料温度36~40℃,喷浆速度3.0mL·min-1。
经预试验,确定以对载药微丸载药率影响较大的HPMC用量(A)、二甲基硅油用量(B)及聚山梨酯-80用量(C)为考察因素,以兰索拉唑的载药率(载药率(%)=微丸含药量×微丸重量/投药量×100%)作为评价指标,每个因素设计3个水平,选用L9(34)正交试验表进行试验。因素水平表见表1,正交试验结果及方差分析见表2、表3。

表1 因素水平表Tab 1Factors and levels
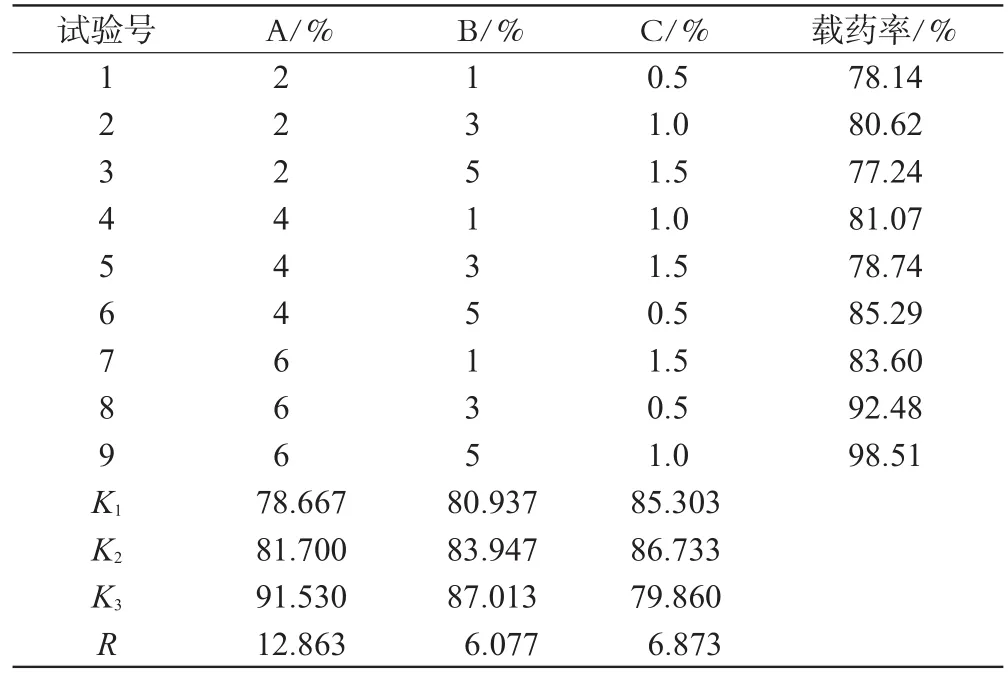
表2 正交试验结果Tab 2 Results of orthogonal test

表3 方差分析结果Tab 3 Results of analysis of variance
由表2直观分析和表3方差分析结果可知,影响因素的主次顺序为A>C>B,其中因素A具有显著性差异。据此确定最优处方为A3B3C2,即处方组成为HPMC 6%、二甲基硅油5%、聚山梨酯-801.0%。
按最佳处方配制主药层包衣液,制备3批样品,所得载药微丸的载药率分别为97.7%、96.4%、96.8%,载药率较高,批间差异较小,表明正交试验优化的处方较佳。
2.4.2 隔离层包衣。取纯化水适量,搅拌下,缓慢加入处方量的HPMC,放置至溶解,加水至足量,配制成浓度为5%的溶液。加入0.1%的无水碳酸钠,充分溶解,再加入1%药用微粉化二氧化钛,搅拌使其成均匀的混悬液,即得碱性隔离层包衣溶液。取上述兰索拉唑载药微丸置于流化床包衣装置中进行底喷包衣。进风温度50℃,雾化压力Ⅰ0.2MPa,雾化压力Ⅱ0.05MPa,物料温度36~40℃,喷浆速度6.0mL·min-1。使隔离层增重分别为7.5%、10.0%、12.5%,然后按照“2.4.3”项下肠溶层包衣方法包肠溶衣,肠溶衣增重30%。观察微丸外观并测定耐酸力,研究不同厚度的隔离衣层对微丸的保护力度。试验结果表明,控制隔离层增重为载药微丸的10.0%较好。
2.4.3 肠溶层包衣。取甲基丙烯酸树脂聚合物水分散体,用水稀释至15%的浓度,搅拌均匀;另取纯化水适量,加入0.8%的柠檬酸三乙酯作增塑剂,搅拌均匀,再加入总体积4%滑石粉搅拌均匀。然后将后者缓慢倒入甲基丙烯酸树脂聚合物水分散体中,慢速搅拌均匀,80目筛网过滤,以避免粗颗粒堵塞喷枪,即得肠溶层包衣溶液[6]。取上述已包隔离层的兰索拉唑载药微丸,置于流化床底喷包衣装置中,注意在包衣过程中持续搅拌包衣液。进风温度50℃,雾化压力Ⅰ0.2MPa,雾化压力Ⅱ0.05MPa,物料温度36~40℃,喷浆速度10.0mL·min-1。包衣完成,继续流化干燥10min即可。结果表明,肠溶衣增重控制在30%较好。
2.5 兰索拉唑肠溶微丸胶囊的制备与检查结果
按照“2.4.1”项下最佳主药层包衣液处方进行载药包衣,然后进行隔离层包衣,使其包衣增重10%,最后进行肠溶层包衣,使其包衣增重30%。测定包衣微丸中兰索拉唑的含量,根据含量确定每粒胶囊的微丸灌装量,并将肠溶微丸灌入普通胶囊中(每粒30mg),即得。同法制备3批,并测定其体外累积释放率及酸中释放量。3批兰索拉唑肠溶微丸胶囊体外释放曲线详见图1。
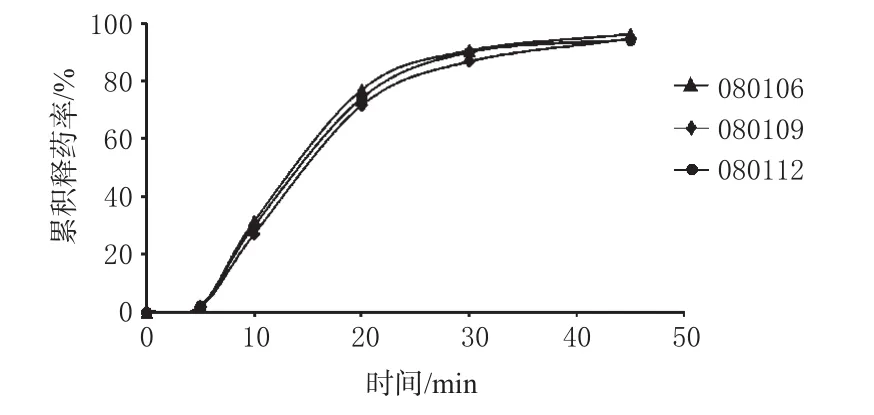
图1 3批兰索拉唑肠溶微丸胶囊的体外释放曲线Fig 1Drug release curves of 3batches of LECPC in vitro
由图1可见,3批肠溶微丸胶囊在人工肠液中45min时的释放度分别为(96.4±0.52)%、(94.8±0.66)%和(94.3±0.76)%。
3批肠溶微丸胶囊在人工胃液中2h的释放量分别为(4.9±1.2)%、(5.5±2.1)%和(6.2±1.6)%,符合规定[5]。
3 讨论
兰索拉唑为苯并咪唑类化合物,具有亚磺酰基,呈弱碱性,在酸性水溶液中很快分解,而在碱性条件下(pH 10)稳定性较好,所以需在主药层包衣液中加入碱性物质调节其pH值至10。在预试验中,笔者曾选择碳酸镁、氧化镁和精氨酸作为碱性调节剂,由于碳酸镁和氧化镁不溶于水,主药层包衣液为混悬液,使得包衣过程中枪头易堵;而选择精氨酸作为碱性调节剂时,主药层包衣液在1.5h时即变为红色,表明兰索拉唑出现降解。因此,最终选择水溶性的无水碳酸钠为碱性调节剂,并达到了预期结果。由于兰索拉唑水溶性较差,故加入聚山梨酯-80为增溶剂;在预试验中,笔者曾采用十二烷基硫酸钠作为增溶剂,但增溶效果不理想。在主药包衣液中加入二甲基硅油后,可提高包衣液的混悬均匀度和润滑性,使包衣过程更顺畅,如不加二甲基硅油,则在包衣过程中易出现堵塞枪头的现象而且微丸包衣时易发生粘连。
在文献[3,7]报道的兰索拉唑肠溶片的制备中,隔离层包衣液均为中性。本试验采用了碱性隔离层包衣液,同时加入二氧化钛作为遮光剂,更好地增加了兰索拉唑的稳定性。
由于肠溶层包衣液呈酸性(pH约为4),当隔离层增重7.5%时,不能有效地防止肠溶层对药物的影响,使药物出现部分降解,而且肠溶微丸的耐酸力较差;当隔离层增重10.0%以上时,可有效阻隔肠溶层对药物的影响,并使肠溶微丸的耐酸力显著增强;如果隔离层太厚,则包衣时间延长,药物由于长时间受热,亦会导致药物的部分降解。
当肠溶层增重20%,包衣微丸在酸液中的稳定时间仅为60min;肠溶层增重25%,包衣微丸在酸液中放置100min时,微丸完好,但到120min时,就有部分微丸变色;肠溶层增重30%,包衣微丸在酸液中放置120min时,微丸完好,无变色破裂,在pH6.8的PBS中45min释放达到95.6%;肠溶层增重40%,在缓冲液中释放较差(77.6%)。故控制隔离层增重为载药微丸的10.0%较好。
试验过程中,笔者曾采用国产的丙烯酸树脂Ⅱ号作为肠溶层包衣材料,同样增重30%,其在酸中释放量却达到了29.5%,因此最终选用甲基丙烯酸树脂聚合物水分散体作为肠溶包衣材料。
本试验采用流化床包衣技术,在空白丸芯上依次包以主药层、隔离层和肠溶层,制备成的兰索拉唑肠溶微丸,载药率高,载药均匀,包衣效果好,不仅具有良好的耐酸力和释药重现性,而且圆整度高,外观亮泽,亦可对肠溶微丸再包彩色薄膜衣,灌装入透明胶囊中,使制剂外观更加亮丽美观,且易于识别。此外,尚可根据微丸的含量灵活调整微丸在胶囊中的灌装量,以更加适合工业化大生产的要求。
[1] 孙建绪.兰索拉唑[J].临床药物治疗杂志,2003,1(4):41.
[2] 杨应霓,余海宣,李庆南,等.兰索拉唑及其片剂的稳定性研究[J].中国现代应用药学,2003,21(3):203.
[3] 张正全,胡海英,邓基伟.兰索拉唑肠溶片处方及工艺的改进[J].华西药学杂志,2007,22(6):643.
[4] 曾小耘,郑若纯,庄静波,等.兰索拉唑肠溶片及肠溶胶囊溶出度的比较[J].中国药房,2001,12(3):171.
[5] 国家食品药品监督管理局标准[S].YBH18552006,2006.
[6] 宋洪涛,郭涛,康鲁平,等.多元定位释药技术制备舒胸缓释胶囊的研究[J].中草药,2005,36(7):993.
[7] 庄意冰,黄惠芳,彭玲,等.兰索拉唑肠溶片的研究[J].中国药学杂志,1999,34(3):169.
Preparation of Lansoprazole Enteric-coated Pellet Capsules
ZHANG Qian(School of Pharmacy,Fujian Medical University,Fuzhou 350004,China)
ZHANG Jing,ZHOU Xin,YU Xi-quan,SONG Hong-tao(Dept.of Pharmacy,Fuzhou General Hospital of Nanjing Military Region,Fuzhou 350025,China)
QUE Jian-yun(Dept.of Pharmacy,Medical College of Xiamen University,Xiamen 361005,China)
OBJECTIVE:To prepare lansoprazole enteric-coated pellet capsules(LECPC).METHODS:The lansoprazole enteric-coated pellets were prepared using fluid-bed coating technology through blank pellets being coated with main component layer,insulating layer and enteric layer in order.Enteric-coated pellets were encapsulated into hard gelatin capsules to obtain LECPC.Drug-loading rate and drug release in artificial intestinal fluid and artificial gastric fluid of 3batches were investigated.RESULTS:The prepared pellets assumed complete round shape,lustrous appearance and coating well with mean drug-loading rate above 96%.The release of 3batches in artificial intestinal fluid within 45minutes were greater than(94.3±0.76)%while were smaller than(6.2±1.6)%in artificial gastric fluid within 2hours.CONCLUSION:The prepared capsule is feasible in technology,reproducible and reliable in quality.It represents satisfactory release in vitro and property of resisting acid.
Lansoprazole;Enteric-coated pellet capsules;Preparation;Fluid-bed coating;Release
R943;R975+.6 文献标示码 A
1001-0408(2010)05-0433-03
*讲师,硕士。研究方向:药物制剂。电话:0591-83712298。E-mail:sohoto@sohu.com
#通讯作者:主任药师,硕士研究生导师,博士。研究方向:药物制剂与临床药学。电话:0591-22859459。E-mail:sohoto@vip.sohu.com
2009-02-28
2009-05-20)

