水貂源牛分枝杆菌的分离与荧光PCR鉴定
王春雨,杨 莉,王全凯,王海军,刘金华,周 亮,王振国(.吉林农业大学,吉林长春 308;.吉林出入境检验检疫局,吉林长春 3006)
水貂作为主要毛皮动物,在我国北部地区广泛养殖,每年产皮数百万张,年经济产值达亿元,是特种动物养殖业的主要支柱[1]。由于各地区养殖规模大小不一,管理水平良莠不齐,对水貂疾病的防治的能力和条件普遍较差,难以保证实际生产对疾病防控的要求。水貂结核病在上世纪就被世界动物卫生组织(OIE)报道[2],水貂的养殖密度较大,配种时需要人工协助,结核病一旦发生就可能大范围流行,并威胁到养殖人员健康,进而影响社会公共卫生安全。
结核病是一种慢性人兽共患传染病,其潜伏期长,检疫和诊断的研究进展缓慢。目前结核病的诊断主要还是靠临床症状和涂片染色以及细菌培养[3],由于结核杆菌生长速度慢,所以菌种的鉴定,费时、费力、敏感性差 ,不利于结核病的净化。荧光探针PCR是近期开始流行的一种微生物检测技术,具有准确性高、重现性好等特点,已广泛用于基因表达、病原体检测等诸多研究领域[4-6]。本研究采用荧光探针PCR对水貂源牛分枝杆菌进行鉴定,可以缩短检测时间,有利于水貂群中结核病的及时控制。
1 材料与方法
1.1 材料
1.1.1 动物 大连某貂场死亡水貂10只,ELISA检测结核阳性。
1.1.2 标准菌株 人型结核分枝杆菌 H37Rv ((M.tuberculosis,ATCC25618)、牛分枝杆菌(M.bovis,ATCC19210)、草分枝杆菌(M.phlei,ATCC607)、耻垢分枝杆菌(M.smegmatis,ATCC607),胃分枝杆菌(M.gastri,ATCC15754),购自北京中原经贸公司(ATCC菌种保存中心中国代理)。
1.1.3 主要试剂与仪器 7H9培养基、7H10培养基、OADC增菌剂均购自美国BD公司;Ex 2×Taq酶购自宝生物工程(大连)有限公司;ABI7000实时荧光PCR仪为美国应用生物系统公司产品;超纯水器Mill—Q Elix 10购自Millipore公司。
1.1.4 引物、探针的设计与合成采用Primer Express2.0软件,设计荧光PCR探针和引物。根据GenBank登录的结核杆菌RD1编码区设计合成引物及探针,5’端标记FAM荧光基团,3’端标记BHQ-1(上游引物GGCTTCTGACCCGCTAATAC,下游引物ACGTGACATTTCCCTGG ATT,探针 CCGCGAAATTCCACTG CTGC);根据牛分枝杆菌基因组中特有序列(GenBank No:AJ003103) 设计合成引物及探针,5’端标记HEX荧光基团,3’端标记BHQ-1(上游引物GTCATGACGCCTTCCTAACC,下游引物CTCCAAGAGTGTTGCG CTT,探针 TGAATTCATACAAGC CGTAGTCGTGCA)。
1.2 方法
1.2.1 细菌分离培养 采集水貂的肺、脾、淋巴结样品,将样品进行匀浆处理后使用4%NaOH进行消化处理,再用相同浓度的弱酸进行中和,将处理后的组织浆液接种于7H10培养基进行分离培养,接种后3 d、7 d后分别观察结果一次,以后每周定期观察结果两次。
1.2.2 抗酸染色 取采集病料的触片,用萋—尼二氏(Zehl-Neelson)染色法染色,光学显微镜观察。
1.2.3 细菌DNA的提取 取2-3个菌落的放入离心管中,加入200 μL TE缓冲液,85~90℃煮10 min后,立即-20℃冷冻15 min,加入40 μL(20 mg/mL)溶菌酶,混匀,37 ℃孵化2 h后迅速加热到65℃。再加入250μg/mL蛋白酶K和终浓度1%SDS,震荡30 min,加入终浓度为1%的 CTAB和 NaCl混合液(CTAB 10%;NaCl 0.7 M),65℃孵化 20 min。加入等体积的氯仿/异戊醇(24/1)提取,离心后取上清液,加入0.6体积的异丙醇沉淀,离心去掉上清,自然干燥,加入25μL无菌蒸馏水溶解DNA,-20℃保存备用。
1.2.4 TaqMan荧光PCR扩增体系和反应条件 TaqMan荧光定量PCR反应体系为25μL,其中ddH2O 13 μL,10×Ex PCR buffer(含 5 mM MgCl2)5μL,dNTP(2.5 mM)2μL,引物 (10 pmol/μL) 和探针(10 pmol/μL)各 0.5 μL,Ex Taq 热启动酶(5 u/μL)0.5 μL,DNA3 μL。,按下列反应参数进行:95℃预变性4 min;95 ℃变性 15 s,60 ℃退火延伸30 s,40个循环;退火延伸检测荧光信号。
2 结果
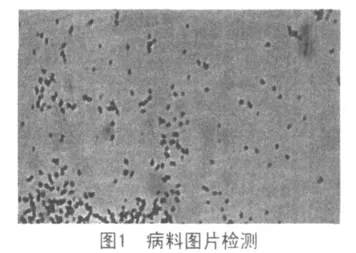
2.1 镜检结果 采集病料的触片经萋—尼二氏染色,为短杆状红色抗酸杆菌(图1)。
2.2 分离培养结果 经过碱处理的病料接种到7H10固体培养基,45 d后有一只水貂的肺脏和淋巴结样本长出菌落,将菌落转接到7H9和7H10固体培养基进行纯化培养。
2.3 荧光探针检测结果
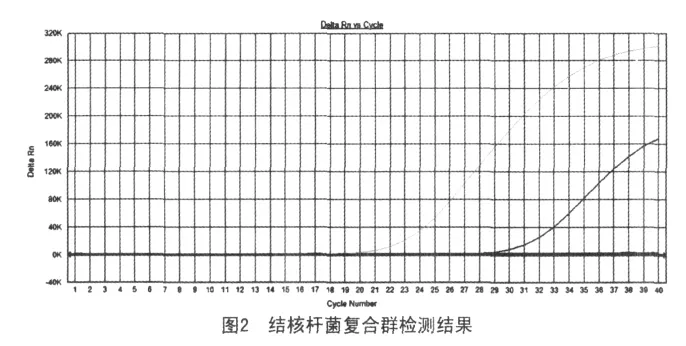
2.3.1 结核分枝杆菌复合群检测根据致病性结核杆菌复合群特有的RD1序列区域设计引物和探针,对所分离的病原菌进行检测。以H37Rv、牛分枝杆菌为阳性质控菌株,BCG和其他分枝杆菌为阴性质控菌株。所分离的病原出现扩增曲线,证明所分离的菌株是致病性结核杆菌(图2)。
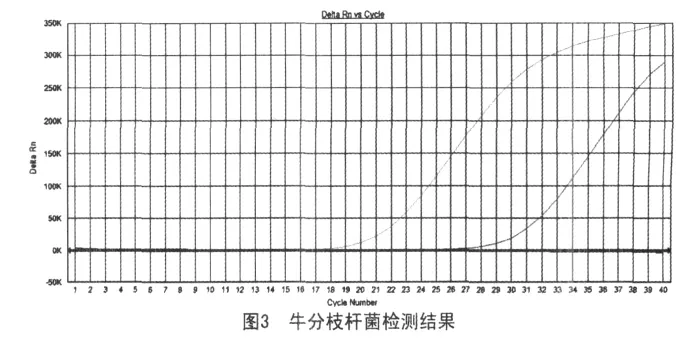
2.3.2 牛分枝杆菌检测以牛分枝杆菌为阳性质控菌株,H37Rv、草分枝杆菌、耻垢核分枝杆菌为阴性质控菌株。对分离病原进行亚种鉴定,出现阳性扩增曲线,说明所分离的水貂结核病原菌属于牛分枝杆菌亚种(图3)。
3 讨论
结核杆菌的分离培养对病料的前处理要求较高,我们处理了十只水貂的内脏样品,但只从一只水貂样本中分离得到牛分枝杆菌,原因可能是由于样品处理时间不当。不同亚种分枝杆菌对培养基敏感性存在差异,通常使用的L-J培养基对于牛分枝杆菌的检出率比较低[7],所以本研究使用7H10培养基添加OADC增菌剂进行初代分离培养,菌落较L-J培养基小,但是菌落在整个培养基斜面分布更加均匀,菌落数量增多,有利于进一步纯化培养。
结核杆菌的常规检测方法为生化鉴定等,属于表型分类法,是以形态和理化特征为依据,近年来变异株的出现,导致了生化检测的特异性降低,让MTC物种级鉴定依然存在较大难度[8-9]。分子生物学技术应用在疾病的诊断逐渐被人们所认可,特别是对于体外培养困难的病原微生物的诊断具有重要的作用[10-11]。结核杆菌复合群荧光PCR检测研究较多主要是IS6110插入序列,该序列在部分牛分枝杆菌中只存在单一拷贝[12],这就导致以IS6110片段为模板动物结核病病原检测时存在弊端。本研究应用的结核杆菌RD1序列只存在于结核杆菌复合群致病株中,基于该位点的荧光PCR检测技术可以增加检测的特异性,能够将致病性结核杆菌与BCG以及其他非致病性结核杆菌区别,根据牛分枝杆菌基因组中特有的229 bp序列设计引物与探针可以对结核杆菌复合群直接进行亚种鉴定,有利于结核杆菌的快速检测,缩短动物检验检疫时间,促进动物结核病的防治。
[1]张伟.关于中国的毛皮动物养殖业[J].野生动物养殖.2004(1):16-17.
[2]Smith G C.Model of Mycobacterium bovis in wildlife and cattle[J].Tuberculosis,2001,81(1):51-64.
[3]Chen J H,Su X D,Zhang Y,et a1.Novel recombinant RD2-and RD11-encoded Mycobacterium tuberculosis antigens are potential candidates for diagnosis of tuberculosis infections in BCG-vaccinated individuals[J].Microbes Infect,2009,11(10-11):876-885.
[4]Heid C A,Stevens J,Livak K J,et al.Real time quantitative PCR [J].Genome Res,1996,6(10):986-994.
[5]Fend R,Geddes R,Lesellier S.Use of an electronic nose to diagnose Mycobacterium bovis infection in badgers and cattle[J].JClin Microbiol,2005,43(4):1745-1751.
[6]Pas SD,Fries E,De Man R A,et al.Development of a quantitative real-time detection assay for hepatitis B virus DNA and comparison with two commercial assays[J].JClin Microbiol,2000,38(8):2897-2901.
[7]Moda G,Daborm C J,et al.The zoonotic importance of Mycobacterium bovis[J].Tuber Lung Dis,1996,7 (7):103-108.
[8]Grange J M,Yates M D,de Kantor I.Guidelines for Speciation Within the M.tuberculosis Complex[Z].2ed.World Health Organization,Geneva,unpublished docu-ment.1996.WHO/EC/Zoo/96.4.
[9]Niemann S,Harmsen D,Rusch Gerdes S,et al.Differentiation of clinical M.tuberculosis complex isolates by gyrB DNA sequence polymorphism analysis[J].J Clin Microbiol.2000,38(9):3231-3234.
[10]Perkins M D.New diagnosis tools for tuberculosis[J].Int J Tuberc Lung Dis,2000,4(12 Suppl 2):182-188.
[11]Nooedhoek G T,Van Embden J D,Kolk A H.Reliability of nucleic acid amplification for detection of Mycobacterium tuberculosis:an international collaborative quality control study among 30 laboratories[J].J Clin Microbiol ,1996 ,34(10):2544-2525.
[12]Savelkoul PH M,Catsburg A,Mulder S,et al.Detection of Mycobacterium tuberculosis complex with Real Time PCR:Comparison of different primer-probe sets based on the IS6110 element[J].JMicrobiol Methods,2006,66(1):177-180.

