柔嫩艾美耳球虫的分离鉴定与致病性测定
王仲兵,古少鹏
(1.山西省动物疫病预防与控制中心,山西太原 030000;2.山西农业大学动物科技学院,山西太谷 030801)
鸡球虫病是由艾美耳球虫中的一种或几种寄生于鸡肠道黏膜上皮引起的一种寄生性原虫病[1],世界各地普遍发生,是目前养禽业中危害最大的一种寄生虫病[2]。目前认为主要有7种禽艾美耳球虫,即堆型艾美耳球虫、和缓艾美耳球虫、柔嫩艾美耳球虫、巨型艾美耳球虫、早熟艾美耳球虫、布什艾美耳球虫和毒害艾美耳球虫[3]。大多数球虫均具有一定的致病性,这使球虫诊断问题复杂化,而且7种球虫在卵囊形态、结构、大小、肠道病变、寄生部位、最短孢子化时间、最短潜伏期等均具有自身特征,它们之间没有交叉免疫原性,同一宿主可以同时感染几种球虫。因此,球虫卵囊的分离技术是鉴定球虫的种类和建立球虫的纯种体系,调查某地区内球虫种类和获得球虫的纯种体系的重要手段[4],对进一步研究球虫的致病性、药物效应、产生的耐药性和禽体对球虫的免疫性,以及对抗球虫药的开发和球虫疫苗研制有重要意义[5]。
1 试验材料
1.1 试验虫株
从太谷县某鸡场采集粪便,经实验室检查确定含有球虫卵囊,用饱和盐水漂浮法分离出球虫卵囊,作本试验使用虫株。
1.2 试验动物
购自太谷县韩村种鸡场海兰白公雏,在无球虫环境中饲养,饲料经高压后使用,饮水为清洁凉开水。经粪便检查,确认无球虫感染后作为单卵囊分离试验用动物。
1.3 主要试剂及仪器
主要试剂:饱和食盐水、重硌酸钾溶液、等渗溶液、氨水;
主要仪器:电子显微镜、离心机、温箱等。
2 试验方法
2.1 野毒株的采集及扩增
采集含有球虫卵囊的鸡的粪便,以饱和盐水漂浮法分离球虫,经增殖获得大量混合球虫卵囊,置2.5%重硌酸钾溶液保存。
2.2 单卵囊分离试验
制备1%琼脂,溶解后浇在培养皿上,厚约1.5 mm,凝固后切成每边为0.4 cm的小方块,移至载玻片上。将保存的混合卵囊用等渗溶液稀释至显微镜下观察每小滴含1~2个球虫卵囊为止。用毛细滴管将一小滴卵囊液滴于琼脂块上,显微镜下观察,当确定液滴内只有一个孢子化的球虫卵囊时,将一小块保鲜膜覆盖于液滴上,经口喂雏鸡,并滴入数滴凉开水,促进其吞咽。
将感染单个卵囊的鸡于已消毒环境中隔离饲养,从感染后96 h逐只检查粪便,保存含有球虫的粪便,感染一周后剖杀,取肠内容物镜检,发现卵囊的即为单卵囊后代,收集保存盲肠和粪便中的卵囊。
2.3 卵囊扩增
将单卵囊分离试验盲肠收集所得的卵囊接种10只11日龄无球虫小鸡,一周后剖杀,收集球虫,获得大量纯种卵囊。
2.4 虫种鉴定
将上步所得卵囊感染的雏鸡,每日观察鸡的精神状态、食欲和最早发现血便的时间,记录潜隐期,剖杀后观察整条肠道,记录主要病变部位。对收集的纯种球虫卵囊在带有测微尺的显微镜下观测其形态结构,测量其长径、宽经、大小,计算该株卵囊的形状指数,并将收集到的纯种卵囊保存于重硌酸钾溶液中,置28℃温箱培养,记录其最短孢子化时间,待其孢子化后,在显微镜下观测孢子囊的形态结构和大小,根据上述各项综合指标确定虫种。
2.4 虫种致病性观察
将11日龄无球虫鸡,分为7个组,每组9只。分别以1×103个/只、5×103个/只、1×104个/只、2×104个/只、5×104个/只、10×104个/只攻毒,另一组为对照组。接种后每日观测鸡的精神状态、饮食欲和血便情况,记录并剖检死亡鸡。一周后剖杀全部试验鸡,记录攻毒前体重、剖杀前体重、死亡率、盲肠病变记分和O.P.G值,计算体增重、相对增重率、抗球虫指数(ACI)值和半数感染量(ID50)、半数致死量(LD50)。
2.4.1 盲肠病变记分参照田角清[6]标准
0:未见病变;
1:盲肠壁有极少量散在出血斑,肠壁增厚,内容物正常;
2:盲肠内有少量血液,肠壁增厚,可见多处出血斑;
3:盲肠内有多量血液,肠壁肥厚,有明显的盲肠变形和萎缩;
4:盲肠显著萎缩,病变达直肠部,肠壁极度肥厚,盲肠内有盲肠芯。
若两侧病变不一致,以病变严重的一侧为准。
2.4.2 ACI值的计算
ACI=(存活率+相对增重率)-(病变记分+卵囊值)[6]
卵囊值:
O.P.G值为0~0.1,卵囊值为0;
O.P.G值为0.1~1,卵囊值为1;
O.P.G值为2~5,卵囊值为10;
O.P.G值为6~10,卵囊值为20;
O.P.G值≥11,卵囊值为40。
O.P.G值为每克粪便中的卵囊数,以×106为单位。
2.4.3 ID50(半数感染量)根据血便百分率来计算;LD50(半数致死量)根据死亡率来计算[7]。
3 试验结果
3.1 虫种鉴定结果
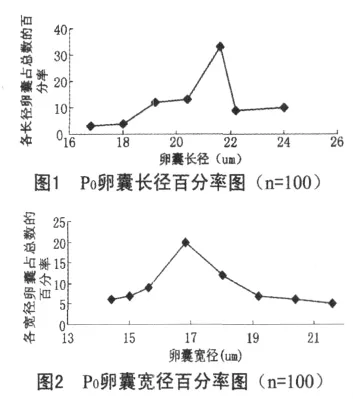
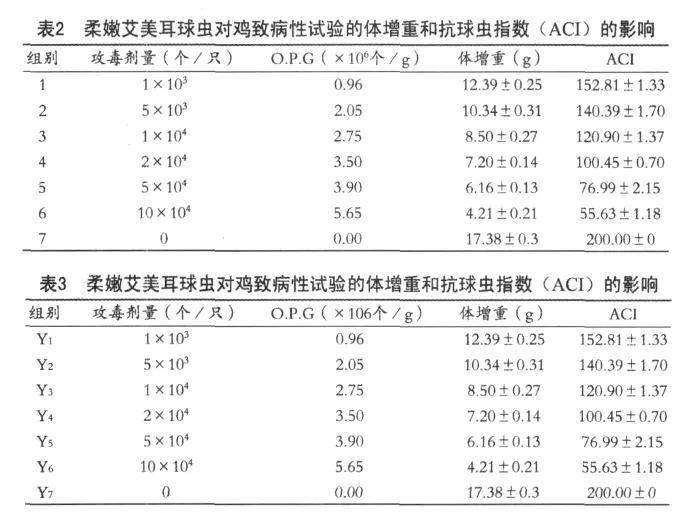
感染单卵囊后代的雏鸡,感染初期,试验鸡精神、饮食欲无明显的异常。感染后120 h,感染鸡表现为饮食欲减少,羽毛逆立,粪便变稀,个别鸡开始拉鲜红色粪便;135 h开始,每隔两小时镜检一次粪便,到141 h时,第一次从粪便中检出球虫卵囊,可见其最短潜隐期为141 h。一周后剖杀,其中两只鸡盲肠高度肿胀和大量出血,黏膜面有大量出血点,肠腔中充满凝血和肠黏膜碎片,取盲肠内容物和盲肠黏膜刮取物镜检可见卵囊,其他肠道无肉眼可见病变,镜检内容物中也未见球虫卵囊,取小肠中段内容物镜检,未见裂殖子。因此可确定单卵囊分离所获得的这株球虫的裂殖生殖和卵囊寄生部位均在盲肠。用饱和盐水漂浮法收集粪便和盲肠球虫卵囊,在显微镜下观察,所收集的球虫卵囊呈宽卵圆形,卵囊壁为二层,光滑,无卵膜孔,有一圆形极粒位于窄端。用装有测微尺的显微镜测量100个球虫卵囊,测得的卵囊长径集中在18.00μm~24.00μm,宽径集中在15.00μm~21.60μm,将其绘成折线图(图 1、图 2),大小范围为16.80~28.80μm×14.40~25.20μm,平均大小为 21.54±0.24μm×17.85±0.24μm,形状指数为1.21。收集到的球虫卵囊在28℃的温箱中培养,检测的最短孢子化时间为19h,将其孢子化的卵囊置于显微镜下观察,孢子囊有斯氏体,无内外残体。根据上述观测结果,参照国内外文献,可确定该株球虫为柔嫩艾美耳球虫,并命名为E.t SX01323。
3.2 柔嫩艾美耳球虫致病性试验
感染初期,试验鸡精神、饮食欲无明显的异常。感染4天后,6个实验组鸡均表现为饮食欲减少,羽毛逆立,粪便变稀,感染后第5天,鸡群出现粪便带血,精神倦怠,双翅下垂,卧地弓背或尾羽上撅,肛门周围和后覆尾羽粘有红褐色血性粪便。并有部分鸡只死亡,随感染剂量增加死亡率也相对增高。剖检病死鸡,可见盲肠壁增厚、肿胀、出血,肠腔中充满凝血块和盲肠粘膜碎片及干涸的盲肠芯。肉眼观察其他肠段无明显变化。
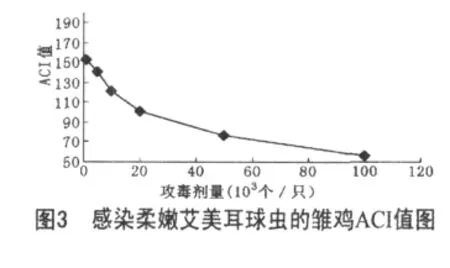
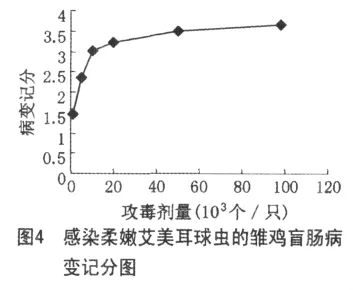
除对照组外,各感染组雏鸡,卵囊排出量和血便量随攻毒量增大而增多,其半数感染量为0.99×104个/只;相对增重率、ACI值随攻毒量的增加而减小,攻毒量由1×103增到10×104个/只时,雏鸡相对增重率由55.27%降到了29.28%,可见柔嫩艾美耳球虫对雏鸡增重的影响很大,且剂量越大,对增重的影响越大,对照组雏鸡的ACI值为200,而感染雏鸡在 1×103~2×104个/只范围内,ACI值在 152.81±1.33~100.45±0.70范围内,可反映出柔嫩艾美耳球虫对雏鸡的损伤较轻微,感染量在5×104~10×104个/只范围内,雏鸡的ACI值降到了76.99±2.15~55.63±1.18范围内,此时柔嫩艾美耳球虫对雏鸡的损伤已较严重,可见柔嫩艾美耳球虫对雏鸡ACI值的影响也很大,且随着剂量增大,对ACI值的影响越来越大;雏鸡的攻毒量在5×103个/只以内不引起死亡,攻毒量在1×104个/只以上,死亡率随攻毒量增加而增高,其半数致死量为7.52×104个/只;试验各感染组病理剖检均观察到不同程度的肠道病变,随着感染剂量的增加,病变程度越来越严重,当攻毒量在1×103~5×103个/只以内时,雏鸡盲肠壁见少量散在出血点,内容物中有少量血液,攻毒量在1×104~10×104个/只以内,盲肠高度肿胀,肠腔内充满凝血和脱落肠黏膜。结果见表1、2和图3、4。
4 分析与讨论
?
球虫分布范围广,危害大,严重威胁养禽业的发展,球虫病对于雏鸡而言,常常是毁灭性的[8]。其中,致病力最强的为柔嫩艾美尔球虫(E.tenella)和毒害艾美尔球虫(E.nacatrix),每年给养禽业带来巨大的损失。因此,许多学者致力于球虫方面的研究。要想深入研究每一种球虫的特性就需要提取品种单一的球虫卵囊进行研究;同时生物技术的进步为球虫的活苗,基因工程苗[9]及球虫遗传变异的研究提供了更为广阔的空间,而获得品种单一、基因型纯净的球虫卵囊是这些研究能否顺利进行的前提。目前,球虫单卵囊分离技术是获得球虫纯种体系的重要手段[10],是上述各种研究的基础。
柔嫩艾美耳球虫(E.tenella)显著的特征是寄生于盲肠和临床上出现明显的血便,本实验分离纯化的这株球虫具有此特征,在显微镜下其卵囊结构、测得的卵囊和孢子囊大小、卵囊形状指数、潜隐期和最短孢子化时间均为柔嫩艾美耳球虫的特征,且在小肠中段亦未见到裂殖子。因此,鉴定分离所的这株纯种球虫为柔嫩艾美耳球虫(E.tenella)。
本实验通过设计剂量梯度对所分离出的柔嫩艾美耳球虫进行致病性观察,无论从攻毒剂量,还是检测指标(增重率、盲肠病变、ACI值、半数感染量、半数致死量)均可得出该株柔嫩艾美耳球虫的毒力很强,应该引起人们足够的重视。且该株柔嫩艾美耳球虫可供以后柔嫩艾美耳球虫的进一步深入研究。
[1]索勋,李国清.鸡球虫病学[M].北京:中国农业大学出版社,1998:117-373.
[2]江苏泰州市畜牧兽医学校编.畜禽球虫病[J].北京农业出版社,1993:32.
[3]索勋,李国清.鸡球虫病学[M].北京;中国农业大学出版社,1998:l1-24.
[4]缮德年,樊生超,姚惠娟,等.鸡球虫虫种分离鉴定方法研究 [J].国外畜牧学—猪与禽,1999,(1)l51-152.
[5]粱兵,郑宏伟,何光源.鸡球虫单卵囊的分离与雏鸡感染试验 [J].中兽医医药杂志,1991(3):3-5.
[14]刘振湘,唐晓玲.湖南省衡阳市鸡球虫病病原种类与流行情况调查[J].中 国 兽 医 寄 生 虫 病 ,2001,9(2):26-28.
[15]杨汉春主编.动物免疫学[M].北京:中国农大学出版社.1999:163-171.
[16]孔繁瑶.家畜寄生虫学(第二版)[M].北京:中国农业大学出版社,1997.
[17]Bhogal B S,Miller GA.Potential of a recombinant antigen as a prophylactic vaccine for one-day-old broiler chickens against E.acervulina and E.tenella infections[J].Vet Immunol Immunopathol,1992,31:323-335.
[18]缮德年,樊生超,姚惠娟,等.鸡球虫虫种分离鉴定方法研究 [J].国外畜牧学 -猪与禽,1999(1):51-52.

