免疫组化法检测大鼠肝脏组织中的乙型肝炎病毒和戊型肝炎病毒
于 品,佘锐萍,夏抗抗,李文贵,丁 叶,岳 卓,韩德平
(中国农业大学动物医学院,北京100193)
乙型肝炎是一种广泛流行、严重危害人类健康的病毒性传染病,其病原为乙型肝炎病毒(Hepatitis B virus,HBV)。乙肝病毒属于嗜肝病毒科(hepadnaviridae),正嗜肝病毒属(Orthohepadnavirus)的一员。全球范围内约有3.5亿乙型肝炎感染者,每年有近100万人死于由乙型肝炎引起的慢性肝炎、肝硬化和肝细胞癌[1-2]。而在中国,普通人群中大约有10%携带HBsAg,有些地区人乙型肝炎的感染率已达50%以上,在某些人群中甚至高达79%,HBV感染是肝硬化与肝癌的形成和发展重要原因之一,HBV感染成为了我国重症肝炎的主要原因,病死率高达 80%[3]。Brumberg(1965)首次发现澳大利亚土著人血清中的抗原(澳抗),1968年证实该抗原与肝炎有关,现称之为乙型肝炎表面抗原(HBsAg)。此后免疫电镜用于澳抗的检查,观察到病毒颗粒,Dane(1970)报道了完整的HBV颗粒。近几年来,陆续有从猪,牛,羊,鸡,鸭,野生鼠类等动物体内检出人乙型肝炎病毒相关抗原的研究报道[4-8],并由此怀疑乙型肝炎是一种人畜共患病。
戊型肝炎(Hepatitis E)是由戊型肝炎病毒(Hepatitis E virus,HEV)引起的一种急性病毒性肝炎。其主要流行于亚洲,非洲和拉丁美洲的发展中国家[9],在美国和欧洲的一些国家也出现过地方性流行[10]。在普通人群中,戊型肝炎的死亡率不到1%,但其对孕妇的致死率却高达28%[11],极大地危害着人类的健康。Meng等2003年首次在猪血清中分离到猪戊型肝炎病毒(SHEV)野毒株[12],又有人从鸡、猫、狗、牛、羊和啮齿类动物体内检测到HEV抗体阳性[13-19],王英华等(2008)在屠宰猪肝中检出HEV,其结果从HEV蛋白和基因两个角度都证明了屠宰猪肝脏中HEV的存在,并且证明猪的HEV与人的HEV有很大的相关性[20]。Li等2009年报道,在北京地区不同的养殖条件下,屠宰猪HEV血清阳性率高达到76.6%-90%,其与人源毒株HEV的同源性在96%以上[21]。HEV已经作为了一种重要的人畜共患病受到了人们的重视。
SD大鼠作为一种常用的实验动物,其病原的控制不仅关系到相关实验的结果,而且会影响到实验人员等暴露人群的健康。而SD大鼠HBV和HEV的感染情况并未见有报道,本研究通过对53例SD大鼠肝脏进行免疫组织化学染色、HE染色和Mallory三色染色,统计SD大鼠肝脏内乙型肝炎和戊型肝炎相关抗原的阳性率,以及乙肝病毒和戊肝病毒感染对肝脏造成的病理损伤等,初步了解SD大鼠肝脏内HBV和HEV感染情况,为进一步揭示人类乙型肝炎和戊型肝炎的发病机理提供基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 购自某实验动物中心,共计53只21日龄清洁级SD大鼠。
1.1.2 试剂 兔抗人乙肝病毒核心抗原(HBcAg)多克隆抗体,鼠抗人乙肝病毒表面抗原(HBsAg)单克隆抗体,兔抗人HEV单克隆抗体,SP免疫组化染色试剂盒,均购自北京中山金桥生物制品公司。
1.2 方法
1.2.1 样品处理 SD大鼠经颈静脉放血处死,无菌采集其肝脏(约1 cm×1 cm×2 cm)样本,用2.5%多聚甲醛-戊二醛混合固定液固定。
1.2.2 切片制作 固定好的肝组织经修块、梯度酒精脱水、二甲苯透明、石蜡包埋,然后制作5张厚4μm的连续切片,备用。
1.2.3 免疫组化染色 切片经二甲苯脱蜡后,用PBS冲洗5 min×3次;3%H2O2室温孵育10 min;蒸馏水冲洗,PBS浸泡5 min×3次;正常牛血清白蛋白工作液封闭15 min,倾去血清,滴加一抗工作液,37℃孵育2 h;PBS冲洗5 min×3次,滴加生物素标记二抗工作液,37℃孵育30 min;PBS冲洗5 min×3次,滴加辣根过氧化物酶标记的链霉卵白素工作液,37℃孵育 30 min;PBS冲洗 5 min×3次,DAB显色液显色;用苏木素衬染后,按常规石蜡切片制作方法脱水、封片后,显微镜下观察。
1.2.4 苏木素-伊红(HE)染色和Mallory三色染色法 对 HBcAg、HBsAg和HEV免疫组化检测结果呈阳性反应的肝脏再进行HE染色和Mallory三色染色,观察其组织病理学变化。
1.2.5 免疫组化染色结果判定 镜下肝组织中乙型肝炎病毒和戊型肝炎病毒相关抗原阳性信号呈现棕红色或棕黄色颗粒或团块状。
2 结果与分析
2.1 肝脏中HBcAg、HBsAg免疫组化检测结果
53例SD大鼠肝脏中HBcAg、HBsAg免疫组化检测结果见下表1和表2。由表1可见,在被检的53例SD大鼠肝脏中,检出了HBcAg、HB-sAg双阳性的有34例,占被检样品总数的66.15%;HBsAg阳性但HBcAg呈阴性的有13例,占总数的24.53%;HBcAg阳性但HBsAg为阴性的有4例,占总数的7.55%;HBcAg、HBsAg双阴性的有2例,占总数的3.77%。由表2可见,在被检的53例SD大鼠肝脏中,有47例呈HBsAg阳性反应,阳性率为88.68%;有38例呈HBcAg阳性反应,阳性率为71.70%。这表明,在53例SD大鼠肝脏中乙型肝炎病毒抗原的总检出率高达96.23%。
?
2.2 HBV抗原在肝脏中的定位
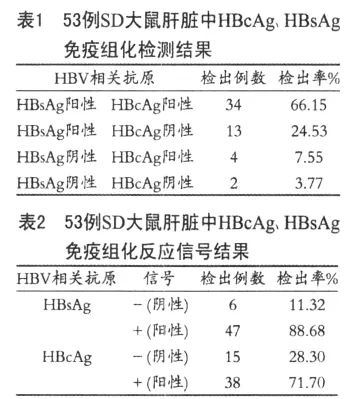
显微镜下观察发现HBcAg免疫组化阳性反应物主要分布在肝被膜下和肝小叶中央静脉周围肝细胞内。以核浆混合型(95%)为主(图 1,A),其次为胞核型(5%)(图 1,B),各例肝脏肝细胞内的HBcAg免疫组化阳性反应物强度不一。
HBsAg免疫组化阳性反应物主要分布在肝被膜下和肝小叶中央区的静脉周围肝细胞内。以胞核胞浆胞膜型(68.09%)为主(图 1,C),其次为胞核胞膜型(31.91%)(图 1,D),各例肝脏肝细胞内的HBsAg免疫组化阳性反应物强度不一。在不加一抗的阴性染色对照片中未见任何棕红色阳性反应信号(图 1,I)。
2.3 肝脏中HEV免疫组化检测结果
53例SD大鼠肝脏中HEV免疫组化检测结果见下表3。由表3可见,在被检的53例SD大鼠肝脏中,检出了HEV阳性的有53例,占被检样品总数的100%。

?
2.4 HEV抗原在肝脏中的定位
显微镜下观察发现HEV免疫组化阳性反应物主要分布在肝被膜下和肝小叶中央静脉周围肝细胞内。以核浆胆管混合型(81.13%)为主(图1,E、G、H),其次为胞核胆管混合型(8%)(图 1,F),另外胞核型和胆管型各占1.89%,各例肝脏肝细胞内的HEV免疫组化阳性反应物强度不一。在不加一抗的阴性染色对照片中未见任何棕红色阳性反应信号(图1,I)。
2.5 HE染色结果
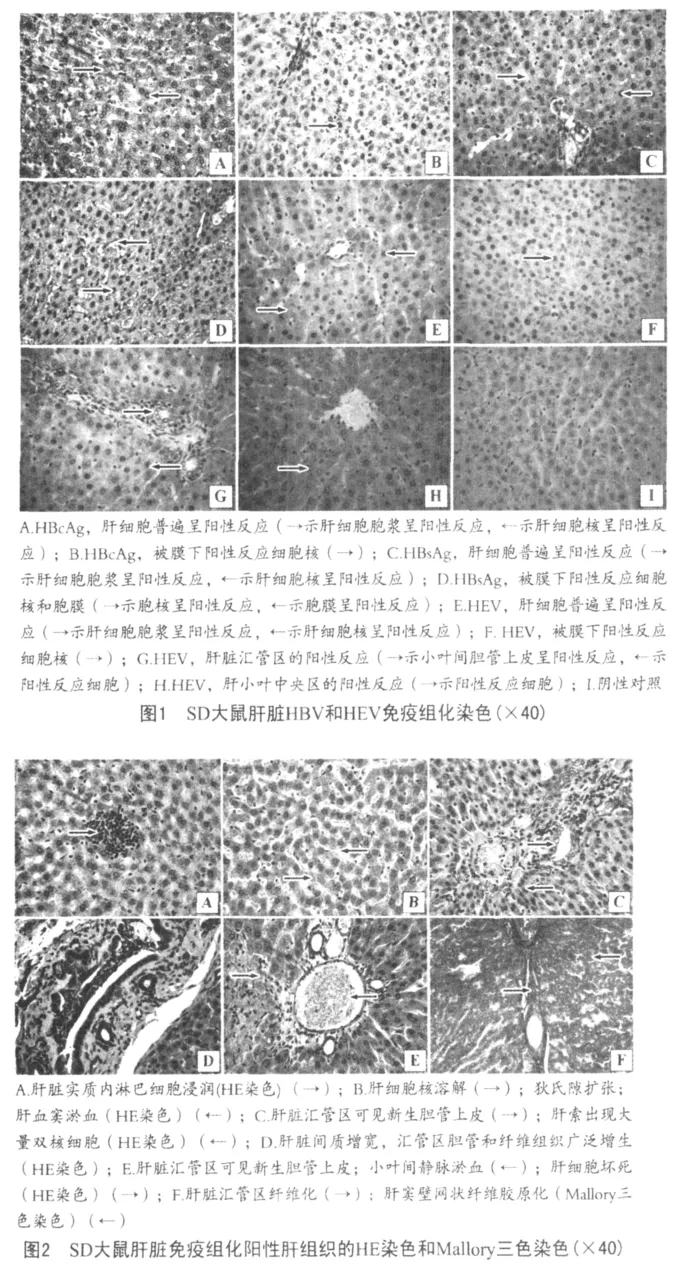
光镜观察发现,免疫组化阳性反应的肝脏组织均有不同程度的病理变化。主要表现有:肝细胞变性,局灶性或散在单个性坏死(图 2,B、E);有的肝小叶中央静脉淤血(图2,E);常见肝小叶间或小叶内淋巴细胞弥散性或局灶性浸润(图2,A);有的可见小叶间胆管增生(图 2,C、D、E),并常见有纤维结缔组织增生现象(图2,D、F)。
统计发现在免疫组化阳性的肝脏样品中,有35%的肝组织中见有淋巴细胞等炎性细胞浸润;33%的肝脏出现了肝细胞变性、坏死;17%的肝脏肝细胞发生萎缩病变;41%的肝脏汇管区胆管增生;22%的肝组织中纤维结缔组织增生。说明HBV和HEV感染对大鼠的肝脏造成了明显的损伤作用。
2.6 Mallory三色染色法结果
在免疫组化阳性反应的SD大鼠肝脏中,镜检发现22%(12/53)的肝组织中有纤维结缔组织增生,并且发现在有些病变比较严重的肝脏中,纤维组织已伸入肝小叶内,有的肝血窦的网状纤维有胶原化的趋势,说明这些SD大鼠肝脏的炎症已转为慢性。
3 讨论
肝脏作为动物机体内最大的腺体,具有生物转化、分泌和排泄等多种生物化学功能,是多种物质代谢的中枢。肝脏独特的双重血液供应,使得肝细胞可以从肝动脉中获得充足的氧及代谢物,并且又可以从门静脉中获取大量由肠道吸收的各种营养物质,为肝脏的各种物质代谢提供了基础。肝脏还具有双重的输出通道,肝静脉可以将肝内的代谢产物运输到其他组织利用或排除,同时胆道系统将肝分泌的胆汁及代谢废物排入肠道。另外,肝组织中还存在多种免疫细胞,其中包括肝巨噬细胞(库普弗细胞)、大颗粒淋巴细胞、肝树突状细胞等,这些细胞能够捕获和呈递血液中的病原微生物及其代谢产物,使肝脏在抗感染免疫中发挥一定的作用。如此重要的器官,其结构和功能正常与否关系到整个机体的健康状态,病毒性肝炎是威胁肝脏功能的重要因素之一,严重地威胁着人类和动物的健康,人类病毒性肝炎的蔓延如此之快,可能与动物病毒性肝炎感染情况有关,尤其是家畜、家禽可能在病毒性肝炎的传播中起到了不可小视的作用。
自从 Brumberg(1965)首次发现澳抗,Dane(1970)报道了完整的HBV颗粒以来,近几年来,陆续有从猪,牛,羊,鸡,鸭,野生鼠类等动物体内检出人乙型肝炎病毒相关抗原的研究报道[1-5],并怀疑乙型肝炎是一种人畜共患病,乙型肝炎是一种世界性的传染病,是肝硬化和肝癌发病的重要诱因,其公共卫生学意义也越来越引起人们的重视。
戊型肝炎已经被公认是一种人畜共患病,Emerson(2003)报道猪是戊型肝炎病毒最主要的动物贮存宿主[22],近年来,在牛、羊、鸡、犬等畜禽及野生动物中也检测到抗HEV抗体或HEV RNA[23],动物病毒株是引起人散发性戊型肝炎的主要病原。
对于SD大鼠感染HBV和HEV的情况,目前未见报道,本研究首次采用免疫组化的方法在SD大鼠的肝组织中显现并定位了人乙肝病毒和戊肝病毒相关抗原。本研究检测的53例SD大鼠肝脏中人乙肝病毒抗原的总检出率达96.23%,人戊肝病毒抗原的检出率高达100%,镜下显示,位于肝被膜附近的肝细胞中,乙型肝炎和戊型肝炎相关抗原阳性信号主要分布于肝细胞核中,呈散在分布,而远离被膜的肝细胞胞浆和部分胞核可见阳性信号,胞浆中多呈成片分布,这可能与HBV和HEV感染阶段不同,病毒存在的部位不同有关。所有肝组织的汇管区胆管上皮细胞均呈阳性反应,表明HEV可能是通过胆汁的分泌而进入肠道的。这与报道的猪等动物戊型肝炎病毒抗原分布情况基本一致。组织形态学观察表明,免疫组化阳性的肝脏HE染色切片都具有典型的病毒性肝炎的病变特征:35%的肝组织中见有淋巴细胞等炎性细胞浸润;33%的肝脏出现了肝细胞变性、坏死;17%的肝脏肝细胞发生萎缩病变;41%的肝脏汇管区胆管增生;22%的肝组织中纤维结缔组织增生,并常见有不同程度的纤维结缔组织增生现象;Mallory三色染色法22%的肝组织中有纤维结缔组织增生,并有网状纤维胶原化,提示这些肝组织有转为慢性肝炎的趋势。这表明SD大鼠的HBV和HEV感染对其肝脏造成了明显的损伤作用,表现为明显的病毒性肝炎的病理学变化。但其病原与人乙肝病毒和戊肝病毒的同源性有待进一步研究。
由于缺乏合适的体内外模型,HBV的生物学研究及治疗方法进展缓慢,因此,建立一种有效的HBV感染模型,是探索其感染机制,发病机理,寻找有效的防治方法及开展抗HBV药物的筛选的重要前提。国内外学者普遍采用鸭HBV感染1~3日龄雏鸭建立乙肝动物模型,是研究乙肝发病机制、病毒复制过程及筛选有效治疗药物的理想模型,可作为抗病毒药物临床前评价的工具,用于研究药物的药效、药动学以及毒理学,也可用于评价免疫治疗的疗效[24]。HBV转基因小鼠模型也应用于HBV感染过程和感染后的免疫病理改变,还有助于发展新的抗病毒治疗方法[25]。HBV转基因小鼠为研究病毒在体内的复制提供了良好的模型,但同时也具有很多缺陷[26]。HEV多种动物宿主的发现提供了实验感染动物模型,其中包括非人类灵长类:猴、食蟹猴、非洲绿猴、短尾猴和黑猩猩[27]。猪作为HEV动物模型,实验感染了猪HEV和人HEV株,这提供了HEV跨物种传播的实验依据[28]。有研究表明,野生啮齿类动物体内检测到HBV和HEV的感染,SD大鼠是常用的实验动物,本研究中检测到的免疫组化阳性的大鼠肝脏其病理变化与人的病毒性肝炎的病变相似,阳性信号分布也与人的HBV和HEV相似,所以,大鼠能否成为进行HBV和HEV研究的动物模型,有待深入研究。
4 结论
SD大鼠可以自然感染HBV和HEV,HBV主要在肝细胞的胞浆胞核中分布,HEV主要分布于肝细胞的胞浆胞核和小叶间胆管上皮中,并且会使其肝脏出现典型的病毒性肝炎的病变特征,部分肝脏还表现有纤维化的趋势。
[1]Lavanchy D.Worldwide epidemiology of HBV infection,disease burden,and vaccine revention[J].JClin Virol 2005:34(1):1-3.
[2]Zuckerman JN,Zuckerman A J.Current topics in hepatitis B [J].J Infect 2000,41:130-136.
[3]周平.PCR在乙肝病毒感染研究中的应用[C]//李景泰,林万明,王国卿.临床医学分子生物学现状和未来.北京:中国科学技术出版社,1995.
[4]许江城,佘锐萍,林剑波,等.应用免疫组织化学方法检测屠宰猪肝脏中人乙型肝炎病毒抗原[J].中国兽医杂志,2004,40(4):46-47.
[5]丁壮,金宁一,陈创夫,等.羊源乙肝病毒与人乙肝病毒S基因序列同源性研究 [J]. 动物医学进展,2001,22(4):54-57.
[6]丁壮,金宁一,陈振文,等.鸡源类人乙肝病毒与人乙肝病毒S基因序列分析 [J]. 中国兽医学报,1999,19(1):18-22.
[7]付美丽,林青,刘小朋,等.鸭乙型肝炎病毒cccDNATaqMan荧光定量PCR的建立 [J].中华微生物学和免疫学杂志,2007,27(7):656-659.
[8]米竹青,李兆样,张海林,等.鼠类携带乙型肝炎表面抗原的研究[J].医学动物防制,2004,20(9):514-515.
[9]Hiroaki,Okamoto.Genetic variability and evolution of hepatitis E virus[J].Virus Research,2007,127:216-228.
[10]Meng,X J.Hepatitis E virus(hepevirus)[M].Encyclopedia of Virology:5vols.3rd ed.Elsevier,Oxford,2008:377-383.
[11]Purcell,R H,Emerson,S U.Hepatitis Evirus[M]//Fields Virology.4th ed.Philadelphia,Lippincott Williams and Wilkins,2001:3051-3061.
[12]Meng,X J.Swine Hepatitis E virus:Cross-speciesinfectionandriskinxenotransplantation[J].Current Top Microbiological Immunology,2003,(278):185-216.
[13]Huang FF,Sun Z F,Emerson SU,et al.Determination and analysis of the complete genomic sequence of avian hepatitis E virus(avian HEV)and attempts to infect rhesus monkeys with avian HEV[J].JGen Virol,2004,85:1609-1618.
[14]Kuno A,Ido K,Isoda N,et al.Sporadic acute hepatitis E of a 47-year-old man whose pet cat was positive for antibody to hepatitis Evirus[J].Hepatol Res,2003,26:237-242.
[15]Purcell R H,Emerson SU.Animal Models of hepatitis A and E[J].ILARJ,2001,42:161–177.
[16]Hirano M,Ding X,Tran H T,et al.Prevalence of antibody against hepatitis E virus in variousspecies of non-human primates:evidence of widespread infection in Japanese monkeys(Macaca fuscata)[J].Jpn JInfect,2003,56:8-11.
[17]Kabrane-Lazizi Y,Fine JB,Elm J,et al.Evidence for widespread infection of wild rats with hepatitis E virus in the United States[J].Am JTrop Med Hyg,1999,61:331-335.
[18]Meng X J.Novel strains of hepatitis E virus identified from humans and other animal species:is hepatitis E a zoonotic[J].JHepatol,2000,33:842-845.
[19]Haqshenas G,Shivaprasad H L,Woolcock PR,et al.Genetic identification and characterization of a novel virus related to human hepatitis E virus from chickens with hepatitis-splenomegaly syndrome in the United States[J].JGen Virol,2001,82:2449-2462.
[20]王英华,韦海涛.屠宰猪肝脏中戊型肝炎病毒(HEV)的检测及组织病理学观察 [J].农业生物技术学报,2008,16(3):373-379.
[21]Wengui L,Ruiping S,Haitao W,et al.Prevalence of hepatitis E virus in swine under different breeding environment and abattoir in Beijing,China[J].Veterinary Microbiology,2009,133:75-83.
[22]Emerson SU,Purcell RH.Hepatitis EVirus[J].Review of Medical Virology,2003,(13):145-154.
[23]周锦萍,孙泉云,刘佩红,等.上海地区多种动物戊型肝炎血清学调查[J].动物医学进展,2006,27(12):85-88.
[24]梁荣感,苏何玲,宋芸娟,等.桂林麻鸭先天性鸭乙肝病毒模型的研究[J].中 国 现 代 医 学 杂 志 ,2006,16(11):1684-1686.
[25]Walter E,Keist R,Niederost B,et al.Hepatitis B virus infection of tupaia hepatocytesin vitro and in vivo[J].Hepatology,1996,24(1):1-5.
[26]李平,于益芝.乙型肝炎病毒感染的小鼠模型[J].国际流行病学传染病学杂志,2006,33(6):392-395.
[27]Balayan M S,Andjaparidze A G,Savinskaya S S,et al.Evidence for a virus in non-A,non-B hepatitis transmitted viathe fecal oral route[J].Intervirology,1983,20:23-31.
[28]Williams T P,Kasorndorkbua C,Halbur PG,et al.Evidence of Extrahepatic Sites of Rep lication of the Hepatitis EVirus in a Swine Model[J].JClin Microbiol,2001,39(9):3040-3046.

