应用环介导等温扩增技术快速检测单核细胞增生李斯特菌的研究
唐梦君 ,高玉时 ,周 生 ,张小燕 ,唐修君 ,蒲俊华 ,葛庆联
(1.农业部家禽品质监督检验测试中心,江苏扬州 225003;2.中国农业科学院家禽研究所,江苏扬州 225003)
单核细胞增生性李斯特菌(Listeria.monocytogenes LM)是李斯特菌属中的一种,LM广泛分布于自然界,在肉类、蛋类、禽类、海产品、乳制品和蔬菜类都能检出[1-2]。该菌为重要人兽共患和食源性病原菌,可引起人和多种动物的胃炎、脑膜炎、败血症、流产等。新生儿、老人及免疫低下者更易感染发病,病死率高达30%[2]。因此,建立一种快速、有效的检测方法对各种食品进行质量监督,及时检测出食品中是否含有该菌非常重要。
目前LM快速检测方法包括传统的细菌分离鉴定、免疫检测、PCR方法等。细菌分离鉴定法操作繁琐、耗时长;免疫检测操作简便,可在同一时间内检测大量样品,但由于存在菌体及鞭毛抗原交叉反应,难以进行李斯特菌种间特异性鉴别[3];PCR法具有特异性强、灵敏度高和速度快等优点,但因PCR技术对模板DNA的质量有较高要求,需要的热循环设备价格昂贵而很难得到推广。
环介导等温扩增(Loop-mediated isothermal amplication,LAMP)是 Notomi等在2000年开发的一种新颖的恒温核酸扩增方法,其原理是针对目的基因的6个区域设计4条特异性引物,利用一种链置换DNA聚合酶(Bst DNApolymerase)在等温65℃左右,几十分钟,即可实现核酸的高效扩增[4]。4条引物对靶序列的6个特异序列区域的识别,保证了LAMP扩增的高度特异性。LAMP不需要模版的热变性[5],长时间温度循环,在等温条件下扩增,不会因温度改变而浪费时间。有无肉眼可见的焦磷酸镁的白色沉淀[6-7],成为判断核酸是否扩增的最简单的方法。增加环引物的LAMP方法,使反应速度可提高1/2~1/3[8]。因此,LAMP与PCR方法相比具有更高的特异性和高效性[9-11]。近来研究表明,LAMP已成功应用于各种细菌和病毒的快速检测[12-14]。本实验以单核细胞增生李斯特菌的hlyA基因为靶序列设计三对引物(包括内外引物和一对环引物),并比较了LAMP和PCR方法的特异性与灵敏性。
1 材料与方法
1.1 主要仪器设备和试剂 电热恒温水浴锅、高速冷冻离心机(HITACHI)、PCR 扩增仪(eppendorf)、凝胶成像系统、恒温培养箱、电泳仪等;Bst DNA聚合酶购自New England Biolab 公司;甜菜碱(Betain),购自Sigma 公 司 ;TaqDNA、dNTP、DNA Marker、Cla I酶等分子生物学试剂购自大连宝生物试剂有限公司。
1.2 菌种 单增李斯特菌(GIM1.229)、金黄色葡萄球菌(ATCC6538)、鼠伤寒沙门氏菌(CMCC50115)、痢疾志贺氏菌(CMCC51252)、猪霍乱沙门氏菌(ATCC13312)、福氏志贺氏菌(CMCC51572)、宋氏志贺氏菌(CMCC51592)购自广东省微生物菌种保藏中心;副溶血性弧菌(ATCC17802)、猪霍乱沙门氏菌(ATCC14028)、 大 肠 杆 菌(ATCC8739)购自中国普通微生物菌种保藏管理中心。
1.3 引物设计与合成 根据Gen-Bank公布的单核细胞增生李斯特菌hlyA基因序列中的保守序列,采用引物设计软件Primer Explorer4.0进行设计,得到一套特异性的LAMP引物,包括外引物 F3、B3和内引物FIP、BIP以及环引物LF、LB,引物序列见表1。引物委托上海生工生物技术有限公司合成。

?
1.4 DNA模版的制备 细菌基因组DNA提取方法参照文献[15],具体步骤为:取一接种环的细菌培养物(约10μL)于1.5 mL离心管中,加入 50μL NaOH(25 mmol/L)混匀,100℃水浴 10 min,加入 4μL Tris-HCl(1 M,pH8.0)进行中和,混悬液4℃20 000 g离心5 min,去沉淀,上清作为LAMP和PCR的DNA模板。
1.5 LAMP扩增 配制LAMP反应体系25μL,包括:10xbst buffer 2.5 μL,MgSO4(25 mmol/L)4 μL、dNTP(10 mmol/L)4 μL、Betaine(5 mol/L)4μL、内引物(20 μmol/L)各 1.5μL、外引物(10 μmol/L)各 0.5μL、环引物(10μmol/L)各0.5μL、Bst DNA 聚合酶大片段(8 U/μL)1μL、DNA模板 2μL以及ddH2O 2.5μL。混匀,于65℃温育60 min,80℃灭活10 min中止反应。产物于2.0%琼脂糖凝胶电泳分析,同时通过向扩增产物中加入1μL SYBRGREEN I,观察颜色变化判断扩增与否。
1.6 LAMP产物的酶切鉴定 取2 μL LAMP扩增产物,加入1μL ClaI、2μL缓冲液及 ddH2O 15μL,轻轻地混合后离心,在37℃酶切1 h,2.0%琼脂糖凝胶电泳观察结果。
1.7 PCR扩增 单核细胞增生李斯特菌PCR反应的引物是检测LM的LAMP反应的两条外引物(F3和B3),见表1。PCR扩增反应体系为:10 ×PCR Buffer 2.5 μL、MgCl2(25 mmol/L)2 μL、dNTP(2.5 mmol/L)2 μL、Taq酶 0.25μL、F3和 B3各 1 μL、模板 2μL,ddH2O 为 14.25 μL。扩增程序为:95℃预变性2 min,95 ℃变性 30 s,56 ℃退火 30 s,72℃延伸1 min,进行35个循环;最后72℃延伸10 min。取PCR产物进行琼脂糖凝胶电泳,用凝胶成像仪观察结果。
1.8 LAMP方法特异性试验 以10株实验菌株的基因组DNA为模板,用建立的LAMP方法进行扩增,电泳观察扩增结果,验证方法特异性。同时用PCR法进行平行检测。
1.9 LAMP方法灵敏度试验
1.9.1 细菌纯培养检测灵敏度 单核细胞增生李斯特菌接种于新鲜的营养肉汤培养基中,37℃培养12 h。用生理盐水进行10倍系列稀释。采用稀释平板法,测定其纯培养物活菌数;同时从每稀释度菌液中取100 μL菌液离心去上清,再加入50μL NaOH(25 mmol/L)混匀,100 ℃水浴10 min, 加 入 4 μL Tris-HCl(1 mol/L,pH8.0)进行中和,混悬液 4 ℃20 000 g离心5 min,去细胞沉淀,取2μL上清作为DNA模板进行LAMP扩增。
1.9.2 人工污染样的检测灵敏度 取经传统方法和常规PCR方法预检单核细胞增生李斯特菌阴性的禽肉25 g,放入225mLLB1培养基中进行均质,取100μL稀释菌液分别接种到900μL均质液中,旋涡混匀,900g离心1 min,上清转入一干净EP管中,再10 000 g离心5 min,去上清,沉淀加入 100μL NaOH(25 mmol/L)混匀,100℃水浴 10min,加入 8μL Tris-HCl(1 M,pH8.0)进行中和,混悬液4℃20 000 g离心5 min,去沉淀,取4μL上清作为LAMP和PCR的DNA模板进行扩增。
2 结果
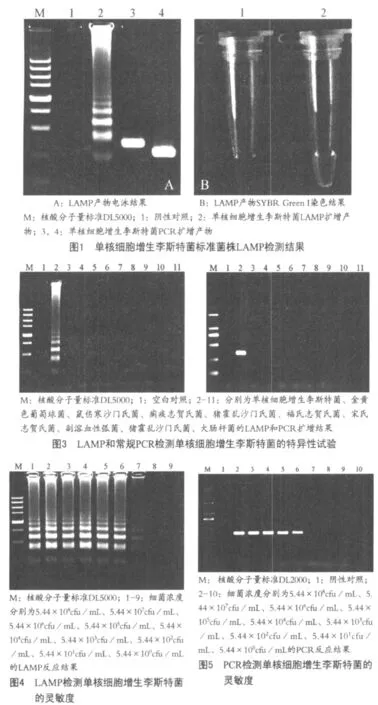
2.1 LAMP检测方法的建立 本研究以设计的一套特异性引物对单核细胞增生李斯特菌基因组DNA进行LAMP扩增。单核细胞增生李斯特菌基因组DNA泳道产生阶梯状条带,以水作为模板的阴性对照未有条带出现(图1A);另外,向扩增产物中加入 1μL SYBR GREEN I,单核细胞增生李斯特菌扩增产物与染料混合后颜色由橙色变为绿色,而阴性对照仍为橙色(如图1B)。结果表明此套LAMP引物能够有效扩增单核细胞增生李斯特菌hlyA基因。
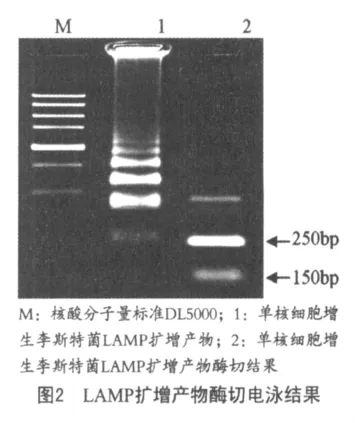
2.2 LAMP扩增产物的酶切鉴定图2显示了单核细胞增生李斯特菌LAMP扩增产物经ClaI酶切消化后的结果。理论计算,扩增产物经内切酶ClaI消化后应为2条分子量约为250 bp和150 bp条带。图中结果与理论值基本相符。
2.3 LAMP检测单核细胞增生李斯特菌的特异性结果 用建立的LAMP方法分别对10株实验菌株进行扩增,特异性试验结果如图3所示,LAMP法和PCR法均具有高特异性,仅单核细胞增生李斯特菌得到阳性结果,其它9株非单核细胞增生均为阴性。
2.4 LAMP检测单核细胞增生李斯特菌的灵敏度结果 经平板计数,原始菌液浓度为5.44×108cfu/mL。10倍系列稀释菌液进行检测,结果显示,LAMP法细菌纯培养物和人工污染样品的检测限约为5.44×102cfu/mL,PCR法细菌纯养物和人工污染样品的检测限为5.44×104cfu/mL(图4)。
3 讨论
单核细胞增生李斯特菌广泛存在于自然界中,可在极端的环境(低温和高盐)中生长,使它很难在食物链中被去除,所以单增李斯特菌在各种食品中均可造成污染,欧美国家曾因此发生多次单增李斯特菌引起的食物中毒,食源性的李斯特菌病已成为一个公共卫生问题。目前我国主要的检测方法为传统的培养方法结合显色培养基和基于生化反应的VITEK系统进行检测,操作较复杂,时间较长,而ELISA试剂盒尽管快速、简便、灵敏,但成本较高。近年来随着分子生物学理论和技术的不断发展,PCR[16-18]、多重 PCR[19-20]、实时荧光PCR[21-22]等在单核细胞增生李斯特菌的检测研究中得到了应用。但这些方法都要耗时4~5 h,并且既要昂贵的仪器设备用于扩增,又要用复杂的方法对产物进行检测,从而限制了它们在基层实验室的推广。因此,亟需开发一种快速、灵敏、方便、价廉的检测方法,以满足对食品中单核细胞增生李斯特菌的实时检测。最近研究表明LAMP方法检测各种食源性致病菌方面具有良好潜力。因此,本研究以单核细胞增生李斯特菌的hlyA基因为靶序列,建立了带有2条环引物的LAMP方法。
单核细胞增生李斯特菌主要的毒力因子有:hlyA、actA、plcA、plcB、prfA、mpl。而检测单核细胞增生李斯特菌常用的靶基因主要有iap、hly、Inl基因[23]。hly基因主要是编码溶血素O的基因,溶血素为李斯特菌的主要致病因子。hly基因是单核细胞增生李斯特菌比较保守的基因,目前多数研究都使用hly基因用以检测单核细胞增生李斯特菌。本研究选择单核细胞增生李斯特菌hlyA基因作为靶基因建立LAMP检测方法,对10株实验菌株进行扩增,只有单核细胞增生李斯特菌得到阳性结果,而其它菌株均为阴性结果,因此该方法特异性强。本方法灵敏度高,对于细菌纯培养物和人工染菌的检测限约为5.44×102cfu/mL,这一结果与文献报道[15,24]的检测限基本相符,且该方法的检测灵敏度是常规PCR的100倍,研究表明,LAMP技术可检测到10个拷贝数甚至更低的靶标,在检测灵敏度上具有更大的优势[25-26]。同时,本研究在LAMP反应中添加2条环引物,环状引物与茎环结构结合的区域在F2和Fl之间(或是B2和B1之间),以F1到F2的方向或是B1到B2的方向结合。这样,茎环DNA或者与内引物杂交,或者与环状引物杂交来启动链置换DNA的合成,从而加快了反应速度,使扩增时间从60 min缩至30 min,与 Hong 和 Yano 等[27-28]的研究报道相符。
综上所述,本研究建立的单核细胞增生李斯特菌LAMP检测方法具有特异性强、灵敏度高、方便快捷、成本低等特点,为单核细胞增生李斯特菌的检测提供了新的发展方向,有望成为简易的常规检测手段,适用于大批量样品的初筛或野外现场进行定性检测。
[1] Farber J M,Peterkin P I.Listeria monocytogenes,a food-borne pathogen[J].Microbiol Rev,1991,55(3):476-511.
[2] Rocourt J,Jacquet C,Reilly A.Epidemiology of human listeriosis and seafoods [J].Int J Food Microbiol,2000,62(3):197-209.
[3] 巢国祥,周晓辉,焦新安.单核细胞增生性李斯特菌PCR快速检测方法建立及应用 [J].中国人兽共患病杂志,2004(9):797-800.
[4]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA [J].Nucleic Acids Res,2000,28(12):E63.
[5]Nagamine K,Watanabe K,Ohtsuka K,et al.Loop-mediated isothermal amplification reaction using a nondenatured template[J].Clin Chem,2001,47(9):1742-1743.
[6]Mori Y,Nagamine K,Tomita N,et al.Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation [J].Biochem Biophys Res Commun,2001,289(1):150-154.
[7] Mori Y,Hirano T,Notomi T.Sequencespecific visual detection of LAMP reactions by addition of cationic polymers[J].BMCBiotechnol,2006,6:3.
[8]Nagamine K,Hase T,Notomi T.Accelerated reaction by loop-mediated isothermal amplification using loop primers[J].Mol Cell Probes.2002.16(3):223-229.
[9] Song T,Toma C,Nakasone N,et al.Sensitive and rapid detection of Shigella and enteroinvasive Escherichia coli by a loop-mediated isothermal amplification method[J].FEMS Microbiol Lett,2005,243(1):259-263.
[10]Okumura T,Nagai F,Yamamoto S,et al.Detection of white spot syndrome virus from stomach tissue homogenate of the kuruma shrimp(Penaeus japonicus)by reverse passive latex agglutination[J].J Virol Methods,2004,119(1):11-16.
[11]Gunimaladevi I,Kono T,Lapatra S E,et al.A loop mediated isothermal amplification(LAMP)method for detection of infectious hematopoietic necrosis virus(IHNV)in rainbow trout(Oncorhynchus mykiss) [J].Arch Virol,2005,150(5):899-909.
[12]Li X,Zhang S,Zhang H,et al.A loop-mediated isothermal amplification method targets the phoPgene for the detection of Salmonella in food samples[J].Int J Food Microbiol,2009,133(3):252-258.
[13]袁文,刘忠华,张钰,等.小鼠肝炎病毒逆转录环介导等温扩增检测技术的建立 [J].中国实验动物学报,2009,17(5):354-359.
[14]张得玉,康艳梅,张翔峰,等.猪生殖与呼吸综合征病毒RT-LAMP检测方法的建立 [J].中国兽医科学,2009,39(10):890-893.
[15]Yamazaki W,Taguchi M,Ishibashi M,et al.Development and evaluation of a loop-mediated isothermal amplification assay for rapid and simple detection of Campylobacter jejuni and Campylobacter coli[J].J Med Microbiol,2008,57(4):444-451.
[16]Bilir OFS,Erol I,Ayaz ND,et al.Immunomagnetic separation and PCRdetection of Listeria monocytogenes in turkey meat and antibiotic resistance of theisolates[J].Br Poult Sci,2008,49(5):560-565.
[17]Cocolin L,Stella S,Nappi R,et al.Analysis of PCR-based methods for characterization of Listeria monocyt genes strains isolated from different sources[J].Int JFood Microbiol,2005,103(2):167-178.
[18]Delibato E,Gattuso A,Minucci A,et al.PCR experion automated electrophoresis system to detect Listeria monocytogenes in foods[J].J Sep Sci,2009,32(21):3817-3821.
[19]Kawasaki S, Fratamico P M,Horikoshi N,et al.Evaluation of a multiplex PCR system for simultaneous detection of Salmonella spp.,Listeria monocytogenes,and Escherichia coli O157:H7 in foods and in food subjected to freezing[J].Foodborne Pathog Dis,2009,6(1):81-89.
[20]Vasconcelos R M,Almeida A E,Hofer E,et al.Multiplex-PCR serotyping of Listeria monocytogenes isolated from human clinical specimens[J].Mem Inst Oswaldo Cruz,2008,103(8):836-838.
[21]de Oliveira M A,Abeid REG,Morato BAM,et al.Quantification of Listeria monocytogenesin minimally processed leafy vegetables using a combined method based on enrichment and 16S rRNA real-time PCR[J].Food Microbiol,2010,27(1):19-23.
[22]Omiccioli E,Amagliani G,Brandi G,et al.A new platform for Real-Time PCR detection of Salmonella spp.,Listeria monocytogenes and Escherichia coli O157 in milk[J].Food Microbiol,2009,26(6):615-622.
[23]Rodriguez-Lazaro D,Hernandez M,Scortti M,et al.Quantitative detection of Listeria monocytogenes and Listeria innocua by real-time PCR:assessment of hly,iap,and lin02483 targets and AmpliFluor technology[J].Appl Environ Microbiol,2004,70(3):1366-1377.
[24]Yamazaki W,Ishibashi M,Kawahara R,et al.Development of a loop-mediated isothermal amplification assay for sensitive and rapid detection of Vibrio parahaemolyticus[J].BMC Microbiol,2008,8:163.
[25]Mori Y,Kitao M,Tomita N,et al.Real-time turbidimetry of LAMP reaction for quantifying template DNA [J].J Biochem Biophys Methods,2004,59(2):145-157.
[26]Suzuki R,Yoshikawa T,Ihira M,et al.Development of the loop-mediated isothermal amplification method for rapid detection of cytomegalovirus DNA[J].J Virol Methods,2006,132(1-2):216-221.
[27]Hong T C,Mai Q L,Cuong D V,et al.Development and evaluation of a novel loop-mediated isothermal amplification method for rapid detection of severe acute respiratory syndrome coronavirus[J].JClin Microbiol,2004,42(5):1956-1961.
[28]Yano A,Ishimaru R,Hujikata R.Rapid and sensitive detection of heat-labile I and heat-stable I enterotoxin genes of enterotoxigenic Escherichia coli by Loop-Mediated Isothermal Amplification[J].J Microbiol Methods,2007,68(2):414-420.

