采后热水处理对苹果梨青霉病的抗性诱导
李红霞,毕 阳,*,伍利芬,李科玮,高雄杰
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃农业大学农学院,甘肃兰州730070)
采后热水处理对苹果梨青霉病的抗性诱导
李红霞1,毕 阳1,*,伍利芬2,李科玮1,高雄杰1
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃农业大学农学院,甘肃兰州730070)
由扩展青霉(Penicillium expansum)引起的青霉病是梨果实采后的主要病害。研究了采后45℃热水浸泡15min处理对苹果梨果实损伤接种P.expansum的诱抗效果及部分机理。结果表明:热水处理后不同时间间隔(0、24、48h)接种病原物对果实病斑直径的扩展抑制存在差异,其中以间隔48h的抑制效果最为明显,接种后第4d的病斑直径仅为间隔0h接种的33.2%,同样,热水处理后48h接种处理的病斑直径也显著低于同期的室温水处理,其中以接种后第8d的差异最为明显,为同期对照的68.7%。热水处理可明显提高损伤接种果实的PAL、POD和PPO活性,PAL活性在接种后第6d高出对照2.76倍,PPO活性在接种后第4d是对照的1.96倍,热水处理还可有效增加损伤接种果实的总酚、类黄酮和木质素含量。上述结果表明,热水处理可通过诱导果实的抗性来抑制苹果梨损伤接种果实病斑直径的扩展。
热处理,果实,采后病害
苹果梨是甘肃省名优特产,但在采后贮运过程中易受扩展青霉(Penicillium expansum)侵染而发生青霉病,虽然采用化学杀菌剂可有效控制仁果类的青霉病[1],但均存在农药残留、环境污染和病原菌产生抗药性等问题,因此急需寻找新的、更安全有效的控制方法[2]。采后热处理具有无化学残留、安全性高、便于操作等特性,可用于采后病害的控制[3]。据报道,采用热空气处理可显著降低苹果青霉病的病斑直径及发病率[4-5]。但尚未见采后热水处理对梨采后病害的控制报道。热水处理的作用机理与其直接抑制病原物的生长和诱导产品产生抗性相关[2,6]。本文拟探讨采后热水处理对苹果梨青霉病的诱抗效果,分析处理后果实体内的抗性生化指标变化,以丰富采后热处理的诱抗机理。
1 材料与方法
1.1 实验材料
供试苹果梨(Pyrus bretschneideri cv.Pingguoli)于2008年10月采自甘肃省国营张掖九公里园艺农场,单果包纸,纸箱包装后运抵本校,室温(18±2℃)下贮藏待用;供试P.expansum 分离于自然发病梨果实,PDA上保存待用。
1.2 实验方法
1.2.1 热水处理 选取大小均匀一致,无任何损伤果实在恒温水浴锅(HH-4金坛市荣华仪器制造有限公司江苏)中45℃下浸泡处理15min,取出晾干后分别于0、24、48h后进行损伤接种。每处理用果实6个,重复3次。
1.2.2 果实损伤接种 孢子悬浮液的配置参照刘红霞等方法并修改[7]。先将28℃下在PDA上培养4d的P.expansum孢子用含0.01%Tween-80的无菌水用玻璃棒刮下,然后转入50mL三角瓶中,在混合器上振荡15s,再用双层纱布过滤,滤液用血球计数板计数算出孢子悬浮液的浓度,最后稀释至所需浓度(2 ×106个/mL)。
果实经75%酒精表面消毒后,用灭菌铁钉(直径3mm)在表面等距离刺孔8个(深3mm,其中赤道部位4个,上下萼洼附近各处2个),取20μL上述孢子悬浮液接入孔内。稍作晾干后入包装箱,塑料薄膜覆盖保湿,于(18±2)℃,RH 85%~90%下贮藏观测病斑直径。
1.2.3 生化分析取样 参照Bi等方法[8]并修改。取热水处理后48h接种果实于处理后0、2、4、6、8、10d削取病斑以外3~5mm处的果皮1g,用直径5mm打孔器打取病斑以外3~5mm处皮下2~3mm处果肉组织3g。铝箔纸包裹,液氮冷冻,在-80℃超低温冰箱中保存待用,以室温水处理48h后接种为对照。
1.2.4 抗性酶活性测定
1.2.4.1 苯丙氨酸解氨酶(Phenylalnine ammonialyase,PAL)活性测定 参照 Assis方法[9]并修改。在290nm下测定吸光度变化,以每小时内A290变化0.01为1个活性单位(U)。酶活性单位为U/mg protein。
1.2.4.2 过氧化物酶(Peroxidase,POD)活性的测定
参照Chance and Maehly方法[10]并修改。酶活性以每分钟A470变化0.01为1个活性单位(U),表示为U/mg protein。
1.2.4.3 多酚氧化酶(Polyphenol oxidase,PPO)活性测定 参考Chen等方法[11]并改进。酶活性以每分钟A525变化0.01为1个活性单位(U),表示为U/mg protein。
1.2.5 苯丙烷代谢产物含量测定
1.2.5.1 总酚和类黄酮含量测定 参照 Pirie and Mullins方法[12]并修改。分别于280nm和325nm测定总酚和类黄酮含量。总酚含量以A280/g FW表示;类黄酮含量以A325/g FW表示。
1.2.5.2 木质素含量测定 参照 Morrison方法[13]并修改。在280nm下测定吸光度,木质素含量以A280/g FW表示。
1.2.6 蛋白含量测定 参照Bradford方法测定[14],以牛血清蛋白(BSA)为标准蛋白作标准曲线,计算蛋白含量,上述各项生化分析均设平行样6个,重复3次。
1.2.7 数据统计 病斑直径数据处理用 Microsoft Excel 2003和DPS3.01数据处理系统计算标准偏差(±SE)并进行Duncan’s多重差异显著分析,其余数据统计后计算标准偏差(±SE)。
2 结果与分析
2.1 热水处理后不同时间间隔和不同温度处理后48h损伤接种P.expansum对病斑直径的影响
热水处理后不同时间间隔接种病原物对果实病斑直径的影响存在差异。以间隔0h接种病斑直径最大,间隔24、48h后接种均能够显著抑制病斑直径的扩展,其中以间隔48h的效果最为明显,不仅在接种后的10d内病斑直径均显著低于0h接种,而且接种后第2d和4d的病斑直径仅是0h接种的39.8%和33.2%(图1A)。同样,热水处理后48h接种处理的病斑直径也显著低于同期的室温水处理对照,其中以接种后第6d和8d的差异最为明显,分别为同期对照的73.2%,68.7%(图1B)。
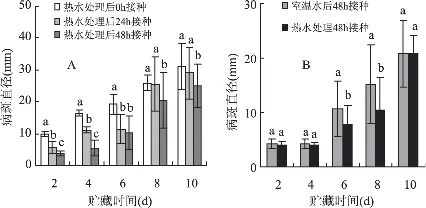
图1 热水处理后不同时间间隔(A)和不同温度处理后间隔48h(B)损伤接种P.expansum对病斑直径的影响
2.2 热水处理对果实体内3种抗性酶活性和3种抗性物质含量的影响
热处理可以显著提高果实体内的3种抗性酶活性,其中以PAL变化最为明显。在培养期间处理和对照的PAL的活性均呈单峰形变化,但处理果实的PAL活性始终明显高于对照,在第6d差异达到最大,比对照高出2.76倍(图2A)。同样,热处理也明显提高了果实的POD和PPO活性,处理组的PPO在前4d迅速上升,在第8d达到最大值,后迅速下降,而对照组在前6d缓慢上升且在第6d达到最大酶活,在第4d时差异最显著,处理组活性是对照的1.96倍,但是处理组始终高于对照。POD的活性变化与PPO基本一致(图2B,2C)。
热处理可以在一定程度上提高梨果实体内的总酚和木质素含量,其中以木质素含量变化较为明显(图2F)。总酚含量除了处理后第2d和10d外,均高于对照(图2D),热水处理还有效提高了类黄酮含量(图2E)。
3 讨论
热水处理后48h果实损伤接种P.expansum的病斑直径显著低于室温水处理的对照(图1B),表明热处理可以通过诱导果实体内的抗病性来有效抑制病斑直径的扩展。热水处理后间隔48h损伤接种P.expansum的病斑直径显著低于间隔0h和24h(图1A),说明热水处理对果实抗病性的诱导具有周期性。PAL、POD和PPO活性,以及总酚、类黄酮和木质素含量是指示果实抗病性是否被诱导的重要生化指标[4]。热水处理后果实体内的PAL、POD和PPO活性明显提高,以及总酚、类黄酮和木质素含量的增加(图2),表明热水处理激活了果实体内的抗性生化反应[4]。该结果与邵兴峰等的研究结果基本一致[4]。PAL是苯丙烷类代谢途径中的第一关键酶,它与酚类物质、木质素及植保素等抗病物质的合成有关,该酶活性越高,说明果实的抗病性越强[15]。PPO可使果实体内积累的酚类物质氧化成高毒性的醌类物质,进而起到对病原物的毒杀作用,从而抑制病原物的生长[16]。POD可催化酚类物质的前体聚合为木质素,起到加固植物细胞壁、抵抗病原物侵袭的作用,还是细胞内清除自由基的保护酶。热水处理提高了POD活性,有利于木质素和植保素的合成,增加了细胞壁的抗病能力[17]。热水处理还显著提高了梨果实内三种重要的抗性物质总酚、类黄酮和木质素的含量,从而提高了梨果实的抗病性。类黄酮作为植物保卫素具有抑制真菌孢子萌发、芽管伸长、菌丝生长作用[18]。酚类物质在PPO作用下可氧化成能对病原菌产生直接毒性的醌类物质,能有效抑制病原菌的扩展[16]。木质素可形成阻止病原物侵入寄主的机械屏障,加强了寄主抗真菌的能力[19]。
综上所述,热水处理对苹果梨青霉病的抑制与其增强果实体内的苯丙烷代谢密切相关。此外,还有一些其他的抗性机理涉及其中,尚需进一步探讨。
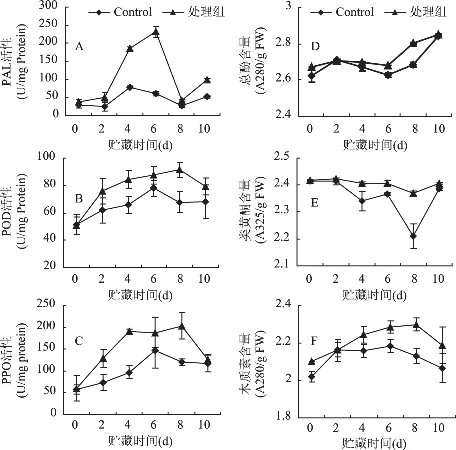
图2 热水处理和P.expansum挑战接种对果实体内PAL(A)、POD(B)和PPO(C)活性以及总酚(D)、类黄酮(E)和木质素(F)含量的影响
[1]张维一,毕阳.果蔬采后病害控制[M].北京:中国农业出版社,1996:132-157.
[2]陈丽,朱世江,朱虹,等.热水处理减轻采后香蕉病害的效果及其机理探讨[J].农业工程学报,2006,22(8):224-229.
[3]王世珍,张红印,黄星奕.热处理对水果采后病害防止的研究进展[J].食品科学,2008,29(2):477-480.
[4]邵兴锋,屠康,静玮,等.热处理对红富士苹果贮藏期间青霉病的抑制效果[J].园艺学报,2007,34(3):743-746.
[5]Tu K,Shao X F,Chen L,et al.Effects of pre-storage air treatments on the post-harvest quality and blue mold control of‘Red Fuji’apple fruit[J].Acta Horticulturase,2006(12):793-798.
[6]张红印,王世珍,黄星奕,等.热水处理对桃果采后青霉病及自然腐烂的控制[J].农业工程学报,2008,24(8):294-297.
[7]刘红霞,毕阳,郭玉蓉,等.采后浸泡或真空渗透钙、钡、镁对金矮生苹果青霉病的影响[J].甘肃农业大学学报,1998,33(4):404-408.
[8]Bi Y,Tian S P,Zhao J,et al.Harpin induces local and systemic resistance against Trichothecium roseum in harvested Hami melons[J].Post-harvest Biology and Technology,2005,38(2):183-187.
[9]Assis J S,Maldonado R,Munoz T,et al.Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J].Post-harvestBiology and Technology,2001,23:33-39.
[10]Chance B,Maehly A C.Assay of catalases and peroxidases[J].Methods in Enzymology,1955(2):764-775.
[11]Chen C,Bélanger R R,Benhamou N,et al.Defense enzymes induced in cucumber roots by treatment with plant growthpromoting rhizobacteria(PGPR)and Pythium aphanidermatum[J].Physiological and Molecular Plant Pathology,2000,56:13-23.
[12]Pirie A,Mullins M G.Changes in anthocyanin and phenolic content of grapevine leaf and fruit tissue treated with sucrose,nitrate and abscisic acid[J].Plant Physiology,1976,58:468-472.
[13]Morrison I M.A semi-micro method from the determination of lignin and its use in predicting the digestibility of forage crops[J].Science of Food and Agriculture,1972,23:455-463.
[14]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[15]Whetten R,Sederoff R.Lignin Biosynthesis[J].Plant Cell,1995(7):1001-1013.
[16]Shadle G L,Wesley S V,Korth K L,et al.Phenylpropanoid compounds and disease resistance in transgenic tobacco with altered expression of L-phenylalanine ammonia-lyase[J]. Phytochemistry,2003,64(1):153-161.
[17]Brisson L F,Tenhaken R,Lamb C.Function of oxidative cross-linking of cell wall structural proteins in plant disease resistance[J].Plant Cell,1994(6):1703-1712.
[18]Deng Y Y,Ming J,Zeng K F.Effects of Chitosan Coating on Disease Resistance and Storage Quality of Navel Orange Fruit[J].Food Science,2008,29(11):656-661.
[19]Hammerschmidt R,Kug J.Lignification as a mechanism for induced systemic resistance in cucumber[J].Physiol Plant Pathol,1982,20:61-67.
Post-harvest hot water treatment induces resistance against Penicillium expansum in pear fruit
LI Hong-xia1,BI Yang1,*,WU Li-fen2,LI Ke-wei1,GAO Xiong-jie1
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.College of Agronomy,Gansu Agricultural University,Lanzhou 730070,China)
Blue mold caused by Penicillium expansum was a major post-harvest disease in pear.lnduction resistance effect and partial mechanisms of post-harvest hot water dipping in 45℃ for 15min against blue mold inoculated with P.expansum in pea(rcv.Pingguoli)were investigated.The results showed that different inoculation interva(l0,24,48h)after hot water treatment had a difference lesion diameter.The interval of 48h had the smallest lesion diameter,which was 33.2%of 0h interval.Meanwhile hot water treatment at interval 48h inoculation had a smaller lesion diameter,and was 68.7%of the control after 8d of inoculation.Hot water treatment significantly enhanced the activity of phenylalnine ammonialyase(PAL)peroxidase(POD)and polyphenol oxidase(POD)in fruit inoculated with P.expansum.The activity of PAL and PPO were 2.76 and 1.96 times higher than the control after 6d and 4d of inoculation.Hot water treatment also increased the content of total phenolics flavonoid and lignin.lt is suggested that hot water treatment inhibits the lesion diameter of pear fruit inoculated with P.expansum by induction resistance.
hot water treatment;fruit;post-harvest disease
TS255.3
A
1002-0306(2010)11-0329-03
2009-11-04 *通讯联系人
李红霞(1982-),女,在读硕士,研究方向:果蔬防腐与保鲜。
国家支撑计划(2006BAD22B02)。

