蛹虫草深层培养产纤溶酶条件的优化
陈慧鑫,刘晓兰,李巍巍,时 晰,郑喜群
(齐齐哈尔大学食品与生物工程学院,黑龙江省农产品加工重点实验室,黑龙江齐齐哈尔161006)
蛹虫草深层培养产纤溶酶条件的优化
陈慧鑫,刘晓兰*,李巍巍,时 晰,郑喜群
(齐齐哈尔大学食品与生物工程学院,黑龙江省农产品加工重点实验室,黑龙江齐齐哈尔161006)
蛹虫草是名贵中药材之一,本课题组发现其液体发酵物中含有较强的纤溶活性物质,具有开发成溶栓药物的潜力。以本实验室已优化的蛹虫草深层培养产纤溶酶的培养条件为基础,对蛹虫草深层培养产纤溶酶的条件进一步优化,并对其深层培养产纤溶酶过程从摇瓶条件到10L发酵罐进行比拟放大。实验结果表明:蛹虫草深层培养产纤溶酶的最适培养条件为蔗糖2%、豆饼5%,250mL三角瓶装液量为50mL,23℃培养5d,培养基初始pH为自然(6.0左右),接菌量为直径1cm菌片一片(每50mL)或深层培养3~5d的液体菌种0.5%(V/V);10L发酵罐在搅拌转速和通风量为100r/min,600L/h的条件下纤溶酶活力达286.21U/mL(尿激酶单位),较摇瓶条件下的酶活力提高了3.2倍,纤溶酶对菌丝生物量的得率较摇瓶条件下提高了5.5倍。
蛹虫草,深层培养,纤溶酶,发酵罐
蛹虫草(Cordyceps militaris(L.)Link)又名北冬虫夏草,隶属于虫草属(Cordyceps),在我国的黑龙江、吉林、辽宁等省份都有野生分布[1-2],蛹虫草中含有核苷类、多糖类等多种有效成分[3-5],具有补虚损、益精气、保肺、益肾、滋补强壮等功效[6-9],其药用价值可与人参和鹿茸相媲美。近年来人们对蛹虫草的生物学特性、药理作用等方面进行研究,取得了一些成果[10-12]。本课题组发现蛹虫草液体发酵物中含有较强的纤溶活性物质,具有开发成溶栓药物的潜力。血栓性疾病是严重危害人类健康的疾病之一,其致残率和死亡率较高[13]。目前国内外已正式批准临床使用的溶栓药物有链激酶(SK)、尿激酶(UK)、组织型纤溶酶原激活剂(t-PA)等,这些药物疗效肯定,但还存在许多缺陷,且价格昂贵,因此,研制新型溶栓药物的需求迫切。微生物种类繁多,生长迅速,是获得溶栓剂的重要来源。日本学者在纳豆中发现了纳豆激酶(NK)[14-15],激发了人们从微生物中寻找新型溶栓剂的热情,几种微生物来源的纤溶酶陆续在中国豆豉[16-17],韩国大豆酱[18],韩国咸鱼[19],亚洲传统食品虾酱[20],印尼豆豉[21]等发酵食品中被发现。本课题组在蛹虫草液体发酵物中纯化得到了两种新的纤溶酶(专利“一种真菌纤溶酶及其培制方法(200810137564.4)”和“一种蛹虫草纤溶酶及其培制方法(200910073373.0)”),并发现它们的性能良好(另文发表)。目前关于大型真菌深层培养生产酶类的研究大多局限于摇瓶条件,生产规模小,难以满足需求,而利用发酵罐深层培养大型真菌生产酶类产物未见报道。本文对蛹虫草深层培养产纤溶酶的条件进行优化,并在10L发酵罐中进行比拟放大,为蛹虫草纤溶酶的工业化生产奠定基础。
1 材料与方法
1.1 实验材料
蛹虫草(Cordyceps militaris) 由齐齐哈尔大学食品与生物工程学院提供;改良PDA斜面/平板培养基 葡萄糖1%,蛋白胨0.5%,KH2PO40.1%,MgSO40.05%,琼脂2.5%,20%土豆汁,pH自然;发酵培养基 蔗糖2%,豆饼5%。
1.2 实验方法
1.2.1 深层培养方法 初始培养条件为蔗糖2%、豆饼5%,250mL三角瓶装液量为50mL,接种量为直径1cm菌片1片,23℃、180r/min培养。优化培养条件的过程以初始条件作对照,每一实验条件做三个平行。
1.2.2 蛹虫草纤溶酶活力的测定 发酵液在10000r/min、4℃离心10min,取上清液10μL点于血纤维蛋白平板上,37℃保温6h,测定溶圈直径,计算面积,纤溶酶活力与溶圈面积呈正相关,由于不同批次市售尿激酶标定活力单位存在差异,致使标准曲线不统一,因此本实验暂采用10μL发酵液在血纤维蛋白平板上的溶圈面积表示溶栓酶活力。
1.2.3 血纤维蛋白平板制备(配制10个平板) 参照Astrup[22]方法,有所改动,取0.25g琼脂糖加入50mL生理盐水中,加热溶解后置45℃水浴中保温30min后加入500U/mL的凝血酶500μL,混匀。取2支80mg/支血纤维蛋白原溶于50mL巴比妥钠缓冲液(pH7.8)中,置45℃水浴中保温5min。分别取5mL凝血酶溶液与5mL血纤维蛋白原溶液混合均匀后,快速倒入φ9cm平皿中,水平放置30min后置冰箱中备用。
1.2.4 菌丝生物量的测定 发酵液在10000r/min、4℃离心10min,沉淀物上层为菌丝体,下层为豆饼渣,将菌丝体与豆饼渣分离后用蒸馏水洗涤3次,60℃烘干至恒质量,测菌丝体生物量。
1.2.5 KLa的测定 摇瓶条件下及10L发酵罐中的KLa测定采用亚硫酸钠氧化法[23]。
2 结果与讨论
2.1 初始培养条件的确定
酶的生物合成受基因和培养环境的双重控制,纤溶酶作为一种诱导酶,底物选择尤为重要。微生物培养过程中,碳源可构成菌体及目标产物的碳骨架、并可为其代谢提供能源;氮元素是细胞内蛋白质、核酸等的重要组成部分。本课题组在前期的实验中对5种碳源(蔗糖、葡萄糖、淀粉、麦芽糖、土豆汁)和5种氮源(大豆粉、豆饼粉、豆粕粉、豆浆、玉米蛋白粉)进行了筛选,并对碳氮源的适合比例进行了实验考察。结果表明,以蔗糖2%,豆饼5%为培养基时,纤溶酶产量最高。
本实验考察了培养温度(18,21,23,25,27℃)对纤溶酶产量的影响。结果表明,温度在21~25℃范围内,菌体产酶活力变化不大,23℃时酶活略高,当温度低于21℃或高于27℃时,产酶明显受到抑制,因此在实际生产过程中,只要控温在21~25℃即可。
摇瓶培养过程中,在摇床转速一定的情况下,不同的装液量会对菌体的生长及其代谢产物产生较大的影响。本实验考察了装液量(250mL三角瓶中装液量为30、40、50、60、70mL)对纤溶酶产量的影响,结果表明,在装液量30~50mL的范围内,纤溶酶产量变化不大,装液量超过50mL,纤溶酶产量则呈现下降趋势,在发酵生产过程中,相同的空间装液量大,可获得更多的目标产物,故本实验选取250mL三角瓶装液量为50mL。
2.2 培养时间的确定
特定培养条件下的微生物生长曲线对指导发酵生产具有重要意义,可根据需要在不同时期进行收获。工业生产中一般要获得目标产物最大产量,还要节省生产成本,因此,确定最适培养时间意义重大。按初始培养条件深层培养蛹虫草8d,每隔24h取样,测定发酵液中的纤溶酶产量,实验结果如图1所示。

图1 培养时间对纤溶酶产量的影响
结果表明,发酵至第3d后开始产酶,到第5d时,酶活趋于稳定,之后随时间延长,酶活没有明显增加。虽然第6d酶活略高于第5d,但考虑到实际生产效率问题,将最适培养时间定为5d。
2.3 培养基初始pH的确定
pH对微生物的生命活动有很大影响,其影响微生物原生质膜所带电荷以及某些营养物质的分解和电离程度,从而影响微生物对养分的吸收以及代谢产物的生成。分别用0.2mol/L及2mol/L盐酸和氢氧化钠逐个调节发酵培养基初始pH为3~10,以pH自然(6.0)做对照,培养条件同上。实验结果如图2所示。
实验结果表明,发酵液初始pH在5~8范围内,菌体产酶活力变化不大。低于5或高于8时,酶活明显受到抑制,因发酵培养基初始pH为6.0左右,所以无需调整。王永敏[24]等在研究pH对蛹虫草菌丝体与胞外多糖得率的影响中也发现初始pH在6.5~8范围内,目标产物的得率无显著差异。微生物的代谢活动还会改变所处环境的pH,本实验中发现蛹虫草菌有调节环境pH能力,无论初始pH如何,培养环境pH都有向中性变化的趋势,说明蛹虫草菌发酵过程中可能既能发酵糖产生酸性物质,也有蛋白脱羧产氨作用。在环境pH为碱性时,可能发酵糖产酸作用占主导;在环境pH为酸性时,可能蛋白脱羧产氨作用占主导。
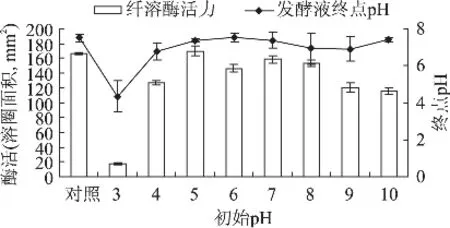
图2 培养基初始pH对纤溶酶产量及发酵终点pH的影响
2.4 接种量的确定
采用较大的接种量可缩短菌体生长达到高峰的时间,使产物的合成提前,但如接种量过大,可能使菌体生长过快,培养液黏度增加,溶氧不足,影响产物的合成;此外,接菌量过大也会导致前培养成本增加。而接菌量过低,菌体生长缓慢,会严重影响生产效率,因此,适宜接菌量的确定至关重要。在基本发酵培养基中,分别接入直径为1cm的菌苔圆片1~5片,培养条件同上。结果如图3所示。
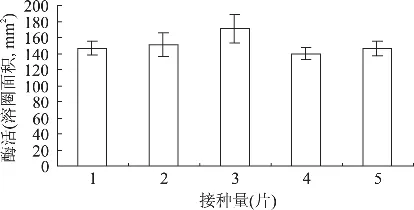
图3 接种量对纤溶酶产量的影响
结果表明,实验范围内接菌量对菌体产酶影响不大,从经济角度考虑,将接菌量定为直径1cm菌片一片。
2.5 液体菌种接种量和菌龄的确定
工业生产中多将斜面保藏的菌种接入液体培养基中,制成二级液体种子,再利用二级种子作为深层培养的接种物,该法可有效地提高接种量,同时缩短菌种从固体到液体培养的适应时间,缩短菌体生长停滞期,从而缩短生产周期,提高生产效率。基于此,在基本发酵培养基中,分别接入深层培养3d的二级蛹虫草菌种0.5%,1%,1.5%,2%,2.5%(V/V),培养条件同上。结果如图4所示。
结果表明,在实验考察范围内液体菌种的接种量对纤溶酶产量影响较小,各水平获得的纤溶酶产量相当。其原因可能为蛹虫草深层培养的周期较长,初期因接菌量的不同而导致纤溶酶产量的差异随培养时间的延长而变得不明显。较小的接菌量节约了前培养成本,即0.5%(V/V)较适合作为液体菌种接菌量。文庭池[25]在蛹虫草高产虫草菌素的深层培养工艺研究中发现接种量对蛹虫草的生物量和虫草素的产量只有很小的影响,此结论与本实验的优化结果相同。

图4 液体接菌量对纤溶酶产量的影响
真菌生长曲线有别于细菌典型生长曲线,可分为生长停滞期、迅速生长期、衰退期三个阶段。在生长停滞期,菌体调整酶系以适应新的培养环境;迅速生长期中碳、氮等元素被迅速利用,呼吸强度达到顶峰,一些代谢产物积累;衰退期中有些真菌菌丝体自溶,有毒代谢产物积累。确定合适生长时期的液体菌种对酶生产意义重大。在基本发酵培养基中接入培养1~8d的液体种子(接菌量为0.5%),培养条件同上,结果如图5所示。

图5 菌种的菌龄对纤溶酶产量的影响
结果表明,液体菌种菌龄为3~5d时,蛹虫草深层培养产纤溶酶的量差别不大。菌龄在小于3d时,纤溶酶的产量是逐渐增加的;菌龄大于5d以后,纤溶酶的产量逐渐减少了。原因可能是3~5d的液体菌种正处于迅速生长期,菌体代谢旺盛,生长快速,较适合作为蛹虫草深层培养产纤溶酶的液体菌种。
2.6 10L发酵罐中试实验
经过优化,蛹虫草在摇瓶培养条件下可获得较高的纤溶酶产量,但摇瓶条件生产纤溶酶,由于其生产规模较小而难以满足需求,因此必须将摇瓶中优化好的深层培养条件在大型的设备中予以重现,以实现大规模生产。氧是好氧发酵的限制性基质,所以氧的提供往往就成为好氧微生物代谢产物形成的重要影响因素。早在20世纪50年代,就有学者提出以KLa为原则进行发酵工艺放大,并在实践中取得了较好的结果[26]。本实验根据KLa相同的原则进行比拟放大,10L发酵罐在搅拌转速和通风量分别在50r/min,700L/h;100r/min,600L/h;150r/min,500L/h下的KLa与摇瓶条件下的KLa较为接近。根据初步确定的搅拌转速和通风量进行实罐发酵,10L的发酵罐中装液量为7L,其他条件同摇瓶培养条件,每隔12h取样,测定纤溶酶活力,并以摇瓶的实验结果做对照,结果如图6所示。
结果表明,在10L发酵罐中,搅拌转速100r/min,通风量600L/h的深层培养条件下,蛹虫草纤溶酶的产量明显高于摇瓶条件下纤溶酶产量,发酵时间为108h时纤溶酶活力达到最高,在血纤维平板上的溶圈面积可达214.28mm2(相当于尿激酶286.21U/mL),比摇瓶条件下纤溶酶溶圈面积154.74mm2(相当于尿激酶89.26U/mL)大38.48%;在搅拌转速50r/min,通风量700L/h的深层培养条件下,蛹虫草纤溶酶的产量与摇瓶条件下纤溶酶产量较为接近,但未超过摇瓶条件下的纤溶酶产量;搅拌转速150r/min,通风量500L/h的深层培养条件下,蛹虫草纤溶酶的产量明显低于摇瓶条件下纤溶酶产量。因此,在考察范围内,搅拌转速100r/min,通风量600L/h的深层培养条件较适合作为10L发酵罐深层培养蛹虫草生产纤溶酶的培养操作条件。

表1 纤溶酶产量最大时纤溶酶对菌丝体的得率
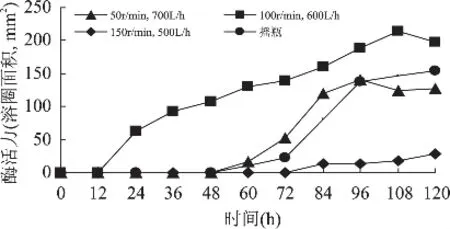
图6 10L发酵罐中不同培养条件对纤溶酶产量的影响
药用真菌深层培养产生的活性代谢产物含量相对较低,在工业化生产中,如果仅以一种产物为目的,将耗费大量成本,因此应开展多产物联产发酵研究。蛹虫草作为高级的滋补品,其菌丝体具有较高的经济价值,在深层培养蛹虫草生产纤溶酶的过程中,蛹虫草的菌丝体作为副产物可被收集加工成为保健品和滋补品,从而实现纤溶酶和蛹虫草菌丝体的联产,提高经济效益,减少资源的浪费。在10L发酵罐实罐发酵的过程中,同时监测菌丝生物量,在保证纤溶酶产量的前提下,尽可能地收集蛹虫草菌丝,实验结果如图7所示。

图7 10L发酵罐中不同培养条件对蛹虫草菌丝生物量的影响
结果表明,在考察范围内,菌丝体随搅拌转速的增加呈现递增趋势,其可能的原因是随搅拌转速的增加,培养基的混合更加均匀,从而提高了蛹虫草对底物的的利用率,其中在搅拌转速150r/min,通风量500L/h的深层培养条件下,蛹虫草菌丝生物量在120h时可达 34.48g/L,比摇瓶条件下的最大值28.81g/L提高了19.68%。本课题组李春丽[27]等在蛹虫草深层培养产菌丝体及胞外多糖的研究过程中,实现了蛹虫草菌丝体和胞外多糖的联产,并利用10L发酵罐进行比拟放大,使菌丝体和胞外多糖的产量也较摇瓶条件下均有较大提高。
10L发酵罐中不同深层培养条件下,纤溶酶产量最大时,纤溶酶对菌丝体的得率如表1所示。
表1的结果表明,在10L发酵罐中,搅拌转速100r/min,通风量600L/h的培养条件下,纤溶酶的得率相对最高,较摇瓶条件下提高了5.5倍。
3 结论
本论文以蛹虫草为菌种,对其深层培养产生纤溶酶的部分工艺条件进行了优化,并利用优化的工艺条件在10L发酵罐中进行了中试实验,取得主要结论如下:蛹虫草深层培养产纤溶酶的最适培养条件为蔗糖2%、豆饼5%,250mL三角瓶装液量为50mL,23℃培养5d,发酵液初始pH为自然(6.0左右),接菌量为直径1cm菌片一片(每50mL)或深层培养3~5d的液体菌种0.5%(V/V);10L发酵罐在搅拌转速和通风量为100r/min,600L/h的条件下,纤溶酶的溶圈面积可达 214.28mm2,相当于尿激酶286.21U/mL,较摇瓶条件下的酶活力提高了3.2倍,纤溶酶对菌丝生物量的得率较摇瓶条件下提高了5.5倍。
[1]邵力平.真菌分类学[M].北京:中国林业出版社,1984:109.
[2]Alexopoulos C J,Blackwell M,Mims C W.菌物学概论[M].第四版.北京:中国农业出版社,2002.
[3]廖春丽,方改霞,王莲哲,等.蛹虫草主要有效成分分析[J].安徽农业科学,2008,36(12):5050-5052.
[4]Bok J W,Lermer L,Chilton J.Antitumor sterols from the mycelial of Cordyceps sinensis[J].Phytochemistry,1999,51:891-898.
[5]Cunningham KG,Manson W ,Spring FS,et al.Cordycepin,a Metalmlic Product Isolated from Cultures of Cordyceps Militaris(Lim·)Link[J].Nature,1950,2166(4231):949.
[6]连云岚,杨中林.北虫草化学成分及药理作用研究进展[J].山西医药杂志,2006,35(1):44-46.
[7]叶博.北虫草药理作用研究[J].安徽农业通报,2009,15(9):52-54.
[8]张安宁,袁书林.不同剂量蛹虫草菌丝体对大鼠免疫功能的影响[J].食品研究与开发,2009,30(3):30-34.
[9]宾文,宋丽艳,于荣敏,等.人工培养蛹虫草多糖的抗炎及免疫作用研究[J].时珍国医国药,2003,14(1):1-2.
[10]刘静明,钟裕容,杨智.蛹虫草化学成分研究[J].中国中药杂志,1989,14(10):608-609.
[11]林树钱,余美兰.人工虫草的研究和开发现状[J].中国食用菌,1997,16(1):5-7.
[12]刘春泉.北冬虫夏草多糖组分的分离纯化及结构研究进展[J].食品科学,2007,28(1):370-373.
[13]鲁艳莉,宁喜斌.血栓形成机理及溶血栓药物的研究进展[J].食品研究与开发,2006,27(1):169-172.
[14]Datar RV,Cartwright T,Rosen CG.Process economic of animal cell and bacterial fermentations:A case study analysis of tissue plasminogen activateor[J].Bio/Technol,1993,11:349-352.
[15]Sumi H,Hamada H,Tsushima H,et al.A novel fibrinolytic enzyme(nattokinase)in the vegetable cheese Natto;a typical and popular soybean food in the Japanese diet[J].Birkhauser Verlag,1987,43:1110-1111.
[16]Fujita M,Nornura K,Hong K,et al.Purification and characterization of a strong fibrinolytic enzyme(Nattokinase)in the vegetable cheese natto,a popular soybean fermented food in Japan[J].Biochem Biophy Res Commun,1993,197(3):1340 -1346.
[17]Cheng T W,Bao P J,Bo L,et al.Purification and characterization of a fibrinolytic enzyme of Bacillus subtilis DC33,isolated from Chinese traditional Douchi[J].J Ind Microbiol Biotechnol,2006,33:750-758.
[18]Kim W,Choi K,Kim Y.Purification and characterization of a fibrinolytic enzyme produced from Bacillus sp.Strain CK11-4 screened from Chungkook-Jang[J].Applied and Environmental Microbiology,1996,62:2482-2488.
[19]Nack-Shick Choi,Jae Jun Song,Dong-Min Chung,et al. Purification and characterization of a novel thermoacid-stable fibrinolytic enzyme from Staphylococcus sp.strain AJ isolated from Korean salt-fermented Anchovy-joet[J].J Ind Microbiol Biotechnol,2009,36:417-426.
[20]Wong A H K,Mine Y.A novel fibrinolytic enzyme in fermented shrimp paste.A traditional Asian fermented seasoning[J].Journal of Agricultural and Food Chemistry,2004,52:980-986.
[21]Seong-Bo Kim,Dong-Woo Lee,Chan-Ick Cheigh,et al. Purification and characterization of a fibrinolytic subtilisin-like protease of Bacillus subtilis TP-6 from an Indonesian fermented soybean,Tempeh[J].J Ind Microbiol Biotechnol,2006,33:436-444.
[22]Astrup T,Müllertz S,et al.The Fibrin Plate Method for Estimating Fibrinolytic Activity[J].Arch Biochem Biophys,1952,40:346-351.
[23]华南工学院,等.发酵工程与设备[M].轻工出版社,1990:202-204.
[24]王永敏,祝文兴,安立国,等.优化条件对蛹虫草菌丝体与胞外多糖得率研究[J].济南大学学报:自然科学版,2010,24(2):148-151.
[25]文庭池.蛹虫草高产虫草菌素的深层培养工艺研究[D].贵阳:贵州大学,2006.
[26]邱树毅.生物T艺学[M].北京:化学工业出版社,2009:115-119.
[27]李春丽,刘晓兰,陈慧鑫,等.蛹虫草深层培养产菌丝体及胞外多糖的初步研究[J].农产品加工:创新版,2010(2):22-26.
Optimization of submerged culture conditions for the production of fibrinolytic enzyme with Cordyceps militaris
CHEN Hui-xin,LIU Xiao-lan*,LI Wei-wei,SHI Xi,ZHENG Xi-qun
(College of Food and Biology Engineering,Qiqihar University,Heilongjiang Key Lab of Agricuhural Product Processing,Qiqihar 161006,China)
Cordyceps militaris is one of the medicinal mushrooms.A kind of enzyme with stronger fibrinolytic activity was found in the fermentation culture fluids of Cordyceps militaris,which had potential for treating thrombus.The fermentation conditions for the fibrinolytic enzyme production with Cordyceps militaris,which based on optimized condition in our laboratory,were further investigated.And the process of the fibrinolytic enzyme production was scaled-up from 250mL flask to 10L fermentor.The results showed that the best conditions for the fibrinolytic enzyme production were 250mL flask containing 50mL medium,which was composed of sucrose2%and bean cake 5%. The fermentation time was 5d under the temperature of 23℃.Keeping the initial pH of culture medium natural condition(about 6.0)was better for the fibrinolytic enzyme production.The better inoculums size was punching out 1cm mycelia cultures into 50mL liquid fluids of 250mL flask.0.5%(v/v)liquid spawn of 3~5d was also better.The fermentation of 10L fermentor under the conditions of agitation rate 100r/min and aeration rate 600L/h got a better result for the fibrinolytic enzyme production.The area of the fibrinolytic enzyme active reached 286.21U/mL(urokinase),which was 3.2 times more than the results of flask.The yield was 5.5 times more than the results of flask.
Cordyceps militaris;submerged culture;fibrinolytic enzyme;fermentor
TS201.2+5
A
1002-0306(2010)11-0216-05
2010-08-23 *通讯联系人
陈慧鑫(1984-),男,在读硕士,研究方向:微生物遗传。
黑龙江省科技计划项目(GB08B401-04)。

