我国不同产地绿豆抗氧化活性分析
赵建京,成 珊,范志红,陈 然,王笑航
(中国农业大学食品科学与营养工程学院,北京100083)
我国不同产地绿豆抗氧化活性分析
赵建京,成 珊,范志红*,陈 然,王笑航
(中国农业大学食品科学与营养工程学院,北京100083)
目的:测定我国十四个产地的绿豆样品的总酚含量、总黄酮含量以及抗氧化能力,为我国部分绿豆品种品质评价体系提供科学依据。方法:分别采用福林-酚法、三氯化铝显色法测定绿豆样品的总酚含量、总黄酮含量,采用铁离子还原抗氧化法(FRAP值)、N,N-二苯基三硝基苯肼(DPPH)自由基清除率法评价其抗氧化能力。结果:绿豆样品总酚含量为2.85~3.84mg没食子酸/g,总黄酮含量为1.99~2.53mg儿茶素/g,FRAP值为1.39~2.08mmol Fe2+/100g,DPPH为1.40~2.03mg抗坏血酸/g。样品总酚含量与FRAP值(r=0.84,p<0.01)、总黄酮与DPPH(r=0.89,p<0.01)相关关系显著。结论:不同产地绿豆总酚含量、总黄酮含量、FRAP值、DPPH存在显著差异。绿豆的抗氧化活性与其总酚含量、总黄酮含量显著正相关,与淀粉、蛋白质、粗纤维、灰分、脂肪含量没有显著的相关性。
绿豆,抗氧化活性,总酚,总黄酮
绿豆[Vigna radiate(L.)Wilczek],同义学名:Phaseolus radiatus(L.),Phaseolus aureus Roxb.是一种高蛋白、中淀粉、低脂肪的豆类,富含多种矿质元素、多种维生素和氨基酸[1]。它还含有多种生物活性物质,包括蛋白水解酶、胰蛋白酶抑制剂、苯丙氨酸解氨酶、超氧化物歧化酶、黄酮类化合物、植物凝集素和抗真菌蛋白等,它具有抗菌抑菌、抗肿瘤、抗氧化、提高免疫力、降血脂和解毒等功效[2]。研究表明,绿豆甲醇提取物具有还原能力、DPPH自由基清除能力、抗脂质过氧化和非脂质氧化损伤能力[3-6]。绿豆乙醇提取物具有很好的超氧阴离子清除能力以及对氧化损伤的大鼠肝细胞具有保护作用[7]。绿豆皮水提取液能够抑制SP2/0细胞、B16细胞和Hela细胞三种离体肿瘤细胞的增殖,并且能提高高温条件下wistar大鼠体内的抗氧化能力[8]。绿豆的抗氧化能力主要源于绿豆皮中所含有的丰富的酚类物质,主要为黄酮类物质[2]。研究人员采用不同浓度的甲醇、乙醇、丙酮等溶剂,利用浸提、超声提取法等方法对绿豆中的酚类物质进行了提取,并进行了定量测定[6,9-13]。绿豆中酚类物质的含量及其抗氧能力是反映其营养品质的重要方面。但目前对于绿豆品质的评价主要关注的是其物理加工品质和淀粉、蛋白等化学成分的含量。本研究拟分别采用福林-酚法、三氯化铝显色法测定我国十四个产地的绿豆样品的总酚含量、总黄酮含量,并采用铁离子还原抗氧化法(FRAP法)、DPPH自由基清除率法对其抗氧化活性进行评价,分析绿豆所含化学成分与其抗氧化活性的相关关系,为绿豆品质评价体系提供科学依据。
1 材料与方法
1.1 材料与仪器
绿豆 中国农业大学食品科学与营养工程学院谷物科学实验室提供,十四个绿豆样品产地分别为湖南邵阳、四川宜宾、江西抚州、山东菏泽、浙江杭州、吉林吉林市、陕西汉中、黑龙江哈尔滨、内蒙古巴彦淖尔、辽宁葫芦岛、广东广州、山西太原、江苏徐州、湖北咸宁,其物理品质及主要化学成分见文献[19],手工检出开裂、过小、皱缩豆粒和异品种粒,粉碎后过60目筛;三吡啶三吖嗪(TPTZ)、N,N-二苯基三硝基苯肼(DPPH) Sigma公司,分析纯;儿茶素中国药品生物制品检定所;没食子酸、香草醛、抗坏血酸、丙酮、钨酸钠、钼酸钠、磷酸、浓盐酸、硫酸锂、双氧水、碳酸钠、亚硝酸钠、结晶三氯化铝、氢氧化钠、三水合乙酸钠、乙酸、六水合三氯化铁、硫酸亚铁、乙醇等 国产,分析纯。
粉碎机 北京环亚天元机械技术有限公司;电子天平(d=0.001g) 北京赛多利斯仪器系统有限公司;SHA-BA型水浴恒温振荡器 江苏省金坛市医疗仪器厂;TDL-5-A型离心机 上海安亭科学仪器厂;DH-101型电热恒温鼓风干燥箱 天津市中环实验电炉有限公司;BCD-245F型冰箱 合肥荣事达电冰箱有限公司;UV-5200型紫外可见分光光度计上海元析仪器有限公司;电热恒温水浴锅 北京长安科学仪器厂;旋涡混合器 江苏海门市麒麟医用仪器厂。
1.2 实验方法
1.2.1 水分含量测定 参照《GB/T 5497-1985粮食、油料检验水分测定法》,采用105℃恒重法测定绿豆粉的含水量[14]。实验结果以干重计。
1.2.2 样品提取液制备 准确称取绿豆粉1.000g,放入离心管中,加入10mL 80%丙酮溶液,加盖,水平放置在25℃的振荡水浴中,振荡速率200r/min,提取1h,3600r/min离心10min,取出上清液留用。重复上述步骤(注:第二次加入10mL提取试剂,第三次加入6mL提取试剂)。合并三次所得上清液,定容至25mL,4℃冰箱保存,2d之内进行分析测定。
1.2.3 总酚测定 采用福林-酚法,参照文献方法[15-16],并略作改动。取150μL样品溶液,加入3mL去离子水、250μL福林酚试剂和750μL 7%(W/V)Na2CO3溶液,涡旋混匀,室温下静置8min。然后加入850μL去离子水,涡旋混匀。该混合物在室温下反应120min。以提取试剂为空白对照,在765nm处测定其吸光度值。总酚含量以没食子酸当量表示(mg没食子酸/g)。
福林酚试剂的配制:称取20.00g钨酸钠和5.00g钼酸钠于圆底烧瓶中,用140mL去离子水溶解。加入80%的磷酸溶液10mL,36%的浓盐酸20mL,文火回流10h。然后加入3.00g硫酸锂及15mL双氧水,加热沸腾15min至亮黄色,冷却。移入250mL容量瓶中,用去离子水定容,贮于棕色瓶中保存。
1.2.4 总黄酮测定 采用三氯化铝显色法,参照文献方法[17],并略作改动。取700μL样品溶液,加入2500μL去离子水和150μL 5%NaNO2溶液,涡旋混匀,静置6min。再加入300μL新制备的10%AlCl3· 6H2O溶液,涡旋混匀,静置5min。然后加入1000μL 1mol/L NaOH溶液和350mL去离子水,涡旋混匀。以提取试剂为空白对照,测定510nm处溶液的吸光值。总黄酮含量以儿茶素当量表示(mg儿茶素/g)。
1.2.5 铁还原抗氧化能力测定(FRAP值) 参照Benzie and Strain的方法[18],并略作改动。300mmol/L醋酸盐缓冲溶液(pH3.6)、10mmol/L TPTZ盐酸溶液(盐酸溶液的浓度为 40mmol/L)、20mmol/L FeCl3·6H2O溶液按照10∶1∶1的比例(v/v/v)混合得到FRAP工作液。此工作液用前现配,并于37℃水浴中保温。取3600μL FRAP工作液,加入样品溶液120μL,再加入360μL去离子水。混匀后置于37℃水浴中反应10min,在593nm处测定其吸光度值。空白采用提取试剂代替样品。结果以Fe2+当量表示(mmol Fe2+/100g)。
1.2.6 DPPH·清除率测定(DPPH) 参照Xu and Chang的方法[17]。取 0.2mL样品溶液,加入3.8mL DPPH乙醇溶液(0.1mmol/L),涡旋振荡充分混匀。室温下,避光放置30min。测定溶液在517nm处的吸光度值A样品,以乙醇作空白对照。另取0.2mL提取试剂,加入3.8mL DPPH乙醇溶液(0.1mmol/L),依上述步骤得到 A对照。DPPH·清除率 =[1-(A样品/A对照)]× 100%,结果以抗坏血酸当量表示(μg抗坏血酸/mg)。
1.2.7 数据统计分析 实验进行三次重复测定,每次三个平行。采用SAS(V8)对实验数据进行处理。
2 结果与讨论
2.1 绿豆样品总酚含量
酚类物质,包括简单酚类、苯丙酯类、安息香酸类、黄酮类、单宁等,是植物性食物总抗氧化能力的主要物质。这类化合物能够清除自由基、螯合金属离子催化剂、激活抗氧化物酶和抑制氧化酶等[20]。
十四个产地绿豆样品的总酚含量及差异性分析见表1。绿豆样品总酚含量的均值为3.42mg没食子酸/g。其中,总酚含量最高的是湖南邵阳产绿豆(3.84mg没食子酸/g),辽宁葫芦岛产绿豆总酚含量最低(2.85mg没食子酸/g),极差为0.99mg没食子酸/g。
总酚含量高于平均值的样品有9个,分别产自湖南邵阳、吉林省吉林市、陕西汉中、黑龙江哈尔滨、内蒙古巴彦淖尔、江苏徐州、湖北咸宁、广东广州。
对绿豆样品总酚含量进行差异显著性检验(P<0.05),结果显示:吉林省吉林市、陕西汉中、黑龙江哈尔滨、内蒙古巴彦淖尔、江苏徐州产绿豆总酚含量没有显著差异;湖北咸宁、广东广州产绿豆总酚含量没有显著差异;浙江杭州、山东菏泽、江西抚州产绿豆总酚含量没有显著差异;山东菏泽、江西抚州、四川宜宾产绿豆总酚含量没有显著差异;山西太原、辽宁葫芦岛产绿豆总酚含量没有显著差异;其余样品间存在显著性差异。

表1 我国十四个产地绿豆样品总酚含量、总黄酮含量、FRAP值、DPPH(干基)
2.2 绿豆样品总黄酮含量
黄酮类化合物是广泛存在的植物次生代谢产物,主要包括黄酮、黄烷醇和缩合单宁。它们是豆类中所含有的主要酚类物质[20]。
我国不同产地绿豆的总黄酮含量及差异性分析见表1。不同产地绿豆总黄酮含量的平均值为2.29mg儿茶素/g,其中吉林省吉林市产绿豆总黄酮含量最高(2.53mg儿茶素/g),山西太原产绿豆总黄酮含量最低(1.99mg儿茶素/g),极差为0.54mg儿茶素/g。
总黄酮含量高于平均值的样品有6个样品,分别产自吉林省吉林市、黑龙江省哈尔滨、内蒙古巴彦淖尔、湖北咸宁、浙江杭州、山东菏泽。
对绿豆样品总黄酮含量进行显著性检验(P<0.05),结果显示:吉林省吉林市、黑龙江省哈尔滨、内蒙古巴彦淖尔、湖北咸宁产绿豆总黄酮含量没有显著差异;内蒙古巴彦淖尔、湖北咸宁、浙江杭州产绿豆总黄酮含量没有显著差异;山东菏泽、湖南邵阳、江西抚州、陕西汉中产绿豆总黄酮含量没有显著性差异;陕西汉中、辽宁葫芦岛、广东广州、江苏徐州产绿豆总黄酮含量没有显著差异;其余样品之间存在显著性差异。
2.3 绿豆样品铁还原抗氧化能力(FRAP值)
铁还原抗氧化法(FRAP法)的原理为:在低pH下,Fe3+-TPTZ复合物可被样品中的还原性物质还原为Fe2+-TPTZ,呈现出明显的蓝色,在593nm处有最大的光吸收,根据吸光度的大小计算试样抗氧化活性的强弱。FRAP法操作简单,结果重复性好,广泛应用于豆类、蔬菜、水果等食品抗氧化能力的测定[18]。
14个不同产地绿豆样品的FRAP值及差异性分析见表1。不同产地绿豆样品的FRAP值的平均值为1.81mmol Fe2+/100g。其中,黑龙江哈尔滨产绿豆的FRAP值最高(2.08mmol Fe2+/100g),辽宁葫芦岛产绿豆的FRAP值最低(1.39mmol Fe2+/100g),两者相差0.69mmol Fe2+/100g。
FRAP值高于平均值的样品有6个,分别产自黑龙江哈尔滨、吉林省吉林、湖北咸宁、江苏徐州、湖南邵阳、山东菏泽。
差异显著性分析(P<0.05)结果显示:黑龙江哈尔滨、吉林省吉林市产绿豆FRAP值没有显著差异;吉林省吉林市、湖北咸宁产绿豆FRAP值没有显著差异;湖北咸宁、江苏徐州、湖南邵阳产绿豆FRAP值没有显著差异;山东菏泽、广东广州产绿豆FRAP值没有显著差异;广东广州、陕西汉中、浙江杭州、内蒙古巴彦淖尔产绿豆FRAP值没有显著差异;陕西汉中、浙江杭州、内蒙古巴彦淖尔、四川宜宾产绿豆FRAP值没有显著差异;其余样品间存在显著差异。
2.4 绿豆样品DPPH自由基清除能力(DPPH值)
DPPH自由基是一种非常稳定的自由基,在许多体系中,它能有效地捕捉别的自由基,起到阻聚的作用。测定样品的DPPH自由基清除率可以用来评价样品的抗氧化能力,该方法目前被普遍使用[20]。在本研究中,DPPH自由基清除率以抗坏血酸当量表示,记作DPPH值。DPPH值越大,表明样品对DPPH自由基的清除能力越强。
14个绿豆样品的DPPH值及差异性分析见表1。不同产地绿豆样品DPPH值的平均值为1.73抗坏血酸/g,其中,内蒙古巴彦淖尔产绿豆的DPPH值最高(2.03mg抗坏血酸/g),四川宜宾产绿豆的DPPH值最低(1.40mg抗坏血酸/g),两者相差0.63mg抗坏血酸/g。
差异显著性检验(P<0.05)结果显示:黑龙江哈尔滨、湖北咸宁、吉林省吉林市产绿豆DPPH值没有显著差异;广东广州、陕西汉中产绿豆DPPH值没有显著差异;湖南邵阳、江西抚州、辽宁葫芦岛产绿豆DPPH值没有显著差异;其余样品间存在显著差异。
2.5 绿豆化学成分与其抗氧化能力的相关分析
十四个绿豆样品的化学成分,包括总酚、总黄酮、淀粉、蛋白质、粗纤维、灰分、脂肪,与其抗氧化能力指标FRAP值、DPPH值的相关性分析见表2。
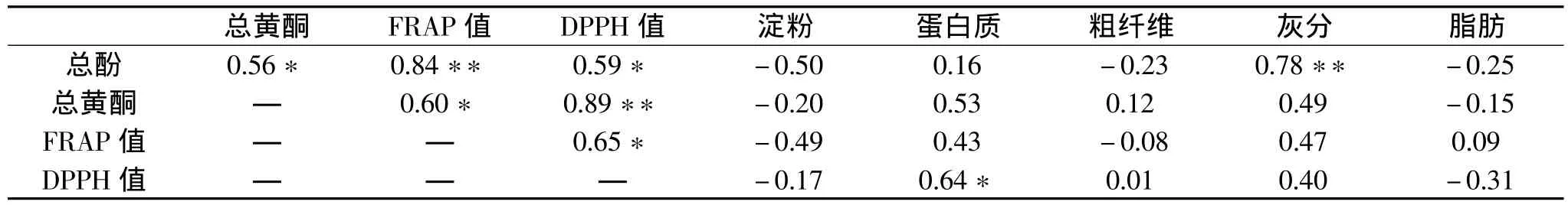
表2 我国不同产地绿豆样品化学成分与抗氧化能力的相关性分析
从表中可以看出,总酚含量和 FRAP值(r=0.84,p<0.01)、总黄酮含量和 DPPH值(r= 0.89,p<0.01)具有很高的相关性。但总酚与总黄酮(r=0.56,p<0.05)、总黄酮和 DPPH值(r=0.59,p<0.05)、总黄酮和 FRAP值(r=0.60,p<0.05)、FRAP值和DPPH(r=0.65,p<0.05)、总酚与灰分(r=0.78,p<0.01)、蛋白质与 DPPH(r=0.64,p<0.05)相关关系较弱。由此说明,绿豆的抗氧化活性主要来自于酚类物质,与淀粉、蛋白、粗纤维、灰分、脂肪等含量没有显著的相关性。
3 讨论
实验结果表明,不同产地绿豆的总酚含量、总黄酮含量、FRAP值、DPPH存在显著差异。造成这种差异的原因除了品种,还有地理因素、土壤因素、气象因素以及农业技术(如肥料、灌溉等)。
目前,对于绿豆的研究主要集中在其物理化学品质及育种上,随着生活水平的提高和肥胖、心血管疾病等慢性病的流行,在对绿豆、红豆等传统豆类的品质评价和育种工作中,应依据使用目的进行调整,如为了制取淀粉、蛋白,则可培育皮薄粒大品种,但如果作为抗氧化物质的来源,则要重视其酚类物质含量。
绿豆在中国、印度、泰国、菲律宾等东南亚国家栽培最广泛,非洲、欧洲、美洲也有少量栽培。我国绿豆品种资源遍布全国各地,数量多,类型丰富,并有2000多年的栽培历史。绿豆作为我国人民喜食的重要豆类,我们在对其进行品质评价时加入对酚类物质和抗氧化能力的测定具有重要意义。
[1]郑卓杰.中国食用豆类学[M].北京:中国农业出版社,1997:144-150.
[2]汪少芸,叶秀云,饶平凡.绿豆生物活性物质及功能的研究进展[J].中国食品学报,2004,4(1):98-102.
[3]Takanori Tsuda,Yuka Makino,Hiroshi Kato,et al.Screening for antioxidative activiry of edible pulses[J].Biosci Biotech Biochem,1993,57(9):1606-1608.
[4]Pin-Der Duh,Wen Jye Yen,Pin-Chan Du et al.Antioxidant activity of mung bean hulls[J].JAOCS,1997,74(9):1059-1063.
[5]Pin-Der Duh,Pin-Chan Du,Gow-chin Yen.Action of methanolic extract of mung bean hulls as inhibitors of lipid peroxidation and non-lipid oxidative damage[J].Food and Chemical Toxicology,1999,37:1055-1061.
[6]张竞竞,易建勇,王宝刚,等.绿豆皮抗氧化物质的提取剂初步分析[J].食品工业科技,2008,29(12):64-66.
[7]李波.八种中国豆类荚果乙醇提取物及所含杨梅素芸香苷抗氧化作用研究[D].浙江大学硕士学位论文,2005.
[8]张竞竞.绿豆皮水提液对离体肿瘤细胞及高温条件下大鼠抗氧化能力作用的研究[D].中国农业大学硕士学位论文,2008.
[9]程霜,杜凌云,王勇,等.绿豆皮中抗氧剂的初步研究[J].中国粮油学报,2000,15(2):40-43.
[10]卫莉,钟秀珍,张宝才,等.绿豆皮黄酮类化合物的提取及定量测定[J].郑州轻工业学院学报:自然科学版,2001,16(1):58-62.
[11]张延杰,田金河,曾庆孝,等.绿豆壳中提取黄酮工艺的研究[J].粮油食品科技,2005,13(5):39-40.
[12]范媛媛,李新华,刘兰英.绿豆黄酮提取工艺研究[J].沈阳农业大学学报,2005,36(5):619-622.
[13]苏冰霞,郑为完,李积华,等.绿豆皮中黄酮类物质浸提条件的优化研究[J].食品研究与开发,2007,128(4):82-86,120.
[14]GB/T 5497-1985粮食、油料检验水分测定法[S].
[15]Singleton VL,Lamuela-Raventos RM.Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent[J].Methods Enzymol,1999,299:152-178.
[16]Singleton VL,Rossi JA.Colorimetry of total phenolic with phosphomolybdic-phosphotungstic acid reagent[J].Am J Enol Viticult,1965,16:144-158.
[17]BJ Xu,SKC Chang.A comparative study on phenolic profiles and antioxidant activity of legumes as affected by extraction solvents[J].Journal of Food Science,2007,72(2):159-166.
[18]Iris F F Benzie,J J Strain.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:the FRAP assay[J].Analytical Biochemistry,1996,239:70-76.
[19]成珊.我国部分绿豆品种品质评价体系的初步建立[D].中国农业大学硕士学位论文,2009.
[20]BJ Xu,SH Yuan,SKC Chang.comparative analyses of phenolic composition,antioxidant capacity,and color of cool season legumes and other selected food legumes[J].Journal of Food Science,2007,72:167-177.
[21]石碧,狄莹.植物多酚[M].北京:科学出版社,2000:128.
Analysis of antioxidant capacity of mung beans from different areas in China
ZHAO Jian-jing,CHENG Shan,FAN Zhi-hong*,CHEN Ran,WANG Xiao-hang
(College of Food Science and Nutritional Engineering,China Agriculture University,Beijing 100083,China)
Objective:ln order to provide scientific evidence for quality evaluation system based on some mung bean cultivars in China,the total phenolic conten(tTPC),total flavonoid conten(tTFC)and the antioxidant capacity of mung beans from fourteen different areas in China were determined.Methods:The TPC was determined by a Folin -Ciocalteu assay.The TFC was determined by an aluminum chloride chromotest.Ferric reducing antioxidant power(FRAP value),2,2-diphenyl-1-picrydrazyl radical scavenging assay(DPPH value)was used for analyzing antioxidant properties.Results:The TPC of mung bean samples ranged from 2.85 to 3.84mg gallic acid/g,the TFC ranged from 1.99 to 2.53mg(+)-catechin/g,FRAP values ranged from 1.39 to 2.08mmol Fe2+/100g,DPPH values ranged from 1.40 to 2.03mg ascorbic acid/g.There were significant linear correlations between TPC and FRAP values(r=0.84,p<0.01),TFC and DPPH values(r=0.89,p<0.01).Conclusion:TPC,TFC,FRAP values,DPPH values of the mung bean samples from different areas were significantly different.Antioxidant activities were strongly correlated with TPC,TFC.But no significant correlations exsited between starch,protein,crude fiber,ash content,fat and antioxidant activities.
mung bean;antioxidant capacity;total phenolic;total flavonoid
TS214.9
A
1002-0306(2010)11-0144-04
2009-12-09 *通讯联系人
赵建京(1984-),女,硕士研究生,研究方向:食物营养。

