肾脏肿瘤超声造影定量研究的进展
燕翠菊 综述 黄备建 审校
超声造影技术近年发展迅速, 已广泛应用于多个器官, 取得较好临床效果。随着影像学的发展, 影像学技术逐步从单纯形态学观察走向功能评价, 从定性走向定量, 以期为疾病诊断提供更加客观的量化诊断依据。近年来, 超声造影定量分析方面的研究也逐步展开, 肝脏、肾脏等腹部脏器及甲状腺、乳腺等浅表小器官均有相关研究[1-4], 本文就超声造影在肾脏肿瘤方面的定量研究及进展作一综述。
1 超声造影成像技术及造影剂简述
1.1 超声造影成像技术(Contrast-enhanced ultrasonography, CEUS)
利用与人体组织间声特性阻抗显著差别的外界物质注入体腔内、管道内或血管内以增强对脏器或病变的显示, 称超声造影成像技术。造影方法有胃、胰造影、结肠温盐水保留灌肠造影、心脏、血管内造影等多种, 本文主要介绍临床应用最广、发展也最迅速的血管内超声造影[5]。
1.2 超声造影剂
超声造影采用一种微泡造影剂, 微泡的直径常在2~6µm间[6], 可随血液流动分布到全身毛细血管床;不同于CT或MRI造影剂, 超声造影剂不穿过毛细血管壁溢出到组织间隙, 更真实地反映造影剂在血液中的动态过程[1], 被称为“最理想的血池显像剂”, 是应用于肝脏及其他脏器的重要条件。目前国内最常用的造影剂为SonoVue(Bracco Imaging, Milan, Italy), 属第二代超声造影剂; 造影剂微泡内含六氟化硫气体,外包一层磷脂微囊。造影剂的气体成分经肺排出体外, 其微囊成分由肝脏清除, 对肾无毒性, 适用于肾功能受损的患者[7]。微泡的血流动力学变化与红细胞类似[8], 有微囊的保护, 稳定性好, 可以在血液中较长时间存在。通过研究微泡的血流动力学变化可得到组织的血流灌注情况[8], 进而为定量分析提供了可能。
2 超声造影定量分析的方法
传统超声在显示深部器官如肾脏或前列腺时常因位置太深而显示欠清, 或因彩色多普勒对于低速血流的敏感性太差而无法观察到实质病灶内的细小血管内血流。超声造影的出现弥补了传统超声的这些缺点; 然而超声造影的诊断结果主要靠检查者的经验与技术, 有着一定的主观性, 出现误诊的可能性仍然存在[9], 人们希望能有一种方法以减少诊断的主观依赖性。定量分析能为疾病诊断提供客观的量化数据, 从而降低对医师经验和技术的依赖, 成为近年来研究的新方向。定量分析发展过程中出现过多种方法。
2.1 平均灰度值法
我国有采用造影前后图像平均灰度值的变化来进行定量分析的报道[10]。不足的是这种方法仅对造影前后感兴趣区(region of interest, ROI)图像灰阶强度的平均值进行比较, 类似于CT值, 虽比较直观但丢失大量反映动态过程的信息, 属静态比较, 无法反映病灶在整个灌注过程中的动态变化情况。
2.2 微血管显像法(microvascular imaging, MVI)
微血管显像法最早在1999年提出, 评估少血供病灶的效果较好, 但是此法对位移限制严格, 要求探头与扫查器官之间没有任何移动, 适用于乳腺等浅表小器官、移植肾或者体型较瘦、肾脏相对表浅且呼吸配合较好的患者[7]。
2.3 时间-强度曲线法(time-intensity curve, TIC)
时间-强度曲线是目前常用的定量分析工具, 其基本原理是造影剂微泡浓度与声像图信号强度成线性关系。ROI内信号强度随时间的变化反映微泡浓度的变化, 微泡浓度的变化进一步反映了组织血流灌注量的变化。多个数学模型可以拟合得出时间-强度曲线, 又各有特点, 以下就应用较为广泛的几种模型做简单介绍。
2.3.1 伽马拟合函数[11]
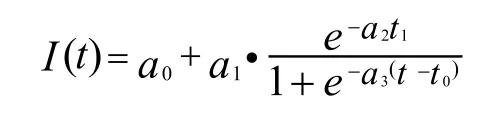
目前临床应用中, 造影剂多以团注方式经浅静脉注入体内, 造影剂在体内的流动过程符合指示剂稀释原理, 而伽马拟合函数较为符合团注超声造影剂在体内随血液流动的稀释过程。
2.3.2 指数函数[12]
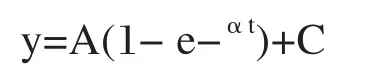
公式中的A 代表曲线的波幅,α代表曲线的上升斜率, C代表基线信号强度。指数函数适用于微泡的破坏-再灌注过程。此模型假定微泡破坏后立刻有恒定浓度的微泡再次进入感兴趣区, 公式忽略了ROI中血流方向的多样性[6]。
指数函数在定量分析组织或器官血流灌注量的情况下应用较多。有研究表明肝硬化患者或肝脏转移癌患者的渡越时间(transit time, TT)比正常人缩短[13],并认为器官的血流灌注情况通过分析造影剂再灌注的血流动力学状态更为准确[14]。微泡浓度与信号强度在再灌注平台期成线性关系[15], 当组织中充满再灌注的微泡时, 微泡信号强度反映了组织中的血流量[16]。
2.3.3 S型函数
S型函数也是描述造影剂再灌注的数学模型, 其表达式为[17]:
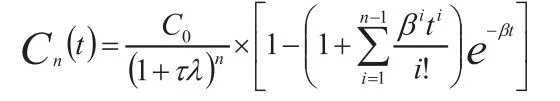
尽管拟合函数不同, 时间-强度曲线均是反映ROI内信号强度随着时间的变化, 如图1所示为感兴趣区分别取在肾皮质和病灶的时间-强度曲线。
时间-强度曲线形象地反映了超声造影的整个动态过程, 从时间-强度曲线中可以提取出多个关于血流灌注的参数[18], 如造影剂到达时间(arrival time, AT)、峰值强度(peak intensity, PI)、达峰时间(time to peak, TTP)、曲线下面积(area under the curve, AUC)、半值宽度(full-width at half maximum, FWHM)[19]、曲线上升支斜率(ascending slope)、下降支斜率(descending slope)[20],对上述所取得的相应参数进行定量分析。
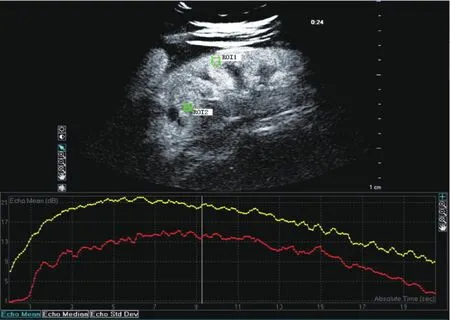
图1 正常肾皮质(ROI 1, 黄色)和病灶(ROI 2, 红色)的超声造影时间-强度曲线
3 定量分析在肾脏肿瘤中的应用
目前关于肾脏占位性病变定量分析仅见散在报道, 尚无细致、系统的文献介绍, 本文就常见的肾细胞癌、囊性肾癌及肾错构瘤等作简单介绍。
3.1 肾细胞癌
肾细胞癌是最常见的肾脏恶性肿瘤, Xu等[21]研究肾细胞癌的超声造影表现, 认为皮质期不均匀高增强或等增强, 延迟期周围环状增强是其较为常见表现。乏血供肿瘤如乳头状肾癌, 一般表现为皮质期缓慢均匀增强, 而富血供肿瘤肾透明细胞癌主要表现为皮质期快速不均匀增强, 延迟期迅速减退[22]。Dong等[23]对42例经病理活检证实的肾细胞癌患者进行定量分析,发现病灶的TTP明显小于周围肾皮质, 时间-强度曲线的上升支斜率平均值大于同侧肾脏正常皮质, 下降支斜率平均值小于同侧肾脏正常皮质, 差异均有统计学意义。上升支斜率代表造影剂的灌注速率, 下降支斜率代表消退速率。病灶的造影剂灌注速率快于肾皮质, 而廓清速率慢于肾皮质, 研究者认为与肿瘤组织内大量动静脉瘘的形成及小静脉的闭塞, 造成造影剂在血管床淤滞有关。上升支斜率与下降支斜率客观反映了病灶的血流灌注特点, 有助于病灶性质的判断。石尖兵等[24]对肾细胞癌定量分析发现, 肾细胞癌与肾皮质的时间-强度曲线均呈弓背向上的弧形, 起始端比较圆滑, 但肾细胞癌弧度相对较高; 究其原因作者认为可能与肾脏皮质本身供血丰富, 而肾细胞癌又多为富血供肿瘤, 两者曲线形态相似; 但癌灶血流灌注速度要快, 曲线上表现为上升支斜率较大, 与Dong等[23]的研究结果一致, 研究中还发现恶性肿瘤的曲线尖度显著高于周围肾皮质的曲线尖度。参数AT、曲线尖度、AUC均有统计学意义。
3.2 囊性肾癌
肾脏复杂性囊性占位一般按照基于CT增强表现的Bosniak分级法为诊断依据, 该诊断标准也适用于超声造影[25], 已有研究认为超声造影鉴别诊断肾脏复杂性囊性占位的准确率优于CT[26]。注入造影剂后, 囊性病变厚壁、囊内分隔或壁上结节明显增强认为是恶性的主要表现[26]。目前复杂性囊性肾占位仍是影像学诊断的一个难题, 已有研究探索定量分析能否提供进一步的诊断依据。Aoki S等[27]采用超声造影定量分析12例肾脏占位性病变, 其中5例为囊性占位性病变; 所有病例均经病理结果证实, 包括11例肾细胞癌和1例出血性囊肿。研究者从时间-强度曲线中提取了TTP、强度增量(intensity change from the baseline to peak,Δl)、三个参数, 其结果为囊性肾细胞癌TTP明显早于周围正常肾皮质, 两者之间TTP及差异有显著意义, 而Δl在两者间差异无统计学意义。研究者认为定量分析将成为一种鉴别诊断囊性肾癌极有前景的方法。
3.3 肾错构瘤
肾脏良性肿瘤以错构瘤最为常见, 因其组织学类型不同, 造影表现可不尽相同。错构瘤皮质期主要表现为向心型缓慢增强, 虽然增强起始时间相同但填充速度慢于或明显慢于肾皮质; 造影剂进入过程较恶性肿瘤慢,由四周向中心填充增强, 逐渐填充至整个肿块; 达峰值时肿瘤与肾皮质相比呈等增强或高增强,造影达峰值后显示为均匀增强, 实质期表现为均匀减退, 无明显造影剂充盈缺损区[28]。
李萍等[20]对50例肾脏实质占位性病灶进行定量分析, 包括38例恶性病灶和12例肾错构瘤。显示肾脏恶性肿瘤的TIC曲线上升快, 以快进表现居多; 而肾脏血管平滑肌脂肪瘤的TIC上升慢, 以慢进表现多见。肾脏恶性肿瘤的上升支斜率、AUC及PI均较血管平滑肌脂肪瘤高, 两组参数差异具有统计学意义。并认为上升支斜率比较客观地反映了造影剂开始灌注的情况, 兼顾了时间和强度双重因素的影响, 较单纯应用AT或TTP更适合于超声造影鉴别良恶性肿瘤的补充。
时间-强度曲线的多个参数可反映良恶性肿瘤的灌注特征, 如上升支及下降支斜率、PI、TTP等等,对病灶进行时间-强度曲线分析有助于更客观地了解病灶特点, 有利于病灶的鉴别诊断。但由于目前研究较少, 尚无统一标准; 随着各参数诊断意义的明确及参数的标准化, 或将在临床诊断中发挥重要的作用。
4 定量分析的局限
虽然时间-强度曲线定量分析为诊断带来了客观的量化数据, 弥补了传统超声主观性强的缺点, 但是定量分析发展时日尚短, 很多问题尚无明确的统一标准。
4.1 时间-强度曲线的标准化问题。
目前时间-强度曲线多由软件自动绘制, 各个软件所使用的函数模型不同, 绘制出的曲线也有差别,缺乏统一的函数模型, 不利于今后各家、各仪器及各项研究之间的比较、印证。
4.2 感兴趣区的选择
目前时间-强度曲线主要由软件自动绘制, 不同情况下如病灶坏死、钙化、靠近大血管, 时间-强度曲线的结果受ROI的位置影响颇大[29], 因此ROI的选择非常重要。另外当与正常组织对照时, 正常组织的ROI应取在病灶周围还是同深度相隔一定距离的部位尚无共识; 表浅病灶与深部病灶的定量分析结果是否有与距离相关的差异; 抑或测定器官、组织血流参数时, ROI当取周边部位还是中心部位等问题目前尚无定论。
4.3 定量参数的筛选及有效性问题
时间-强度曲线包含多个定量参数, 但并非所有参数均能提供有诊断意义的信息, 不同器官, 有价值的参数可能不同。如何筛选定量参数,目前尚无统一的认识。在动态造影过程中, 定量参数会受呼吸、深度、遮挡等的影响, 参数的稳定性值得探究。Ignee A等[30]在一项研究中着重比较了AUC、PI、TTP、MTT、上升时间(rise time, RT)及深度、侧移、感兴趣区的大小、形状等对上述参数的影响。结果显示参数TTP和RT不同条件下稳定性良好, 其他参数的变异较大。TTP、 RT在3cm~10cm深度时稳定性均较好,其他参数仅仅在4cm~6cm时结果可靠; TTP和RT在有一定的移动时稳定性良好, 而其他参数变异超过50%。研究者还发现ROI的大小和形状对结果无影响,这与Goertz RS等[29]的研究一致。
4.4 原始数据的处理
现在定量分析多采用后处理技术。造影时对整个造影过程录像存盘, 再将视频资料导入定量分析软件系统进行分析, 这个过程不可避免地涉及到资料的存储问题。有研究者认为录像视频材料存在对数据的非线性压缩[31], 原始数据所提供的信息才最可靠[19]。但是有些与时间相关的参数, 比如TTP、RT、MTT等并不受非线性压缩的影响[31], 故还需进行大量的研究课题以分析比较原始数据及压缩后数据对定量分析结果的影响。已有报道新的软件Sonoliver可直接对原始数据进行分析, 无需经过对数压缩[29]。如果这种软件可靠性高的话, 将有望解决原始数据的压缩失真问题。
4.5 其他
不正确的衰减补偿造成的声影效应(shadowing effect)也是影响定量分析准确性的一个因素。目前一般采用时间-增益补偿(time-gain compensation,TGC)对超声穿过组织时发生的声衰减进行补偿, 这种补偿的基础为衰减程度是深度的函数; 而实际情况中衰减不仅受深度的影响, 尤其造影条件下, 存在微泡内气体的衰减, 使情况更加复杂, 单纯应用TGC补偿并不准确[32]。因此如何准确地对造影过程中的微泡衰减进行补偿, 以确保定量分析的准确性, 是一个亟须解决的问题。Mule S等[32-33]已提出评估微泡造影剂在体内衰减情况的模型,目前尚处于研究阶段, 可能是一种极有前景的解决造影过程中微泡衰减问题的方法。
5 展望
定量分析是影像学发展的趋势。超声造影定量分析有无创、简便、无放射损伤、对肾无毒性、可重复性强等优点, 在各种影像学定量研究方法中独树一帜; 有望今后成为超声诊断的重要补充, 并在肿瘤良恶性鉴别、评估肾功能损害程度、药物疗效评价、肿瘤术后随访等多方面发挥重要作用。然而超声造影定量分析仅为一种刚属起步的方法,目前尚处于探索阶段, 还存在很多问题, 应用于临床仍需进行大量的研究论证。
1.Thorelius L.Contrast-enhanced ultrasound: beyond the liver[J].Eur Radiol, 2003, 13 (Suppl 3): 91-108
2.Faccioli N, Crippa S, Bassi C, et al.Contrast-enhanced ultrasonography of the pancreas[J].Pancreatology, 2009, 9(5):560-566
3.Caproni N, Marchisio F, Pecchi A, et al.Contrast-enhanced ultrasound in the characterization of breast masses: utility of quantitative analysis in comparison with MRI[J].Eur Radiol,2010, 20(6): 1384-1395
4.Zhang B, Jiang YX, Liu JB, et al.Utility of contrast-enhanced ultrasound for evaluation of thyroid nodules[J].Thyroid, 2010,20(1): 51-57
5.徐智章.超声造影成像[J].上海医学影像, 2005, 14(1):75-79
6.Quaia E.Microbubble ultrasound contrast agents: An update[J].Eur Radiol, 2007, 17(8): 1995-2008
7.Correas JM, Claudon M, Tranquart F, et al.The kidney: imaging with microbubble contrast agents[J].Ultrasound Q, 2006, 22(1):53-66
8.Kishimoto N, Mori Y, Nishiue T, et al.Ultrasound evaluation of valsartan therapy for renal cortical perfusion[J].Hypertens Res,2004, 27(5): 345-349
9.Mitterberger M, Pelzer A, Colleselli D, et al.Contrast-enhanced ultrasound for diagnosis of prostate cancer and kidney lesions[J].Eur J Radiol, 2007, 64(2): 231-238
10.黄道中, 张青萍, 乐桂蓉.肝脏肿瘤超声血管造影的定量分析[J].中华超声影像学杂志, 1998, 7(6): 330-333
11.林希元, 丁红, 王本刚, 等.超声造影伽马拟合分析技术对肝癌微循环血流灌注的定量研究[J].中国医学影像技术,2008, 24(2): 251-253
12.Wei K, Jayaweera AR, Firoozan S, et al.Quantification of myocardial blood flow with ultrasound-induced destruction of microbubbles administered as a constant venous infusion [J].Circulation, 1998, 97(5): 473-483
13.Albrecht T, Blomley MJ, Cosgrove DO, et al.Non-invasive diagnosis of hepatic cirrhosis by transit-time analysis of an ultrasound contrast agent[J].Lancet, 1999, 353(9164): 1579-1583
14.Cosgrove D, Eckersley R, Blomley M, et al.Quantification of blood flow[J].Eur Radiol, 2001, 11(8): 1338-1344
15.Correas JM, Burns PN, Lai X, et al.Infusion versus bolus of an ultrasound contrast agent: In vivo dose response measurements of BR1[J].Inves Radiol, 2000, 35(1): 72-79
16.Wei K, Le E, Bin JP, et al.Quantification of renal blood flow with contrast-enhanced ultrasound[J].J Am Coll Cardiol, 2001,37(4): 1135-1140
17.Lucidarme O, Franchi-Abella S, Correas JM, et al.Blood flow quantification with contrast-enhanced US:“entrance in the section” phenomenon-phantom and rabbit study[J].Radiology,2003, 228(2): 473-479
18.Sboros V, Tang MX.The assessment of microvascular flow and tissue perfusion using ultrasound imaging[J].Proc Inst Mech Eng H, 2010, 224(2): 273-290
19.Lavisse S, Lejeune P, Rouffiac V, et al.Early quantitative evaluation of a tumor vasculature disruptive agent AVE8062 using dynamic contrast-enhanced ultrasonography[J].Invest Radiol, 2008, 43(2): 100-111
20.李萍, 李凤华, 方 华, 等.肾脏良恶性病灶微循环血流灌注定量分析中超声造影伽马拟合分析技术的应用[J].上海交通大学学报(医学版), 2009, 29(6): 702-704
21.Xu ZF, Xu HX, Xie XY, et al.Renal cell carcinoma: Realtime contrast-enhanced ultrasound findings[J].Abdom Imaging,2009 Oct 21.[Epub ahead of print]DOI: 10.1007/s00261-009-9583-y
22.Roy C, Gengler L, Sauer B, et al.Role of contrast enhanced US in the evaluation of renal tumors[J].J Radiol, 2008, 89(11 Pt 1):1735-1744
23.Dong XQ, Shen Y, Xu LW, et al.Contrast-enhanced ultrasound for detection and diagnosis of renal clear cell carcinoma[J].Chin Med J(Engl), 2009, 122(10): 1179-1183
24.石尖兵, 陈习仲, 欧华林, 等.肾细胞癌实时超声造影表现及定量分析[J].山东医药, 2010, 50(7): 82-83
25.Ascenti G, Mazziotti S, Zimbaro G, et al.Complex cystic renal masses: characterization with contrast-enhanced US[J].Radiology, 2007, 243(1): 158-165
26.Quaia E, Bertolotto M, Cioffi V, et al.Comparison of contrastenhanced sonography with unenhanced sonography and contrastenhanced CT in the diagnosis of malignancy in complex cystic renal masses[J].Am J Roentgenol, 2008, 191(4): 1239-1249
27.Aoki S, Yamamoto T, Funahashi Y, et al.Contrast enhanced ultrasound using a time-intensity curve for diagnosis of renal masses[J].J Urol, 2009, 181(Suppl.S(4)): 700
28.黄备建, 李超伦, 徐本华, 等.高回声错构瘤的超声造影表现[J].上海医学影像, 2009, 18(4): 283-284, 291
29.Goertz RS, Bernatik T, Strobel D, et al.Software-based quantification of contrast-enhanced ultrasound in focal liver lesions-A feasibility study[J].Eur J Radiol, 2009 Dec 2.[Epub ahead of print]DOI: 10.1016/j.ejrad.2009.11.004
30.Ignee A, Jedrejczyk M, Schuessler G, et al.Quantitative contrast enhanced ultrasound of the liver for time intensity curves—Reliability and potential sources of errors[J].Eur J Radiol, 2010,73(1): 153-158
31.Verbeek XA,Willigers JM, Prinzen FW, et al.High-resolution functional imaging with ultrasound contrast agents based on RF processing in an in vivo kidney experiment[J].Ultrasound Med Biol, 2001, 27(2): 223-233
32.Mule S, De Cesare A, Frouin F, et al.An original methodologyfor quantitative assessment of perfusion in small animal studies using contrast-enhanced ultrasound[C].Conf Proc IEEE Eng Med Biol Soc, 2007; 1: 347-350
33.Mule S, De Cesare A, Lucidarme O, et al.Regularized estimation of contrast agent attenuation to improve the imaging of microbubbles in small animal studies[J].Ultrasound Med Biol,2008, 34(6): 938-948

