在非小细胞肺癌组织中stathmin蛋白的表达及与含紫杉方案化疗敏感性的关系
丛光东 李建 杜亚明* 王中彬
肺癌是人类最常见的恶性肿瘤之一,也是病死率最高的恶性肿瘤之一,其中大约有80%为非小细胞肺癌(NSCLC),且5年生存率很低,不足15%[1]。化疗在肺癌的治疗中有举足轻重的作用,但是相同的药物,用在临床期别相同的患者身上,常会产生截然不同的效果,提示临床疗效取决于药物与肿瘤组织的相互作用。药物遗传学(pharmacogenetics)和药物基因组学(pharmacogenomics)的迅速发展已经证明:肿瘤组织的基因表达情况与NSCLC化疗的疗效相关。因此,根据患者肿瘤组织的基因表达情况选用特异的对其最佳的化疗药物,以提高化疗的敏感性及延长生存期,并将毒副反应降到最低成为可能[2]。随着对肺癌的研究不断深入,对肺癌的治疗方法也在不断的提高,目前,已提倡肺癌的治疗向个体化的方向发展,但是现在对个体化的治疗还比较盲目,不能做到有的放矢。因此,加强对肺癌的特异性因子的研究就显得尤其重要,检测并分析其指标也对指导临床的治疗有重要意义。
stathmin蛋白是近年发现的在细胞的增殖和分化中十分重要的可溶性蛋白质,对于细胞外信号起一个中继站的作用,故命名为stathmin[3]。其可以通过影响肿瘤细胞内微管蛋白的聚合与解聚而干扰紫杉醇类药物的作用底物,从而影响此类药物的疗效[4,5]。微管蛋白是细胞骨架的重要组成部分。其中3型β微管蛋白(β-tubulinⅢ)与作用于微管的化疗药物敏感性有最密切的关系[6]。
本课题通过SP二步法联合测定NSCLC患者瘤组织内stathmin蛋白的表达与临床化疗效果的观察,分析二者之间的关系,以期为个体化治疗提供药物选择的参考。
1 材料与方法
1.1 临床资料
123例NSCLC组织均为辽宁医学院附属第一医院病理科术后存档标本(肺癌组),术前未经任何放化疗,均有明确病理诊断,术后予以药物辅助化疗。123例患者中男性88例,女性35例,年龄34~80岁,平均58.49岁。所有标本按WHO (1981)组织学分型分级标准:鳞癌75例(其中高分化11例,中分化47例,低分化17例,有淋巴结转移的31例),腺癌48例(其中高分化33例,中分化10例,低分化5例,有淋巴结转移26例)。所有病例均按国际肺癌TNM分期(UICC,5thed,1997):Ⅰ期68例,Ⅱ期42例,Ⅲ期11例,Ⅳ期2例,其中用含紫杉类化疗药物辅助化疗者32例。另选15例炎性假瘤组织为良性对照(良性组)。全部标本常规固定,石蜡包埋,5µm切片。
上述123例中32例为用含紫杉类化疗药物化疗的晚期非小细胞肺癌患者的标本,化疗方案:TP:(paclitaxel:135 mg/m2d1,carboplatin:AUC 5~6 d1 q21d )。所有患者至少接受2周期以上的化疗,并且具备完整的临床随访资料。
1.2 检测方法
鼠抗人stathmin单克隆抗体(北京中杉生物科技有限公司)。用免疫组织化学二步法对两组样本中的stathmin蛋白进行检测。用已知的stathmin蛋白阳性切片作阳性对照,用PBS代替一抗作阴性对照。严格按试剂盒说明书进行操作。
1.3 结果判断
随机选择5个高倍视野,stathmin蛋白表达阳性,均为在细胞质中出现棕黄色。用按每张切片肿瘤细胞中阳性细胞的比例和着色深浅记分,行半定量分析。阳性细胞所占比例判断:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。染色强度:无着色0分,浅黄色1分,棕黄色2分,棕褐色3分。根据两项指标积分数(积分=A×B)高低分为:0分为阴性(-),1~2分为可疑(±),3~5分为弱阳性(+),6~8分为阳性(++),9~12分为强阳性(+++)。以-和±为表达阴性,+、++及+++为表达阳性。以上所有结果的判定在双盲法下进行。
按WHO标准评定疗效:CR-病灶完全消失1个月以上。PR-肿块缩小超过50%,时间4周以上。NC-病灶减小不到50%或无变化或增大25%以下。PD-病灶增大超过25%或出现新病灶。完全缓解或部分缓解者为化疗有效,稳定或疾病进展者为化疗无效。
总生存期(OS):自化疗首日至死亡或失访日期止,以电话或门诊随访的方式完整随访32例用含紫杉类化疗药物化疗的晚期非小细胞肺癌患者,随访时间17~60个月,随访日期截止到2008年5月25日。观察患者生存期(患者开始化疗日至患者死亡或最后1次随访日期)。
1.4 统计学方法
应用SPSS16.0软件处理数据。率的比较用χ2检验;生存曲线分析用Log-Rank检验, P<0.05为差异有统计学意义。
2 结 果
2.1 两组stathmin蛋白的表达情况。
NSCLC组中stathmin蛋白表达阳性65例(52.8 %),良性组中1例(6.7%)。所以经统计学处理得出,两种蛋白表达在肺癌组与炎性假瘤组之间均有显著差异,差异有统计学意义(P<0.05),见表1。
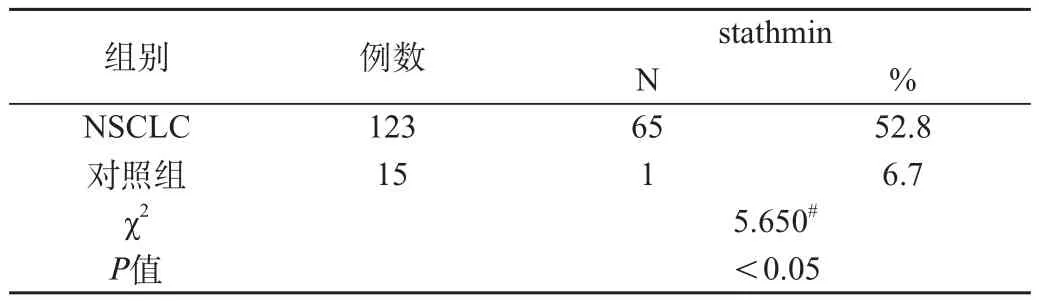
表1 stathmin蛋白在NSCLC与对照组中的表达
2.2 stathmin蛋白表达水平与NSCLC临床病理特征的关系
stathmin蛋白阳性率在中-低分化期大于高分化期,经卡方检验,差异有统计学意义(χ2=3.91,P<0.05);有淋巴结转移组stathmin蛋白阳性率高于无淋巴结转移组,经卡方检验,差异有统计学意义(χ2=22.3,P<0.01);stathmin蛋白表达在年龄、性别、组织类型、分期方面无显著性差异(P>0.05)。

表2 stathmin表达水平与NSCLC临床病理特征的关系
2.3 stathmin蛋白对术后化疗效果的预测
选取肺癌组中术后行含紫杉类辅助化疗并具备完整随访资料者32例,将stathmin蛋白指标分为阳性、阴性两组。其中stathmin蛋白为阳性者16例,其1、2、3年生存率分别为68.75%、18.75%和0,中位生存期为18个月;为阴性者16例,其1、2、3年生存率为87.5%、56.25%和31.25%,中位生存期为27个月。二者1、2、3年生存率比较,χ2=5.12,P<0.05。二者生存曲线如下,差异有显著性(图1)。
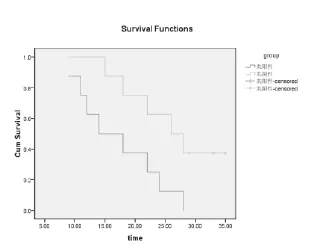
图1 两组患者的生存曲线图
3 讨 论
目前为止,NSCLC的化疗效果仍然不是太理想,在目前常用的化疗方案中尚未有一种方案效果显著,肺癌细胞出现耐药性是影响化疗疗效的主要因素,多药的耐药(MDR)可能是导致NSCLC化疗失败的主要原因[7]。若能前瞻性地进行分子指标的检测,预测患者对药物的疗效及预后,就可能做到个体化治疗及预后的判定。
stathmin蛋白是近年来发现的在细胞的增殖和分化中十分重要的可溶性蛋白质,其家族成员包括stathmin、SCG10、SCLI和RB3。该蛋白由149个氨基酸组成,相对分子质量19×103。stathmin蛋白为一种高度保守的细胞内蛋白,该蛋白作为细胞信号转导分子在细胞分化、组织再生、修复及在神经系统的发育[8,9]、尤其是恶性肿瘤发生、发展及肿瘤细胞对化疗的敏感性上具有重要意义[10,11]。细胞微管由微管蛋白二聚体构成,是真核生物细胞内重要的细胞骨架,是有丝分裂时纺锤体的基本组成单位。stathmin蛋白具有解聚微管的作用,通过调节该蛋白的表达和活性,控制细胞的增殖和分化:有丝分裂间期,活性状态的stathmin蛋白高表达,促进微管解聚;有丝分裂早期,stathmin蛋白磷酸化,成为非活性状态,此时微管聚合增加,有丝分裂纺锤体形成;有丝分裂后期,stathmin蛋白去磷酸化恢复活性,促进微管解聚,有丝分裂纺锤体解散,退出有丝分裂。Rubin等[11]研究证实,stathmin缺少的细胞中微管聚合增加,而stathmin过表达的细胞中微管聚合减少。
本研究结果显示,stathmin蛋白主要表达在细胞浆内,在NSCLC中表达高,并与分化程度及有无淋巴转移密切相关(P<0.05);而与患者年龄、性别及肿瘤病理类型和分期无关。提示stathmin阳性表达可能与肺癌的发展有着重要的相关性,在肺癌的发生、发展过程中扮演着重要的角色。其与细胞的增殖和分化有关,其有可能成为人类肺癌生物治疗的一个新靶点。
紫杉类化疗药物作为抗微管解聚的细胞毒类药物,1992年被美国FDA批准临床上使用。紫杉类药物主要作用于细胞G2晚期和M期末,它虽可促进微管蛋白装配成微管,然而却抑制微管的裂解,导致微管排列异常,使纺锤体失去正常功能而引起细胞死亡[12]。临床上用紫杉醇治疗肿瘤时,需注意到患者肿瘤细胞的基因状态,这可能是与药物疗效有关的重要因素[13,14]。
与紫杉类化疗药物相同,stathmin蛋白的下游作用靶点也是微管系统,即在细胞分裂周期中起关键作用的微管蛋白、微管及纺锤体等细胞器,只是作用路径不同,在细胞分裂间期(G0-M)末端具有抑制微管蛋白聚集的作用[15]。国内外研究结果表明,肿瘤基因stathmin的表达程度与肿瘤对化疗药物的敏感性有一定关系[16]。
本研究结果显示,stathmin均呈阳性时,患者生存率和生存期较均为阴性者下降(P<0.05),提示stathmin均呈阳性表达的患者对含紫杉化疗药的敏感性较其均呈阴性表达者差。提示我们,stathmin均呈阳性表达时,NSCLC患者对含紫杉类的化疗药物的敏感性下降,患者术后预后较差。
综上所述,过表达的stathmin均可引起肿瘤细胞对紫杉类化疗药物敏感性的降低,但目前对其具体的机制还未有一个非常明确的阐述,还有待于进一步的研究得以证实,通过对两种因子的检测,我们证实了两种因子可能作为预测患者对紫杉类药物化疗疗效的指标。这就为NSCLC患者个体化的治疗提供了一定的指导意义,为具体的化疗方案的选择提供了帮助.但是,本实验只局限了与紫杉类药物的作用关系,与其他化疗药物的关系还不明确,还需要其他学者的研究得到证实。随着各种化疗药物耐药机制不断的被阐明以及逆转耐药策略的成熟,相信对NSCLC患者的化疗就可以做到真正的有的放矢。
[1]Rinaldi M,Cauchi C,Gridelli C.First line chemotherapy in advanced or metastatic NSCLC[J].Ann Onc,2006,17(Suppl 5):64-67.
[2]Sarries C,H aura EB,Roig B,et al.Pharmacogenomic strategies for developing customized chemotherapy in non-small-cell lung cancer[J].Pharmacogenomics,2003,3(6):763-780.
[3]Schubart UK,AlagoW,DanoffA.Properties of p19,a novel cAMP2 dependent p rotein kinase substrate p rotein puri fi ed from bovine brain [J].J Biol Chem,1987,262 (24): 11871-11877.
[4]Jing XR,Liu L,Zhao H,et al.Relationship between expression of Stathmin gene in cancer cells and its sensitivity to chemotherapeutic drugs[J].Fourth Milit Medi Univ,2005,26(9):784-788.
[5]Alli E,Bash Babula J,Yang JM,et al.Effect of stathmin on the sensitivity to antimicrotubule drugs in human breast cancer[J].Cancer Res,2002,62(23):6864-6869.
[6]Bhattacharya R,Cabral F.A ubiquitous beta-tubulin disrupts microtubule assembly and inhibits cell proliferation[J].Mol Biol Cell,2004,15(7):3123-3131.
[7]沈绍华,叶欣.肺耐药相关蛋白与多药耐药关系的研究现状[J].国外医学肿瘤学分册,2000,27(4):230-232.
[8]Mori N,Morii H.SCG10-related neuronal growth-associated proteins inneural development,plasticity,degeneration,and aging[J].J Neurosci Res,2002,70(3):264-273.
[9]Chen W,Ji J,Xu X,et al.Proteomic comparison between human young and old brain by two-dimensional gel electrophoresis and identi fi cation of proteins[J].Int J Dev Neurosci,2003,21(4):209-216.
[10]Campostrini N,Marimpietri D,Totolo A,et al.Proteomic analysis of anti-angiogenic effects by a combined treatment with vinblastine and rapamycin in an endothelial cell line[J].Proteomics,2006,6(15):4420-4431.
[11]Rubin CI,Atweh GF.The role of stathmin in the regulation of the cell cycle[J].J Cell Biochem,2004,93(2):242-250.
[12]Alli E,Yang JM,Ford JM,et al.Reversal of stathmin-mediated resistance to paclitaxel and vinblastine in human breast carcinoma cells[J].Mol Pharmacol,2007,71(5):1233-1240.
[13]Raff MC.Social control on cell survival and cell death[J].Nature,1992,356(6368):397-400.
[14]何松,沈薇,沈鼎明.体外观察紫杉醇对肝癌HepG2细胞生长的影响[J].重庆医学,2003,32(3): 268-270.
[15]Zada A,Geletu M,Pulikkan J,et al.Proteomic analysis of acute promyelocytic leukemia: PML-RARα leads to decreased phosphorylation of op18 at serine 63[J].Proteomics,2006,6(21):5705-5719.
[16]Budde PP,Kumagai A,Dunphy WG,et al.Regulation of op18 during spindle assembly in xenopus Egg Extracts[J].J Cell Biol,2001,153(1):149-158.
——水芹主要害虫识别与为害症状

