棉苗立枯病拮抗菌的筛选及鉴定
罗燕娜,杜娟,李俊华,徐齐君,赵思峰
(石河子大学绿洲农作物病害防控重点实验室,石河子832003)
棉苗立枯病拮抗菌的筛选及鉴定
罗燕娜,杜娟,李俊华,徐齐君,赵思峰
(石河子大学绿洲农作物病害防控重点实验室,石河子832003)
为明确7株拮抗细菌对棉苗立枯丝核菌在生物防治中的应用潜力,通过拮抗菌拌种催芽、温室盆栽测试、小区拌种测定及大田拌种测定其防治棉苗烂根病的防治效果。结果表明,拮抗菌S37和S44具有较好的促生和防病效果。在小区试验中,S37和S44对棉苗立枯病的防治效果分别为47.8%和57%,与化学种衣剂福多甲的效果相当。在新疆兵团143团和148团的大田试验中,S37对棉苗立枯病的防治效果均为37.5%,也与福多甲的防治效果相当。通过菌落形态特征观察和16S rDNA分析,对防病和促生效果最好的2株拮抗菌S37和S44进行了鉴定,结果表明,这2株拮抗菌均为枯草芽孢杆菌(Bacillus subtilis)。
棉花;立枯丝核菌;拮抗菌;筛选;枯草芽孢杆菌
Abstract:CottonRhizoctonia solani-induced damping-off disease is the most important plant disease in Xinjiang cotton region.In order to appraise the applied potentiality of 7 bacteria strains with the antagonistic Rhizoctonia solaniactivity controlRhizoctonia solani-induced damping-off disease.Promoting growth and control effect were screened basing expedite budding,pot trail,plot and field experiment.The result show that S37 and S44 can promote cotton growth and better control cottonRhizoctonia solani-induced dampingoff disease.S37 and S44 had a better control efficacies and were 47.8%and 57%in plot tests respectively,equal the dress seeds with Fuduojia.S37 had a better control efficacy and was 37.5%and 37.5%in field tests in Regiment 143 and Regiment 148 of Shihezi area respectively,equal the dress seeds with FUDUOJ IA.S37 and S44 were identified as Bacillus subtillus basing morphological,physiological characteristic and based on 16S rDNA senquence phylogenetic analysis.
Key words:cotton;Rhizoctomia solani;biocontrol bacteria;screening;B acillus subtillus
立枯病又称烂根、黑根病,是棉花苗期的主要病害,南、北方棉区均有发生[1]。新疆是我国最重要的植棉区,由于地理位置特殊,在棉花播种到成苗期间经常遭遇倒春寒,这非常利于由立枯丝核菌(Rhizoctonia solaniKuhn)引起的立枯病的发生,其不仅造成烂种、烂芽和棉苗死亡,严重时导致大面积棉田缺苗断垄,甚至毁种重播,造成巨大经济损失[2-4]。
立枯丝核菌以菌丝体或菌核在土壤中或病残体上越冬,在土壤中形成的菌核可存活数月至几年,该菌可抵抗高温、冷冻、干旱等不良环境条件,适应性很强,一般能存活数年,且耐酸碱[1]。因缺乏对该病的抗病品种,对该病的防治目前主要以化学杀菌剂拌种或种衣剂包衣为主,但使用化学农药不能从根本上防治棉花立枯病,又带来环境污染[5-6]。采用生物防治的方法来防治棉苗烂根病是一种行之有效的技术,此方法既可限制有害微生物生长,又增加了根际有益微生物的数量,同时可以减少化学农药带来的环境污染,因此,筛选出能够有效防治该病的生防微生物并制成生物种衣剂以替代化学农药拌种或化学种衣剂就十分必要[6]。
本研究对前期筛选获得的7株拮抗菌作了进一步筛选和比较,对2株具有良好防病和促生效果的菌株进行了形态学和分子生物学鉴定,以明确这2个菌株具体种类和对棉苗烂根病的应用潜力,从而为棉花生物种衣剂的开发提供理论依据。
1 材料与方法
1.1 材料
棉花品种为新陆早13号,购买于石河子市种子市场。
供试拮抗菌 S23、S37、S44、S48、S71、S158 和S228分离自新疆加工番茄和棉田土壤中,前期研究证明对立枯丝核菌有较好抑制效果。
供试病原菌立枯丝核菌(Rhizoctonia solani Kuhn)为本实验室分离保存。
马铃薯葡萄糖培养基(PDA)[7]:去皮马铃薯200 g、葡萄糖 20 g、琼脂 18 g、蒸馏水 1000 mL,p H 6.8。
营养琼脂液体培养基(NA)[7]:牛肉膏3 g、蛋白胨 5 g、NaCl 5 g、葡萄糖 10 g、蒸馏水 1000 mL,p H 7.0~7.2。
对照药剂为福多甲,由新疆康正农业科技开发有限公司生产,为新疆使用面积较大的棉花专用种衣剂。
土壤为棉田土壤,过筛,在烘箱中160℃灭菌2 h备用。
1.2 方法1.2.1菌体培养
立枯丝核菌培养:将斜面保存的菌株接入PDA平板上置于培养箱中28℃培养72 h,长满全皿后备用。
拮抗菌培养:将不同拮抗菌分别接入装有NA培养基的三角瓶中,28℃200 r/min摇床培养48 h,将其稀释到1×108cfu/mL备用。
1.2.2 拮抗菌室内催芽促生效果测定
挑选饱满、无破损和发芽率高的棉种浸入配制好的拮抗菌菌悬液3 h,取出、晾干。以福多甲拌种和清水拌种为对照。
用直径40 cm的托盘,底面均匀水平,在托盘底部垫上灭菌的厚度一致的纱布,将托盘分为5个区,每个区分别均匀摆放处理好的棉种20粒,将无菌水注入到每个区域的纱布上,使纱布刚好吸满,在托盘上覆盖1层保鲜膜,放入人工气候箱中25℃培养,观察发芽时间,3 d后调查发芽率,7 d后分别测量各处理的芽长、根长和鲜重。
1.2.3 拮抗菌对棉苗立枯病防病效果测定
盆栽防病效果测定:选用装土量0.5 kg的培养钵,将培养好的丝核菌接入灭菌土壤中,接菌量为1/4皿每钵,种子处理方法同上。用培养钵装菌土0.4 kg,每钵播种20粒种子,然后再覆盖1层灭菌土,每处理设3个重复,以福多甲和清水处理种子为对照。出苗后,在1片真叶期调查记录各处理立枯病的发病率和病情指数,计算各拮抗菌对棉花立枯病的防治效果[2]。
小区防病效果测定:小区试验在2008年进行,2008年4月持续低温阴雨天气,非常有利于棉苗烂根病发生,发病十分严重,很多地块发病率达到100%。小区地点设在石河子大学农学院实验站中,小区面积共计132 m2,已连续3年种植棉花,种子处理同上。每个处理3次重复,随机排列,人工种植,膜下滴灌,正常管理浇水。出苗10 d后调查棉苗立枯病的发病率和病情指数,计算拮抗菌的防治效果。
大田防病效果测定:大田试验也在2008年进行,分设于2块地,一块地设在143团10连,地块均一,于4月18日播种,播种量为60 kg/hm2播种方式为10 cm+66 cm机采棉配置,膜宽2.05 m,灌溉方式为膜下滴灌,正常管理。出苗后,于5月13日进行调查,每个处理随机抽取3个点,每点抽取50株,记录发病率和病情指数,计算防治效果。另一块地设在148团4连,土质均一,于4月10日播种,播种量为67.5 kg/hm2,播种方式为10 cm+66 cm机采棉配置,膜宽2.05 m,灌溉方式为膜下滴灌。出苗后从5月3日起,每隔5 d调查1次,记录发病率和病情指数,计算拮抗菌的防治效果。
棉苗烂根病分级标准:0级,健苗;1级,茎基、根部局部有病斑;2级,1/3~1/2的茎基、根部出现病斑;3级,1/2~2/3的茎基、根部出现病斑;4级,枯死[3]。
发病率=发病株数/调查总株数×100%;
病情指数=[Σ(各发病级株数×代表数值)/(调查总株数×发病最重级的代表数值)]×100;
防治效果=[(对照组病情指数-处理组病情指数)/对照组病情指数]×100%。
1.2.4 拮抗菌S37和S44的初步鉴定
培养性状及菌落形态特征观察:经筛选S37和S44具有较好的防病和促生效果,对其进行常规的革兰氏染色、菌体形态和和菌落形状观察以及芽孢染色,参照文献[7]中的方法进行。对照菌株革兰氏阴性菌为大肠杆菌,革兰氏阳性菌为枯草芽孢杆菌。
生防菌株S37和S44的16S rDNA片段扩增和序列分析:菌株基因组DNA的提取参照文献[8]的方法。
采用细菌16S rDNA基因的通用引物16F27(正向引物 :5′-AGA GTT TGA TCC TGG CTC AG-3′)和 16R1522(反向引物 :5′-AAG GA G GTG ATC CAG CCG CA-3′)扩增参试的细菌菌株16 S rDNA序列[9-10]。
PCR反应体系:基因组DNA 2μL、10×PCR buffer 5μL、10 mmol/L dN TP 4μL、25 mmol/L MgCl23μL、2μmol/L 16F27 5μL、2μmol/L 16R1522 5μL、5 U/μL Taq DNA 聚合酶 0.5μL,加入ddH2O至终体积为50μL。扩增反应程序:94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸 2 min,35个循环;最后72℃延伸 10 min。反应完成后,1%琼脂糖凝胶电泳检测 PCR反应产物。
将PCR反应产物进行进一步纯化后委托上海生工生物工程技术服务有限公司进行测序。用DNAMAN软件将测序结果与其他12个芽孢杆菌菌株的16S rDNA序列进行比对,并构建系统树,应用自展法(bootstrap)检验系统树,自展数据集为1000次。
2 结果与分析
2.1 拮抗菌对棉种发芽的影响
由表1可知:除S48外,各拮抗菌处理棉种后都能提高棉种的发芽率。S37、S44、S71、S158和S228均可促进棉花种子提前出芽,同时这几株拮抗菌还可以明显增加棉花的芽长、根长和鲜重,其中S71和S228的促生效果最好,鲜重与对照相比分别增加了13.25%和 11.66%,其次为 S158、S44 和 S37,鲜重与对照相比分别增加了7.69%、7.69%和5.88%。S23、S48和福多甲对照处理则促生效果不明显。
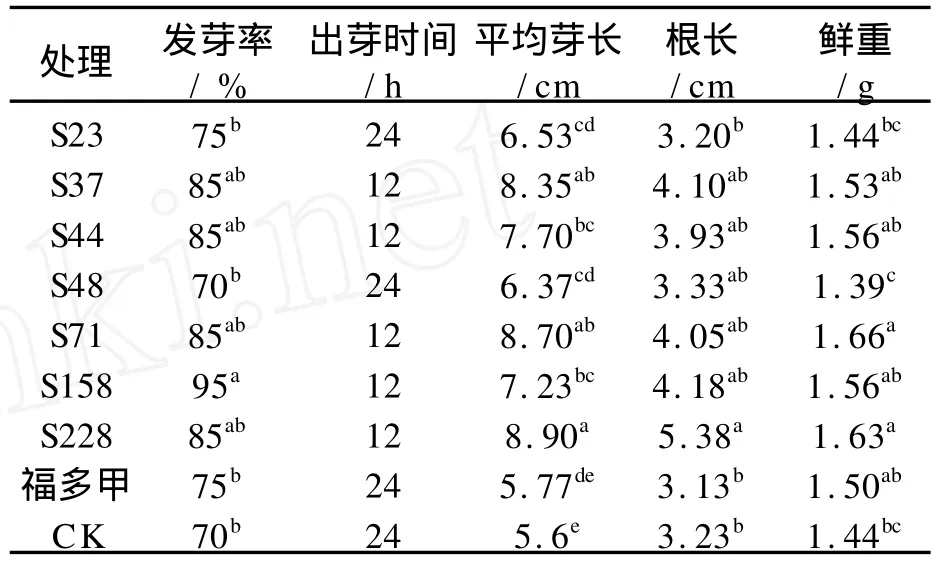
表1 拮抗菌对棉种出芽影响Tab.1 The effect of antagonistic bacteria to cotton seeds germinating
2.2 拮抗菌对棉苗立枯病的防病效果
2.2.1 拮抗菌防治棉苗立枯病盆栽试验效果
选择促生效果较好的拮抗菌 S37、S44、S71和S228进行盆栽试验,结果见表达式。由表2可知:在土壤中存在立枯丝核菌的情况下,各拮抗菌都可促进棉花提前出苗,同时对棉苗立枯病均有一定防治效果。供试菌株中S228防治棉苗烂根病的防效达到58.9%,但出苗率仅为29.4%,低于对照的出苗率。S37、S44和S71的拮抗菌既可提高棉种的出苗率,同时对棉苗烂根病的防治效果分别达到21.8%、53.4%和8.2%。在同样条件下,化学种衣剂福多甲的防病效果为32.9%。

表2 拮抗菌对棉花立枯病盆栽防病效果Tab.2 Effect of antagonistic bacteria to control cotton damping-off disease in pot trail
2.2.2 拮抗菌防治棉苗烂根病小区试验效果
田间小区试验的结果(表3)显示,4株拮抗菌对棉苗立枯病均有一定的防治效果,4株拮抗菌都可显著降低棉苗立枯病的发病率和病情指数,其中S228和S44的相对防效分别达到了59%和57%,高于种衣剂福多甲54.5%的相对防效,S37和S71的相对防效略低于福多甲,其相对防效分别为47.8%和43.9%。
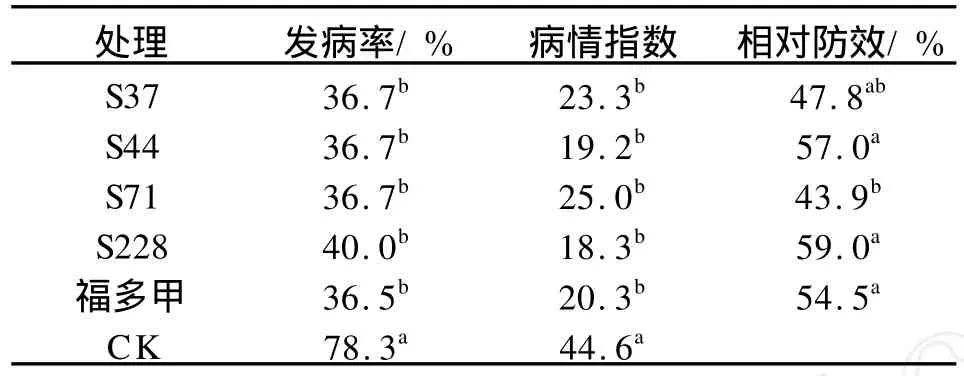
表3 拮抗菌防治棉花立枯病的小区试验结果Tab.3 Effects of antagonistic bacterium to control cotton damping-off disease in plot tests
2.2.3 拮抗菌防治棉苗烂根病大田试验效果
所选拮抗菌在2块大田中对棉苗立枯病均有防治效果(表4)。在143团10连发病较轻的地块中,其中S37相对防效达到37.5%,化学种衣剂福多甲的相对防效为32.55%,S228、S44和S71的相对防效分别为29.61%、20.01%和14.06%,均低于福多甲。148团4连棉苗立枯病发生较为严重,福多甲防病效果最好,其相对防效达到39.93%;其次为S37,相对防效为37.5%,与福多甲防病效果相当,S228、S44和 S71的相对防效分别为 19.6%、13.8%和15.1%,均低于福多甲。

表4 大田生产条件下几种拮抗菌对棉花立枯病的防治作用Tab.4 Effects of antagonistic bacterium to control cotton damping-off disease in the field
2.3 拮抗菌的初步鉴定
2.3.1 拮抗菌的形态观察
取防病和促生效果最好的拮抗菌S37和S44进行鉴定,经革兰氏染色后在显微镜下观察,2株拮抗菌菌体形态均为短杆状(图1a)。实验结果表明,大肠杆菌标准菌株染色后呈红色,KOH实验有明显的丝状物拉出,为革兰氏阴性菌;2株拮抗菌经革兰氏染色后均呈蓝紫色,KOH实验均无丝状物拉出,为革兰氏阳性菌。将培养48 h的2株拮抗菌经芽孢染色后镜检,可以看见红色短杆状的菌体中间有绿色的芽孢,形状近似椭圆形,并且没有膨大的孢囊(图 1b)。
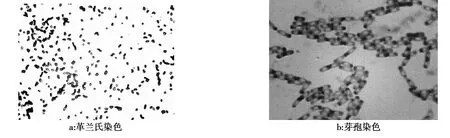
图1 拮抗菌S37和S44革兰氏染色和芽孢染色情况Fig.1 Gram stain and sporangium stain of antagonistic bacteria S37 and S44
2.3.2 菌株S37和S44的ITS序列分析
将S37和S44的DNA提取后经电泳检测,所得DNA片段约为22 kbp。以所提的总DNA为模板进行 PCR扩增,均能扩增出1条大小约为1500 bp的特异性条带,纯化测序后,菌株 S37和 S44的16S rDNA序列DNA长度分别为870和897 bp。与文献已经报道的具有生物防治作用的并且具有促生作用的 B acillus subtilis进行比对,并用 Paeni-bacillus polymy xa作为外群,结果得到了系统发育树(图 2)。
从图2可以看出,S37和S44与B acillus subtilis(AM501549)和 B acillus subtilis(FJ984438)亲缘关系最近,相似率达到100%,通过2株生防菌的16S rDNA分析,初步将S37和S44鉴定为B acillus subtilis。

图2 菌株S37和S44的系统发育树状Fig.2 Phylogenetic tree based on alignment of strain S37 and S44 and other other 12 Bacillus species including 16S rDNA sequencing data
3 讨论
目前,筛选能够有效防治棉苗烂根病的生防微生物并制成生物种衣剂以替代化学农药或化学种衣剂日益受到关注。
Howell等[11]和 Hagedorn等[12]研究了木霉防治棉花立枯病的生防机制,认为木霉主要通过重寄生、产生抗生素、诱导棉苗根部植保素积累、萜烯类化合物的形成以及在棉株根部的有效定殖来防治棉苗烂根病。Djonovic等[13]研究认为木霉能产生1种诱导棉花产生防卫反应的蛋白类激发子Sm1,其能够诱导棉株活性氧的迸发和相关防卫基因的表达,从而获得局部的或系统的抗病性减轻棉花病害的发生。张亚平等[3,14]和阎小雪等[15]分别从新疆棉田土壤中分离、筛选获得了对棉苗苗期病害有较好防治作用的芽孢杆菌;纪春艳等[2]从新疆棉田土壤筛选到了对棉苗立枯病有较好防治作用的拮抗细菌和放线菌,并初步研究了其防治机理;罗明等[16]则从新疆不同种植区的棉花植株组织中分离获得一批对立枯丝核菌抑菌作用较强的内生细菌。上述研究的结果均表明,筛选、获得能够替代化学拌种剂的高效生防菌株来防治棉苗烂根病从理论和实践上都很有发展前景。
本研究针对前期筛选获得的对立枯丝核菌具有较好拮抗活性的拮抗细菌开展了促进棉种发芽和防治棉苗立枯病的研究,结果表明:拮抗菌株 S37和S44既具有提高棉种发芽率、促进棉花提前出苗和增加棉苗生物量的作用,又能较好地防治棉苗立枯病的效果。在小区试验中,S44防病效果好于种衣剂的效果,S37则与种衣剂的防病效果相当。在大田试验中,S37在2个点上的防病效果与种衣剂相当,而S44的防病效果与种衣剂相差较远,这可能是由于新疆地域辽阔,生态环境复杂,存在长期低温或干旱等不利于棉苗生长和生防菌定殖的气候因子,同时生防菌进入棉田土壤后受其他微生物的影响也可能影响其生物活性。如果能在剂型和使用方式上找到能使生防菌活性更稳定的制约因子,使其真正能够发挥其防病和促生作用将最终可以化学种衣剂,从而使其具有较好的推广应用前景,这将是今后需要深入探讨的重要工作。
对这2株具有应用前景的拮抗菌进行了形态学和分子生物学鉴定,最终将其鉴定为枯草芽孢杆菌(B acillus subtilis),这将为明确其防病机理和适用范围提供理论和技术依据。
[1]何叶,高树凯,乔国梅,等.棉花立枯病的症状及防治[J].北京农业,2007,9(25):44-45.
[2]纪春艳,王纯利,罗明.新疆棉花立枯病根际生防细菌的筛选[J].西北农林科技大学学报:自然科学版,2007,35(5):97-101.
[3]张亚平,李国英,阎小雪.北疆棉花苗期病害生防菌7B-1的研究[J].中国农业科学,2002,35(6):728-731.
[4]龚双军,李国英,蔺国仓.不同品种棉花对立枯丝核菌抗性的测定[J].石河子大学学报:自然科学版,2004,22(7):55-56.
[5]Amanda J.Bennett,John M.Whipps.Beneficial microorganism survival on seed,roots and in rhizosphere soilfollowing application to seed during drum priming[J].Biological Control,2008,44:349-361.
[6]杜志兵,杜秉海,姚良同,等.两株棉花立枯病生防菌MH1和MH25的筛选与鉴定[J].微生物学通报,2008,35(2):204-208.
[7]方中达.植病研究方法[M].3版.北京:农业出版社,1998.
[8]何迎春,高必达.立枯丝核菌的生物防治[J].中国生物防治,2000,16(1):31-34.
[9]Edward U,Rogall T,Blocker H,et al.Isolation and direct complete nucleotide determination of entire genes.Characterization of a gene coding for 16S ribosomal RNA[J].Nucleic Acids Res,1989,17:7843-7853.
[10]Hauben L,Vauterin L,Swings J,et al.Comparison of 16S Ribosomal DNA Sequences of allXanthomonasSpecies[J].Int JSyst Bacteriol,1997,47:328-335.
[11]Howell C R,Hanson L E,Stipanovic R D,et al.Induction of terpenoid synthesis in cotton roots and control ofRhizoctonia solaniby seed treatment with Trichoderma virens[J].Phytopathology,2000,90(3):248-252.
[12]Hagedorn C,G ould W D,Bardinelli T R C.Rhizobact-eria of cotton and their repression of seedling disease pathogens[J].Applied and Environmental Microbiology,1989,55(11):2793-2797.
[13]Djonovic S,Pozo M J,Dangott L J,et al.Sm1,a proteinaceous elicitor secreted by the biocontrol fungus Trichoderma virensinduces plant defense reponses and systemic resistance[J].Molecular Plant-Microbe Interaction,2006,19(8):838-853.
[14]张亚平,李国英.北疆棉花根际微生物对棉花立枯病拮抗作用的研究[J].石河子大学学报:自然科学版,1998,2(1):8-11.
[15]阎小雪,李国英,乔贵宾.新疆棉花苗期病害拮抗细菌的筛选和应用[J].新疆农业科学,2004,41(5):288-292.
[16]罗明,芦云,张祥林.棉花内生细菌的分离及生防益菌的筛选[J].新疆农业科学,2004,41(5):277-282.
Screening and Identification of Antagonistic Bacteria Control Rhizoctonia solani-onduced Damping-off of Cotton
LUO Yanna,DU Juan,LI Junhua,XU Qijun,ZHAO Sifeng
(The Key Laboratory of Prevention and Control for Oasis Crop Disease,Shihezi University,Shihezi 832003,China)
S435.111.4;S562
A
1007-7383(2010)05-0555-06
2009-11-19
农业部“948”重大项目(2006-G62),公益性行业科研专项(农业)(200803031),教育部春晖计划项目(Z2006-1-83016),新疆兵团基础研究计划项目(ZD2007JC02)
罗燕娜(1985-),女,硕士生,专业方向为植物病害生物防治;e-mail:luoyn0408@163.com。
赵思峰(1975-),男,副教授,从事植物病害生物防治研究;e-mail:zhsf㊦agr@shzu.edu.cn。

