棉花9-顺式环氧类胡萝卜素双加氧酶基因在干旱条件下的表达分析
刘江娜,邓晓艳,李志博,刘菲菲,章杰,郗忠玲,魏亦农
(石河子大学农学院/新疆兵团绿洲生态农业重点实验室,石河子 832003)
棉花9-顺式环氧类胡萝卜素双加氧酶基因在干旱条件下的表达分析
刘江娜,邓晓艳,李志博,刘菲菲,章杰,郗忠玲,魏亦农
(石河子大学农学院/新疆兵团绿洲生态农业重点实验室,石河子 832003)
为了了解棉花幼苗9-顺式环氧类胡萝卜素双加氧酶(NCED)基因在干旱胁迫下的生物学功能,采用半定量逆转录聚合酶链式反应(semi RT-PCR)法检测在干旱胁迫下棉花 GhNCED基因表达量的变化。结果表明:随着PEG6000介导的水分胁迫时间的推移,该基因的表达量逐渐上升,6 h时达到最强,随后又逐渐下降,到24 h时表达量降到最低。而在棉花不同的组织器官中,6 h时水分胁迫能显著促进棉花叶和茎中NCED基因的表达,根部GhNCED基因表达变化较小。
棉花;NCED;半定量RT-PCR;水分胁迫
Abstract:In order to study the biologic function of 9-cis-epoxycarotenoid dioxygenase(NCED)gene under water-stress in cotton,a semi RT-PCR system was established to detect the gene expression of NCED in dehydrated cotton.The result showed that the expression level of the gene in leaves was gradually increased with the water-stressed accumulation,and it reached the highest level at the time point of 6 hours after PEG6000 and treatment and then it was gradually decreased to the lowest level after 24 hours'water stress.In different organs of cotton,the expression of GhNCED gene can be obviously induced at 6 hours after water stress treatment in stems and leaves,but the expression level of the gene in root was not obvious.
Key words:cotton;NCED;semi RT-PCR;dehydration
脱落酸(abscisic acid,ABA)在植物抗逆境胁迫反应中起着广泛而重要的作用[1],干旱、高盐和低温胁迫均能引起植物内源 ABA水平的提高[2-3]。ABA生物合成酶中9-顺式环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenase,NCED)催化的氧化裂解反应是ABA生物合成途径中的关键步骤[4]。NCED基因最初是在玉米(Zea mays)的ABA缺失突变体 viviParousj4(vPj4)中克隆得到[5],其可以特异地氧化裂解9-顺式紫黄质和9-顺式新黄质而产生黄质醛,而并不催化其它种类的类胡萝卜素氧化裂解。随后在拟南芥[6]、番茄[7]、豇豆[8]、鳄梨[9]、菜豆[10]、柑橘[11]等植物中均克隆到了NCED基因。对不同植物中的NCED基因分析表明,这类基因是一个多基因家族,在植物界中普遍存在并高度保守;在结构上无内含子,氨基酸序列的N-端有典型的叶绿体靶向转运肽,而 C-端高度同源,并且有4个保守的组氨酸结构。
棉花种植区多分布在干旱、半干旱地区,因此干旱是影响棉花的产量和质量的主要制约因素之一。而近年来,抗虫棉的推广及应用、棉花抗黄、枯萎病的基因工程研究大大降低了生物胁迫对棉花品质所造成的不良影响[12],而非生物胁迫下抗逆分子机制研究及基因工程的研究也在不断深入。因此,应用分子生物学技术,研究棉花抗逆分子机制,并利用基因工程技术分离出与棉花抗旱品质紧密相关的基因则显得十分重要。
目前,尚未见到棉花NCED基因的相关报道,水分胁迫下棉花体内NCED基因的表达模式及功能尚不明晰。本研究利用PCR方法结合cDNA末端快速扩增(RACE)技术扩增棉花NCED基因的同源片段以及3′末端,并利用半定量RT-PCR的方法分析其在棉花受到水分胁迫时的表达特性,以期为进一步探讨 GhNCED基因作为新的棉花抗旱基因资源的可行性奠定基础。
1 材料与方法
1.1 材料
以抗旱品种晋13为实验材料,用 Hogland营养液培养棉花至第3片真叶展开,20%的PEG6000处理棉花幼苗,用于提取棉花总RNA。
1.2 方法
1.2.1 RNA的提取
取1 g左右的棉花新鲜幼嫩叶片组织,利用改良的CTAB/酸酚法[13-14]提取棉花组织总RNA,用琼脂糖凝胶电泳检测总RNA的完整性,用紫外分光光度计测定OD260与OD280,确定总 RNA的浓度和纯度。
1.2.2 棉花GhNCED基因主体片段的克隆
以棉花总RNA为模板,参照M-MLV的反转录试剂盒(invotrogen公司)说明书的方法合成cDNA第一条链作为反应模板,以LJ1:5′-CGACGGMGACGGNATGGTBCACGC-3′和LJ2:5′-NNCTCYTCCCAM GCRTTC-3′(由上海生工公司合成)为引物,进行PCR扩增。基因扩增采用PCR反应体系[15](10μL):TaqDNA 聚合酶(天根公司 2.5 U/μL)0.2μL、10×buffer 1μL、dNTP(10 mmol/L)0.2μL、LJ1(10 μmol/L)0.2μL、LJ2(10μmol/L)0.2μL、反转录第一条cDNA 0.4μL、ddH2O 7.8μL,总反映体系为10μL。PCR反应程序:94 ℃3 min,94 ℃1 min、55℃1 min、72℃1 min,35个循环,72℃延伸10 min。PCR产物以1%的琼脂糖凝胶电泳检测后,用DNA凝胶回收试剂盒(天根公司)回收,克隆至pGEM-T easy载体(Promega公司),用 T7通用引物测序(上海生工公司)。
1.2.3 棉花 GhNCED基因3′端的克隆
逆转录:在微量离心管中加入棉花叶片RNA 2 μL 、3′-CDSprimer 1μL,用 RNAase Free ddH2O 定容至5μL混样之后迅速离心一下,70℃水浴2 min,迅速冰浴2 min,稍稍离心,使样品沉于管底,再依次加入5×First-strand buffer 2μL,DTT(20 mmol)1μL,dN TP Mix(10 mmol/L)1μL,MMLV Reverse Transcriptase 1μL,将混样反复抽提混匀几次后稍加离心,42℃温浴1.5 h,72℃灭活7 min,-20℃保存待用。
3′Outer PCR反应:取上步RT产物0.5μL,10×Buffer 1μL,LJ3:5′-GCCACTCAGGGATTGCCAGACTCTTACT-3′(10μmol/L)0.2μL,UPM(10μmol/L)1μL,dN TP(10mmol/L)0.2μL,Taq DNA 聚合酶(2.5 U/μL)0.2μL,ddH2O 6.9μL,反应条件为94℃30 s,72℃3 min,5个循环;94℃30 s,70℃30 s,5个循环;94℃30 s,68℃3 min,72℃3 min 25个循环。
3′Inner PCR反应:取第1轮产物1μL用 EDTA-buffer稀释50倍,取稀释后的产物1μL,10×Buffer 1μL,LJ4:5′-TGTCGAGA TCCCTCTATCCATGCCAACC-3′(10μmol/L)0.2μL,NUP(10 μmol/L)0.2μL,dNTP 0.2μL,Taq DNA 聚合酶(5 U/μL)0.2μL,ddH2O 7.2μL,反应条件为 94℃30 s,68℃3 min,72℃3 min 30个循环。
巢式 PCR扩增产物经回收、克隆、鉴定,每个阳性克隆挑选3个平行菌,送至上海生工生物技术服务有限公司进行测序。
1.2.4 半定量RT-PCR方法检测棉花 GhNCED基因在干旱胁迫下的表达
分别提取经 PEG6000 干旱处理 0、0.5、1、2、4、6、8、12、16、20、24 h 的棉花幼苗叶片总 RNA 并进行反转录(反转录条件参照上文),用于半定量RTPCR[16]的基因特异引物是在3′U TR区设计的:上游NCED1:5-GGGGAGGTAAAAAAGCAC-3,下游 NCED2:3-A TCCAAACTTTCCTCGCC-5。为防止扩增达到平台期,分别进行了26、30和35个循环的扩增,最后选用30个循环进行表达特性分析,反应条件:94℃3 min,94℃45 s,52℃45 s,72℃45 s,30个循环,72℃延伸10 min。
内参基因UBI的扩增引物序列[17]为:上游,5′-CAGATCTTCAAAACCCT-3′;下 游 ,5′-GACTCCTTCTGGATGTTGTA-3′。反应条件是:94 ℃3 min,94℃45 s,55℃45 s,72℃45 s,26个循环,72℃延伸10 min。
PCR产物在0.8%的琼脂糖凝胶上进行电泳分析。
1.2.5 半定量RT-PCR法检测 GhNCED基因在棉花不同组织中的表达
分别提取经 PEG6000干旱处理0、6 h的棉花幼苗根、茎、叶的总 RNA并进行反转录(反转录条件参照上文),方法同1.2.4。
2 结果与分析
2.1 RNA提取
分别提取经 20%PEG6000 处理 0、0.5、1、2、4、6、8、12、16、20、24 h 的棉花幼苗叶片总 RNA,以及经20%PEG6000处理0和6 h的棉花幼苗根茎的总 RNA,从结果(图1)可以见到28、18和5 S的条带,这表明所提取的 RNA完整性好。经DNaseⅠ处理后检测OD260/280,结果均在2.0左右,表明提取的RNA质量符合要求,可用于RT-PCR实验。
2.2 棉花GhNCED基因主体片段的扩增结果
用RT-PCR的方法,以简并引物LJ1和LJ2扩增出了746 bp的 GhNCED主体片段(图2a),与预期的片段长度相符。对测序结果进行BLASTp分析,该片段与NCBI数据库中其它NCED蛋白具有较高的同源性,与柑橘CsNCED(登录号为ABC26010.1)、蓖麻VVNCED(登录号为 E1F42638.1)和花生 AhNCED(登录号为 CAE004592.2)的同源性分别为87%、84%和79%,因此推测该片段是从棉花中克隆到的NCED基因同源片段。
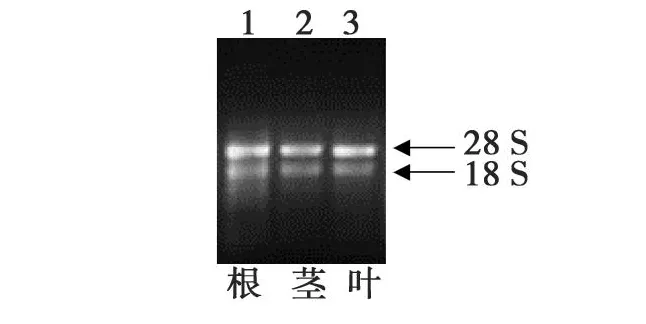
图1 棉花根、茎、叶的总RNAFig.1 The pattern of cotton total RNA
2.3 棉花 GhNCED基因3′端的克隆结果
根据RT-PCR所得的序列信息设计基因特异性引物,按Clontech公司的SMART RACE试剂盒提供的方法进行 RACE实验,引物LJ3和LJ4分别用于primary和nested PCR扩增目的基因的3′端,得到约1 kb的片段(图2b),将所得片段克隆并测序。对测序结果进行BLASTp分析,该片段与NCBI数据库中其它NCED蛋白有较高的同源性,与柑橘CsNCED(登录号为 ABC26010.1)、蓖麻 VVNCED(登录号为E1F42638.1)和菜豆 PvNCED(登录号为AAF26356.1)的同源性分别为 78%、78%和 73%。将所得GhNCED的3′端片段与其主体片段用DNAStar进行拼接,得到1个长度为1681 bp的片段。
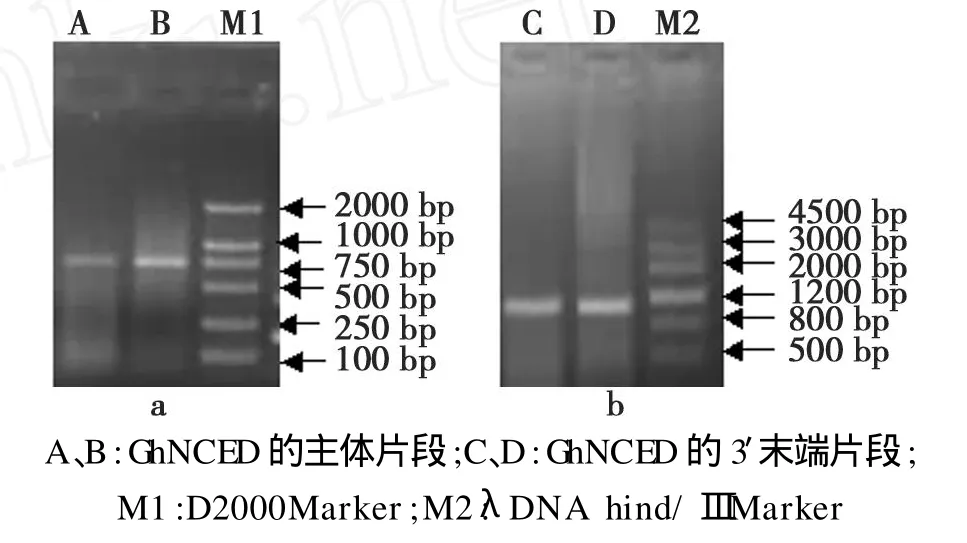
图2 GhNCED主体和3′片段Fig.2 The main fragment and 3′-end of GhNCED
2.4 水分胁迫对棉花 GhNCED基因表达的影响
作为内参照的UBI基因属保守性强的“管家基因”,UBI mRNA具有普遍而恒定表达的特性,设立内参照可减少加样不准或RNA定量时产生的误差。在本研究中,UBI扩增条带亮度相同,保证RTPCR的真实可靠性。采用RT-PCR方法半定量分析GhNCED基因响应脱水的表达情况。结果(图3)显示:GhNCED基因的表达呈现出典型的响应干旱胁迫的特征;经脱水处理能够显著诱导 GhNCED基因的表达。经PEG6000处理0.5 h后 GhNCED的表达量就开始增加,随着胁迫时间的延长其表达量仍在不断增加,处理6 h时表达量达到最高,随后其表达量不断降低,至24 h时表达量达到最低[10]。
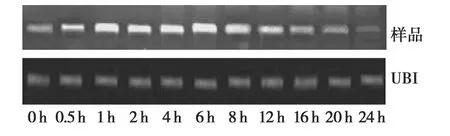
图3 棉花GhNCED基因在干旱处理下的表达情况Fig.3 Analysis of GhNCED expressing under water stress
2.5 GhNCED基因在在棉花不同组织中的特异性表达
分析干旱胁迫下棉花幼苗中 GhNCED基因表达的器官特异性,结果如图4所示,在未经胁迫的棉花幼苗茎叶中均检测到GhNCED基因,而在根部未检测到该基因。6 h水分胁迫能显著促进棉花叶和茎中的GhNCED基因的表达,但在根部其表达量只有少量的增加。

图4 GhNCED基因在棉花不同组织中的表达情况Fig.4 Analysis of GhNCED in different cotton organs
3 讨论
本研究所采用的semi RT-PCR是目前探讨基因转录水平的有效手段,可用来检测基因表达及其变化状况,并进行半定量分析,与传统的Nohrtem Blot法比较,其具有灵敏、简捷、特异性、费用低等优点。在特异引物的引导下,可以从低丰度mRNA逆转录产物中扩增出近μg级的cDNA产物。在运用半定量RT-PCR方法检测特异基因表达量的差异时,总RNA的质量至关重要,只有在总RNA未被降解的情况下,才能保证其中mRNA的完整性,从而真实反映起始模板中基因表达量的差异。
NCED的作用是转运到质体中裂解9-顺新黄质和9-顺紫黄质形成黄质醛,其编码的9-顺环氧类胡萝卜素双加氧酶是ABA合成的关键限速酶。NCED在果实成熟、萎蔫、干旱等过程或条件下对ABA的合成起着关键的调节作用。由此可见,多种胁迫条件能诱导该基因的大量表达,但经过各个处理后,NCED的表达变化趋势以及到达峰值的时间有很大差异。玉米ZmNCEDmRNA在萎蔫5 h后达到峰值[5];番茄LeNCEDmRNA在萎蔫12 h后增加3倍,但在干旱处理16 h时才增加3倍[7];菜豆叶片渗透胁迫30 min即可检测到 PvNCEDmRNA快速增加,并证明mRNA的变化领先于ABA的积累,且认为是叶片和根部NCEDmRNA控制着ABA的积累。本研究结果表明,在棉花幼苗叶片中GhNCED基因的表达呈现典型的响应水分胁迫的特征,水分胁迫0.5 h就能诱导 GhNCED转录本的增加,当水分胁迫6 h时 GhNCED基因的表达量达到最高,随着胁迫时间的增加,GhNCED基因的表达量又逐渐下降,直到胁迫24 h时,其表达量降到最低。在菜豆[10]和柱花草[18]中,干旱胁迫前用Nothern blot方法检测不到 PvNCED1和SgNCED基因的转录本,但是在受到短时间胁迫后二者的转录本均有大量的增加,说明 PvNCED1和 SgNCED基因在干旱胁迫下高效表达。我们采用的半定量RT-PCR方法在水分胁迫前的棉花幼苗叶片中也检测到了 GhNCED的表达,但其表达量低,水分胁迫时高效表达。这种结果可能是检测方法灵敏度不同造成的,RT-PCR检测灵敏度高能扩增出较低拷贝的转录本,这与 Tan等[19]利用实时定量 RT-PCR方法在拟南芥中的研究结果一致。而在棉花幼苗的不同器官中,我们发现在未经胁迫的棉花叶片和茎中均能检测到GhNCED的表达,但是在根中却检测不到 GhNCED基因的表达,水分胁迫 6 h后GhNCED基因在茎和叶片中高效表达,而在根中虽然检测到了 GhNCED基因的表达但表达量很低。这与万小荣等[20]利用半定量RT-PCR法在花生上的研究结果一致,同时万小荣等[20]将花生的AhNCED1氨基酸序列进行亚细胞定位结果发现,其N端有一典型的由30个氨基酸组成的叶绿体靶向转运肽,表明AhNCED1蛋白主要在地上部绿色组织中起作用。由此我们可以推测 GhNCED基因在根中表达量低的原因可能是 GhNCED蛋白主要也是在地上部绿色组织中起作用。而鉴于NCED基因是ABA合成过程中的关键限速酶,因此我们还可以推测在干旱条件下,ABA可能主要在叶片和茎中合成,从而使气孔关闭,通过降低蒸腾作用减少失水率。
4 结论
本研究中,我们分离到了1个新的棉花NCED基因,并通过半定量 RT-PCR实验发现,GhNCED基因在正常条件下表达量很低,干旱胁迫能够强烈诱导该基因的表达,并且在干旱处理0.5 h时棉花NCED基因的转录本便开始积累,直到6 h时其表达量达到最大,随后其表达量逐渐降低,直到24 h时其表达量降到最低。这表明棉花NCED基因对逆境胁迫的响应非常灵敏,而在棉花幼苗不同的器官中,GhNCED基因在茎叶中的表达量高,在根中表达量低。目前,抗逆基因分离及在品种改良上的应用是棉花抗逆育种的研究热点。本研究克隆了GhNCED基因的保守区及其3′末端,为进一步研究GhNCED基因表达的调控以及其蛋白结构奠定了一定的基础。目前 GhNCED基因的5′末端正在测序当中。
[1]Zeevaart J A D,Creelman R.Metabolism and physiology of abscisic acid[J].Annual Review of Plant Physiology and Plant Molecular Biology,1988,39:439-473.
[2]Liotenberg S,North H,Marion Poll A.Molecular biology and regulation of abscisic acid biosynthesis in plants[J].Plant Physiology and Biochemistry,1999,37(5):341-350.
[3]Seo M,K oshiba T.Complex regulation of ABA biosynthesis in plants[J].Trends in Plant Science,2002,7(1):41-48.
[4]Schwartz S H,K oornneef M,Zeevaart J A D,et al.Biochemical characterization of the aba2 and aba3 mutants in Arabidopsis thaliana[J].Plant Physiol,1997,114:161-166.
[5]Tan B C,Sehwartz S H,Zeevaart J A,et al.Genetic control of abscisis acid biosynthesis in maize[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94:12235-12240.
[6]Iuchi S,K obayashi M,T aji T,et al.Regulationof drought tolerance by gene manipulation of 9-cis-epoxyearotenoid dioxygenase a key enzyme in abscisic acid biosynthesis in Arabidopsis[J].Plant,2001,27:325-333.
[7]Burbidge A,Grieve T,Jackson A,et al.Structure and expression of a cDNA encoding a putative neoxanthin cleavage enzyme(NCED)isolated from a wilt-related tomato(L ycopersicon esculentumMill.)library[J].Journal of Experimental Botany,1997,47:2111-2112.
[8]Iuehi S,kobayashi M,Taji T,et al.A stress-inducible gene for 9-cis-epoxyecarotenoid dioxygenase involved in abscisic acid biosynthesis under water stress in droughttolerance cowpea[J].Plant Physiol.2000,123:553-562.
[9]Chernys J T,Zeevaart J A D.Characterization of the 9-cis-epoxycarotenoid dioxygenase gene family and the regulation of abscisic acid biosynthesis in avoeado[J].Plant Physiol,2000,124:343-353.
[10]Qin X,Zeevaart J A D.The 9-cis-epoxycarotenoid cleavage reaction is the key regulatory step of abscisic acid biosynthesis in water-stressed bean[J].Proceedings of the National Academy of the United States of America,1999,96:15354-15361.
[11]Rodrigo M J,Alquezar B,Zacaras L.Cloning and characterization of two 9-cis-epoxycarotenoid dioxygenase genes,differentially regulated during fruit maturation and under stress conditions,from orange(Citrus sinensisL.Osbeck)[J].Journal of Experimental Botany,2006,57(3):633-643.
[12]贾士荣,郭三堆,安道昌.转基因棉花[M].北京:北京科学出版社,2001.
[13]蒋建雄,张天真.利用改良的CTAB/酸酚法提取棉花组织总RNA[J].棉花学报,2003,15(3):166-167.
[14]朱新霞,高剑峰,刘红玲,等.小拟南芥几丁质酶基因cDNA的克隆与序列分析[J].石河子大学学报:自然科学版,2004,22(5):411-414.
[15]崔百明,李予霞,乐锦华,等.小拟南芥COR15a基因的克隆及序列分析[J].石河子大学学报:自然科学版,2003,7(2):87-89.
[16]黄先忠,马正强,魏灵珠,等.小麦泛素融合降解蛋白基因全长cDNA的克隆及分析[J].石河子大学学报:自然科学版,2004,22(5):369-372.
[17]Yue Hua Xiao,Zheng-Sheng Zhang.Cotton flavonoid structural genes related to the pigmentation in brown fibers[J].Biochemical and Biophysical Research Communications,2007,358:73-78.
[18]杨锦芬,郭振飞,杨静.柱花草9-顺式环氧类胡萝卜素双加氧酶基因(SgNCED1)的克隆及表达分析[J].草地学报,2007,16(3):21-28.
[19]Tan B C,Joseph L M,Deng W T,et al.Molecular characterization of the 9-cis-epoxycarotenoid dioxygenase gene family[J].The Plant Journal,2003,35:44-56.
[20]万小荣,李玲.花生水分胁迫诱导基因AhNCED1的克隆与功能分析[D].广州:华南师范大学,2005.
The Expression Analysis of Cotton 9-cis-epoxycarotenoid Dioxygenase G ene under Drought Stress
LIU Jiangna,DENG Xiaoyan,LI Zhibo,LIU Feifei,ZHANGJie,XI Zhongling,WEI Yinong
(College of Agriculture,Shihezi University/The Key Laboratory of Osis Eco-agricultury,Xinjiang Production and Construction Group,Shihezi 832000,China)
S513;S718.43
A
1007-7383(2010)05-0546-05
2009-12-24
国家自然科学基金项目(30760124)
刘江娜(1984-),女,硕士生,专业方向为生物技术在作物遗传育种中的应用。
魏亦农(1964-),男,教授,从事棉花遗传育种研究;e-mail:weiyinong@163.com。

