薄层荧光扫描法测定花生根中白藜芦醇的含量
韩小丽,张士真,呼亚旭,李明静*
(1.河南省医药学校,河南开封475001; 2.商丘市技师学院,河南商丘476000;3.河南大学化学化工学院,河南开封475004)
薄层荧光扫描法测定花生根中白藜芦醇的含量
韩小丽1,张士真2,呼亚旭3,李明静3*
(1.河南省医药学校,河南开封475001; 2.商丘市技师学院,河南商丘476000;3.河南大学化学化工学院,河南开封475004)
在硅胶 G铝箔板上,以V(氯仿)∶V(丙酮)∶V(甲酸)=8∶1∶0.2的溶液为展开剂,狭缝尺寸为3 mm×0.45 mm,检测波长为335 nm,采用薄层荧光扫描法测定花生根中白藜芦醇的含量.结果表明:白藜芦醇在21.6~108.0 ng范围内线性关系良好,回归方程为 Y=-664.701+12.666X,R=0.996 9,花生根中白藜芦醇的含量为358.89μg/g.
薄层荧光扫描法;白藜芦醇;花生根
白藜芦醇(resveratrol)是一种具有生物活性的多酚类化合物,其化学名称为3,4′,5-三羟基二苯乙烯.目前至少已经在21科31属72种植物中发现了白藜芦醇的存在,如豆科的落花生属、葡萄科的葡萄属,决明属、百合科的藜芦属、槐属[1]等.由于它具有抗氧化,抑制癌细胞增殖,抑制血小板活性,消炎等多种药理活性[2-4],因此被广泛应用于医药、食品、化妆品等行业.
目前,开发利用富含白藜芦醇的保健植物愈来愈受到人们的关注,有关从葡萄皮、虎杖中提取白藜芦醇的研究已有大量的文献报道[5-7],而花生根中白藜芦醇的研究报道较少,而且主要集中于用 HPLC法测定白藜芦醇的含量[8-10].花生根为花生的不可食部分,如能充分利用,既可以提高花生种植的附加值,又可避免环境污染,对农产品资源开发与利用将有重要的意义.作者用薄层荧光扫描法对花生根中白藜芦醇的含量进行了测定,为综合利用提供参考.
1 实验部分
1.1 仪器与材料
970CRT荧光分光光度计(上海精密科学仪器有限公司),CAMAG TLC SANNER 3型薄层扫描仪(瑞士),CAMAG LINOMAT5半自动点样仪(瑞士),铝箔板(德国,20 mm×20 mm×5 mm),白藜芦醇对照品(购自中科院昆明植物所植化室),其他试剂均为分析纯.将花生根(采自河南开封近郊)洗净、晾干、粉碎后,备用.
1.2 色谱及扫描条件
展开剂:V(氯仿)∶V(丙酮)∶V(甲酸)=8∶1∶0.2;上行展开,展距5 cm;单光束反射式荧光线性扫描,激发波长335 nm;狭缝尺寸3 mm×0.45 mm,滤光片 K400;扫描速度20 mm·s-1.
2 结果与讨论
2.1 对照品溶液的制备
精密称取白藜芦醇对照品适量,用乙酸乙酯溶解,定容至25 mL容量瓶中,配制成浓度为0.108 0 g/L的对照品溶液备用.
2.2 样品溶液的制备
取花生根粗粉3 g,精密称定,置于索氏提取器中,用90 mL 95%的甲醇冷浸,分三次加入,冷浸24 h后索氏提取3 h,水浴温度75℃.提取液旋转蒸至醇干.加入等体积石油醚萃取三次,萃余液用等体积乙酸乙酯萃取三次,收集有机相,旋转蒸干.用乙酸乙酯溶解,转移至10 mL容量瓶中定容,待测.
2.3 标准曲线的考察
用半自动点样仪对白藜芦醇对照品溶液进行点样,点样量分别为0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0μL,点于同一块硅胶 G铝箔板上进行检测,以白藜芦醇峰面积(Y)为纵坐标,进样体积(X)为横坐标,绘制标准曲线,回归方程为:Y=-664.701+12.666X,R=0.996 9;在21.6 ng~108.0 ng范围内线性关系良好.
2.4 样品含量测定
精密称取等量的花生根粗粉(3份),按照2.2项制备样品溶液,在1.2项中的色谱和扫描条件下进行测定,测得样品含量平均值为358.89μg/g,RSD为1.49%.测定结果见表1.
2.5 精密度试验
精密吸取5份0.3μL的对照品溶液,分别点于同一块硅胶 G铝箔板上,展开,扫描,测得峰面积值分别为3 622.57,3 682.60,3 529.69,3 524.13,3 816.76.平均值为3 635.15,RSD为3.34%.
2.6 重现性试验
取2.4项中样品2,分别吸取0.3μL在同一块硅胶 G铝箔板上点 5个点,扫描,测得峰面积值分别为4 958.45,
4 817.56,4 818.45,5 120.46,4 996.81,平均值为4 942.35,RSD为2.60%.
2.7 稳定性试验
取上述样品2,放置5 h、10 h、15 h和24 h后分别进行测定,测得样品中白藜芦醇含量分别为363.98,363.69,359.77,359.44,359.34μg/g,平均值为361.24μg/g,RSD为0.66%.可知样品在冰箱内(6℃)存放24 h后白藜芦醇含量基本稳定.
2.8 回收率试验
取2.4项中样品溶液5.0 mL,加入0.108 0 g/L的对照品溶液0.5 mL,用乙酸乙酯溶解,并定容至10 mL容量瓶中,在1.2项中的色谱和扫描条件下测定,回收率分别为103.86%,105.08%,105.52%,平均回收率为104.82%,RSD=0.80%(n=3).
2.9 荧光激发波长的选择
白藜芦醇在366 nm的紫外光照射下能产生荧光,但这并不是最佳的荧光激发波长.通过荧光分光光度计的检测得知,最佳激发波长为335 nm,荧光发射波长为375 nm,本试验中的荧光为Stokes荧光.
71.
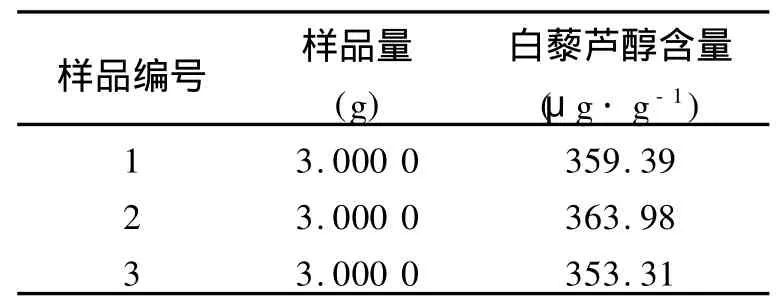
表1 样品含量测定结果(n=3)Table 1 Results of sample determination
[32]林英光,杨卓如,程江.纳米掺锶羟基磷灰石的制备及其抗菌性能研究[J].化工新型材料,2007,35(3):20-24.
[33]Kim T N,Feng Q L,Kim J O,et al.Antimicrobial effects of metal ions(Ag+,Cu2+,Zn+)in hydroxyapatite[J].J Mater Sci:Mater Med,1998(9):129-134.
[34]Ahn E,Gleason N,Nakahira A,et al.Nanostructure processing of hydroxyapatite-based bioceramics[J].N ano Lett,2001,1(3):149-153.
[35]Li L,Liu Y,Tao J,et al.Surface modification of hydroxyapatite nanocrystallite by a small amount of terbium provides a biocompatible fluorescent probe[J].J Phys Chem C,2008,112(32):12219-12224.
[36]邓霞,陈治清,钱志勇,等.纳米羟基磷灰石/脂肪族聚酯酰胺复合材料[J].生物医学工程学杂志,2008,25(2):378-381.
[37]曹惠,陈新,邵正中.羟基磷灰石/丝素蛋白复合纤维的制备及其矿化研究[J].化学学报,2008,66(18):2059-2064.
[38]Chen F,Wang Z C,Lin C J.Preparation and characterization of nano-sized hydroxyapatite particles and hydroxyapatite/chitosan nano-composite for use in biomedical materials[J].Mater Lett,2002,57(4):858-861.
[39]Li B,Hu Q,Qian X,et al.Bioabsorbable chitosan/hydroxyapatite composite rod prepared by in-situ precipitation for internal fixation of bone fracture[J].Acta Polymerica Sinica,2002(6):828-833.
[40]Nukavarapu S,Kumbar S,Brown J,et al.Polyphosphazene/nano-hydroxyapatite composite microsphere scaffolds for bone tissue engineering[J].Biomacromolecules,2008,9:1818-1825.
[41]Sundaram C S,Viswanathan N,Meenakshi S.Uptake of fluoride by nano-hydroxyapatite/chitosan,a bioinorganic composite[J].Biores Technol,2008,99:8226-8230.
[42]Reverchon E,Pisanti P,Cardea S.Nanostructured PLLA-hydroxyapatite scaffolds produced by a supercritical assisted technique[J].Ind Eng Chem Res,2009,48:5310-5316.
[43]Wen J,Li Y,Zuo Y,et al.Preparation and characterization of nano-hydroxyapatite/silicone rubber composite[J].Mater Lett,2008,62:3307-3309.
Determination of Resveratrol in Peanut Root by Thin Layer Chromatography Fluorescence Scanning
The content of resveratrol was determined by thin layer chromatography fluorescence scanning on silica-gel G aluminium foil plate.The developing solvent was composed by chloroform,acetone and formic acid(8∶1∶0.2).The slit size was 3 mm×0.45 mm and the detection wavelength was 335 nm.The results showed that the calibration curves were linear in the range of 21.6~108.0 ng(R=0.996 9),and the content of resveratrol in peanut root was 358.89 μg/g.
thin layer chromatography fluorescence scanning;resveratrol;peanut root
O 652.63
A
1008-1011(2010)05-0088-02
2010-05-20.
韩小丽(1982-)女,硕士生,研究方向:天然产物及中草药化学.*
.

