东北鹤虱水提取物对小鼠脾淋巴细胞体外增殖、分泌IL-2和TNF-α的作用
于 跃,杨 柳,郭秀英,高建华,孟 林
(天津医科大学药理学教研室,天津 300070)
东北鹤虱 (Lappula Echinata Gilib,LEG)为紫草科一年生草本植物东北鹤虱果实,盛产于我国华北、东北等地区。其性味苦、辛、平,入脾、胃、肝三经,具有驱虫、抗炎、抗腹泻的作用,可治疗虫积腹痛[1]。民间用其果实或全草水煎治疗各种腹泻,尤其对慢性腹泻、老年性腹泻、某些疾病如糖尿病、肿瘤等伴发的腹泻有明显作用。已有研究证明其水提取物具有抗炎[2]、缓解平滑肌痉挛[3]、调节胃肠水平衡[4]等作用,但未见LEG-I对机体免疫系统作用的报道。本文通过观察脾淋巴细胞增殖、细胞周期变化、细胞因子IL-2和TNF-α分泌,探讨LEG-I对机体免疫功能的影响。
1 材料与方法
1.1 材料
1.1.1 药物 LEG,产地为我国黑龙江省,种子类药材,呈卵形,长约3~3.5mm,由黑龙江中医药大学药学院药用植物学教研室于嘉彬教授鉴定。取干燥的LEG,粉碎至20目,水煎煮,过滤除药渣后合并药液,以水提醇沉法及Sevag法收集并除蛋白,所得提取物过滤,经减压旋蒸,透析,最后冷冻干燥,得到粉末状淡黄色提取物LEG-I,-20℃保存。临用前LEG-I用PBS缓冲液配制成1mg/ml储备液,0.22 μm微孔滤膜过滤除菌,可4℃保存,实验中再以PBS缓冲液稀释成所需浓度。
1.1.2 试剂 ConAⅣ型,美国Sigma公司;四甲基偶氮唑盐(Methyl thiazolyl tetrazole,MTT),瑞士 Fluka公司;二甲基亚砜(Dimethylsulfoxide,DMSO),美国Amresco公司;Mouse IL-2测定试剂盒,晶美生物工程有限公司,生产批号20071125;碘化丙啶染料,美国Sigma公司;核糖核酸酶A(Ribonuclease A,RNaseA),美国 Sigma 公司;胰蛋白酶,Gibco,批号:200706321;放线菌素D,美国Sigma公司。
1.1.3 实验动物及细胞 近交系清洁级BALB/C小鼠,体重(20±0.25)g,4~5 周龄,雌雄不拘,购自中国医学科学院放射医学研究所(批准文号:SCXK津2005-0001)。L929细胞株由天津医科大学药学院惠赠,常规复苏传代,应用时调整至所需浓度。
1.1.4 仪器 Model680型酶标仪(Bio-Rad);Epics-XL型流式细胞仪(美国Beckman Coulter公司)。
1.2 方法
1.2.1 对小鼠脾淋巴细胞增殖的影响 取BALB/C小鼠1只,无菌条件下常规方法制备脾细胞悬液。台盼蓝测定细胞存活率为90%以上,细胞计数,RPMI-1640培养基调整细胞浓度为2×106/m l。取悬液加入96孔细胞培养板中,每孔160μl。实验分为对照组(每孔加入20μl RPMI-1640培养液)、药物单独刺激组(每孔加入20μl LEG-I,其终浓度为3.125~100μg/ml)、ConA单独刺激组(每孔加入 20μl ConA,使其终浓度为5μg/ml)以及药物协同ConA刺激组(每孔加入20μl LEG-I,其终浓度为0.781~100μg/ml和 20μl ConA,其终浓度为 5μg/ml),各孔用RPMI-1640培养液补足体积至200μl。每组每浓度做6复孔。于37℃,5%CO2孵箱中培养68 h,取出培养板每孔加20μl5mg/ml的MTT溶液,放于孵箱中继续培养4 h,取出后将孔板离心1 500 r/min 15min,小心吸弃上清,每孔加入100μlDMSO,振荡5min,于酶标仪上测OD570nm值,并计算淋巴细胞转化刺激指数 (stimulation index,SI),SI=实验孔OD570nm值/对照孔OD570nm值。
1.2.2 对小鼠脾淋巴细胞周期分布的影响 按上述方法制备小鼠脾淋巴细胞,调整细胞浓度为2×106/ml,细胞加入 24 孔板中,每孔 0.8ml,空白组补加RPMI-1640培养液0.2ml,实验组加入不同浓度的 LEG-I0.2ml使其终浓度为(100 μg/m l),ConA组加入0.2mlConA使其终浓度为5μg/m l,于37℃,5%CO2孵箱中培养48 h,收获细胞至离心管内。将收集细胞离心1 000 r/min,5min,弃去上清,冷PBS洗细胞两次,离心1 000 r/min,5min。70%乙醇4℃固定过夜,上机前,离心收集细胞,并用PBS洗细胞,弃上清,加入500μlRNaseA(终浓度为100μl/m l),37 ℃作用30min,再加入50μl/ml碘化丙啶染液500μl室温避光染色30min,吹散细胞后用300目尼龙滤膜过滤,然后以流式细胞仪分析细胞周期,每个样品收集10 000个细胞的参数,分析结果以处于G0/G1期、S期、G2/M期细胞的百分率表示,根据公式PI=(S+G2/M)/(G0/G1+S+G2/M)×100%计算增殖指数(proliferation index,PI)。
1.2.3 对小鼠脾淋巴细胞分泌TNF-α的影响 无菌收集小鼠脾淋巴细胞悬液,调整细胞浓度至2×106/ml,于96孔板中,每孔加入160μl细胞悬液,药物单独刺激组加入20μl不同浓度LEG-I(25、50、100μg/ml),ConA协同刺激组每孔除加入上述不同浓度的LEG-I外,各孔还需加入20μlConA(终浓度为5μg/ml),阳性对照组加入终浓度为5μg/ml的ConA 20μl,空白组加入20μlRPMI-1640培养液,各孔加入RPMI-1640液补足体积至200μl。每组平行作6孔重复。于37℃,5%CO2孵箱中培养48 h,1 500 r/min离心10min,收集上清,-20℃冻存。0.25%胰蛋白酶消化对数生长期的TNF敏感的鼠成纤维细胞系L929细胞2min后,加入RPMI-1640完全培养基终止消化,收集细胞,用RPMI-1640培养液洗两次,调整细胞浓度为1×105/ml,加入96孔板中(每孔100μl),孵箱过夜。弃上清,加入脾细胞培养上清100μl和20μl放线菌素D(终浓度为1mg/L),培养20 h。于倒置显微镜下,观察细胞杀伤情况。以MTT法测定杀伤细胞的细胞毒活力。
1.2.4 对小鼠脾淋巴细胞分泌IL-2的影响 脾淋巴细胞悬液制备及分组方法同上,各实验组给药浓度分别为 6.25、25、100 μg/m l。细胞于 37 ℃,5%CO2孵箱中培养48 h,1 500 r/min离心10min,收集上清,-20℃冻存。标本中IL-2含量测定按试剂盒说明书步骤进行。结果判断:每个标准品和标本的OD值应减去零孔的OD值。以标准品浓度作横坐标,OD450nm值作纵坐标,应用统计软件SPSS15.0绘制标准曲线,据曲线函数值计算个标本的浓度值。
1.3 统计学方法 实验数据应用SPSS15.0统计软件进行处理,结果均以表示。多样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(ONEWAY ANOVA),方差齐者采用LSD法检验,方差不齐采用Dunnett’s T3法检验。
2 结果
2.1 对小鼠脾淋巴细胞增殖的影响 在脾细胞培养液中加入不同浓度的LEG-I作用72 h后,LEG-I在体外有直接激活静止小鼠脾细胞增殖的作用,其OD570nm和SI值明显高于空白对照组,差异具有统计学意义。LEG-I在剂量为3.125~100μg/ml范围内表现为丝裂原特性,并且有剂量依赖关系,其中100μg/ml LEG-I作用于静止小鼠脾淋巴细胞后,其刺激指数SI值与ConA组相当,淋巴细胞增殖率约为83.3%。见表1。
表1 LEG-I对静止小鼠脾淋巴细胞体外增殖的影响(,n=6)

表1 LEG-I对静止小鼠脾淋巴细胞体外增殖的影响(,n=6)
与空白对照组相比*P<0.05,**P<0.01;与ConA单独刺激组相比,#P<0.01
OD570nm 0.215±0.002 0.413±0.012**0.223±0.004*#0.262±0.007**#0.300±0.004**#0.310±0.005**#0.335±0.006**#0.394±0.018**浓度 (μg/m l)5.000 3.125 6.250 12.500 25.000 50.000 100.000 SI 1.000±0.012 1.919±0.055**1.037±0.017*#1.220±0.034**#1.395±0.022**#1.440±0.024**#1.559±0.028**#1.833±0.081**组别空白对照组ConA单独刺激组LEG-I单独刺激组
表2显示,不同浓度LEG-I对ConA诱导的小鼠脾淋巴细胞转化反应具有明显的促进作用,与ConA组相比,其OD570nm和SI值明显升高,差异有统计学意义。其中100μg/ml LEG-I作用于活化的小鼠脾淋巴细胞后,淋巴细胞增殖率约为276.4%。说明LEG-I与ConA具有协同刺激作用。
表2 LEG-I对被ConA诱导的小鼠脾淋巴细胞体外增殖的影响(,n=6)

表2 LEG-I对被ConA诱导的小鼠脾淋巴细胞体外增殖的影响(,n=6)
与空白对照组相比*P<0.01;与ConA单独刺激组相比#P<0.05,##P<0.01
组别空白对照组ConA单独刺激组LEG-I协同ConA OD570nm 0.219±0.011 0.467±0.024*0.524±0.016*#0.532±0.007*#0.539±0.005*#0.575±0.029*##0.713±0.044*##0.722±0.042*##0.732±0.025*##0.826±0.035*##浓度 (μg/m l)5.000 0.781 1.562 3.125 6.250 12.500 25.000 50.000 100.000 SI 1.000±0.053 2.131±0.110*2.388±0.072*#2.429±0.033*#2.455±0.024*#2.620±0.134*##3.251±0.199*##3.291±0.193*##3.339±0.114*##3.764±0.162*##
2.2 对小鼠脾淋巴细胞周期分布的影响 未刺激的对照组淋巴细胞多处于G0/G1期,其增殖指数PI为14.60%,经ConA刺激48 h后,与对照组相比,G0/G1期细胞数减少,分裂期的细胞明显增加,增殖指数PI为28.90%,明显高于对照组(图1);经LEG-I作用48 h后,进入S期和G2/M期的小鼠脾淋巴细胞分别为16.00%和7.90%,增殖指数(23.90%)高于空白对照组。说明LEG-I可促进淋巴细胞DNA的合成,使细胞进入分裂期。
2.3 对小鼠脾淋巴细胞分泌TNF-α的影响 L929细胞是一类对TNF-α敏感的细胞株,L929细胞抑制率越高,表明小鼠脾淋巴细胞分泌TNF-α量越多。单独给与LEG-I后,与对照组相比,25、50及100μg/ml LEG-I均不能增加对L929细胞抑制率(P>0.05)(图2),说明3组不同剂量LEG-I均不能有效促进小鼠脾淋巴细胞产生TNF-α。

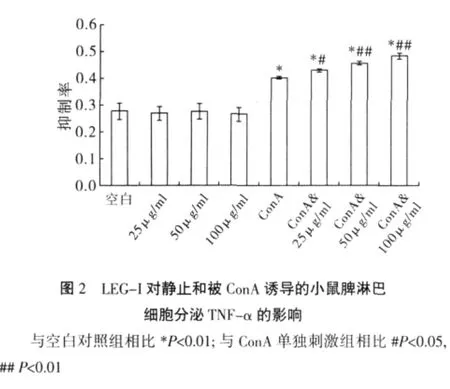
LEG-I与ConA协同刺激后,与ConA组相比,3组不同剂量LEG-I均可增加L929细胞抑制率,如图3A可以看出,100μg/ml LEG-I与ConA协同刺激小鼠脾淋巴细胞48 h,其上清液作用于L929细胞20 h后,倒置显微镜下观察细胞体积缩小,胞浆浓缩,折光性差。而空白组(如图3B)L929细胞呈多角形生长,胞质均匀,折光性强。这一结果表明,LEG-I可增加ConA诱导的小鼠脾淋巴细胞TNF-α分泌,并且具有一定的剂量依赖性。

2.4 对小鼠脾淋巴细胞分泌IL-2的影响 表3显示,小鼠脾淋巴细胞可自发性分泌一定量水平的IL-2,加入不同浓度LEG-I后,对静止的小鼠脾细胞上清中IL-2的分泌无明显增加作用,与空白对照组相比无统计学差异(P>0.05)。经过ConA刺激后,小鼠脾细胞分泌IL-2明显升高,与空白对照组相比,有显著性差异。3个剂量组LEG-I均可提高ConA诱导的小鼠脾淋巴细胞IL-2分泌水平,与ConA组相比,其增长率分别为3.39%、22.75%、34.42%。并且在6.25~100μg/ml范围内,其刺激作用具有浓度依赖性,随LEG-I浓度升高,IL-2分泌水平提高。
回归方程:(A vsC)C=422.37×A-84.731,r=0.995 5
表3 LEG-I对静止和ConA诱导的小鼠脾淋巴细胞分泌IL-2的影响( ,n=6)

表3 LEG-I对静止和ConA诱导的小鼠脾淋巴细胞分泌IL-2的影响( ,n=6)
与空白对照组相比*P<0.01;与ConA单独刺激组相比#P<0.05,##P<0.01
IL-2(pg/m l)23.28±3.26 175.16±6.54*26.17±4.21 25.88±4.21 26.83±3.07 181.10±1.37*#215.01±6.30*##235.45±3.24*##浓度(μg/ml)5.00 6.25 25.00 100.00 6.25 25.00 100.00组别空白对照组ConA单独刺激组LEG-I单独刺激组LEG-I+ConA协同组
3 讨论
本实验研究了LEG-I对小鼠脾淋巴细胞增殖及对TNF-α和IL-2分泌的影响。实验中,LEG-I可有效刺激小鼠脾淋巴细胞增殖,在3.125~100μg/ml浓度范围内呈剂量依赖效应。由此提示,LEG-I可能是淋巴细胞的致有丝分裂原或具有丝裂原样作用,可直接启动淋巴细胞表面受体活化,促进脾淋巴细胞增殖,提高机体的免疫能力。ConA是常用的诱导T细胞发生增殖的有丝分裂原[5],LEG-I能增强淋巴细胞对刺激物ConA的反应性,在0.781~100μg/ml剂量范围内具有剂量依赖关系,说明LEG-I与有丝分裂原具有协同刺激脾淋巴细胞增殖作用。
正常小鼠淋巴细胞在未接受抗原刺激时多处于G0期[6],给药组小鼠脾淋巴细胞较空白组G0/G1期细胞比例降低,而S期和G2/M期细胞比例增加,提示LEG-I主要作用于小鼠脾淋巴细胞细胞周期的S期和M期,促进淋巴细胞DNA合成,使细胞从G0/G1期进入S期,通过调节细胞周期诱导小鼠脾淋巴细胞进入分裂增殖期。
正常小鼠脾淋巴细胞可分泌一定生理水平的TNF-α,LEG-I对正常小鼠脾淋巴细胞TNF-α的产生几乎无影响,但可增加脾细胞在ConA刺激后产生TNF-α的量,生成的TNF-α可能参与巨噬细胞活化,诱生多种免疫调节介质,如IL-1、IL-6、CSF等,刺激T细胞增殖,增强NK活性,调节B细胞分化、增殖等[7-8]。LEG-I有可能通过上述途径实现其免疫调节作用。
类似的结果也出现于此,LEG-I对静止期淋巴细胞IL-2分泌无调节作用,却显著增加ConA诱导的小鼠脾淋巴细胞IL-2分泌水平,在6.25~100μg/ml剂量范围内呈剂量依赖性。IL-2是T淋巴细胞的自分泌或旁分泌生长因子,可作用于自身或邻近T细胞表面的IL-2受体,诱导淋巴细胞增殖活化,活化的T淋巴细胞可进一步提高机体IL-2水平,形成正反馈效应,从而增强细胞免疫应答,提高机体免疫能力。故LEG-I增强小鼠T淋巴细胞转化功能,推测可能与其促进IL-2产生有关。
综上,LEG-I能促进静息状态及ConA诱导的小鼠脾淋巴细胞增殖,促进淋巴细胞DNA合成,使细胞进入分裂增殖期,促进ConA活化小鼠脾淋巴细胞TNF-α及IL-2分泌,表明LEG-I具有免疫激活或免疫增强作用。
[1]冉先德.中华药海[M].哈尔滨:哈尔滨出版社,1987:1062-1064
[2]张卉,高建华,孟林.东北鹤虱胶囊的抗炎、镇痛、抗菌作用实验研究[J].天津医科大学学报,2004,10(4):492
[3]郭秀英,于跃,孟林,等.东北鹤虱提取物抗腹泻作用机制的探讨[J].天津医科大学学报,2009,15(1):11
[4]高卫真,高建华,窦淑兰,等.东北鹤虱胶囊制剂的药效学研究[J].中国中医结合外科杂志,2005,11(4):347
[5]Brubaker JO,LiQ,Tzianabos AO,etal.Mitogenic activity of purified capsularpolysaccharide A from bacteroides fragilis:differential stimulatory effectonmouse and rat lymphocytes in vitro[J].J Immunol,1999,162(4):2235
[6]ChechlinskaM,Siwicki JK,GosM,etal.Molecular signatureof cell cycle exit induced in human T lymphoblastsby IL-2withdrawal[J].BMCGenomics,2009,10(8):261
[7]Shimizu Y,Inoue E,Ito C.Effectof thewater-soluble and non-dialyzable fraction isolated from Senso(Chan Su)on lymphocyte proliferation and natural killer activity in C3H mice[J].Biol Pharm Bull,2004,27(2):256
[8]Jayaraman T,PagetA,Shin YS,etal.TNF-alpha-mediated inflammation in cere-bral aneurysms:a potential link to growth and rupture[J].Vasc Health Risk Manag,2008,4(4):805

