基于卟啉-联吡啶的铜离子荧光化学传感器及其应用研究
林伟琦
(厦门市产品质量监督检验院,福建厦门361004)
0 引言
铜是人体不可缺少的微量元素,存在于所有器官和组织中,通常与蛋白质或其它有机物结合,在许多生理过程起着重要的作用,如血红素的合成、结缔组织的生长、氧化磷酸化作用等[1~2]。然而,当其浓度过大时,也会引起胆汁排泄铜的功能紊乱,慢性活动性肝炎,帕金森综合症,肾小管中毒等。因此,探索铜离子的新分析方法特别是痕量分析方法已引起现代分析化学工作者愈来愈多的注意。
近年来,利用光纤技术来构建Cu2+的光化学传感器已经引起了人们越来越广泛的关注[3~6],与传统的Cu2+检测方法相比,光化学传感器具有尺寸小、成本低、不需要基准物质、且信号输出不受电磁场影响等诸多优点。大多数光纤传感器信号输出都是基于固定于不同基质中的敏感物质的吸收或反射信号,尽管荧光信号在灵敏度上优于吸收和反射信号,但是基于荧光测量的Cu2+的光纤传感器的报道还很少[7~8]。荧光传感器的敏感物质通常包括两个部分:荧光基团(控制信号输出)和离子识别基团(选择性的识别金属离子),两部分通过化学键连接起来。由于这两部分之间的光致电子或能量转移[9~10],当识别基团与某种离子选择性络合,络合作用将诱导荧光基团的荧光性质发生变化。
寻找对Cu2+具有高选择性响应的荧光传感器对分析工作者仍是一个非常活跃的研究领域[11~13]。卟啉是一类在自然界普遍存在的大环类化合物,在生命体的新陈代谢过程中起着非常重要的作用。同时卟啉具有非常好的光化学特性,大的Stokes位移,相对长的激发(>400 nm)和发射(>600 nm)波长,能将背景荧光的影响降到最小。这些优点使得卟啉成为设计新的荧光分子传感器的潜在荧光基团。该文选择了卟啉枝接联吡啶的化合物(H2Pbpy)作为Cu2+的光纤传感器的敏感物质。其中卟啉作为荧光基团,联吡啶作为识别基团。联吡啶与Cu2+络合以后,卟啉激发态电子可以通过联吡啶转移给Cu2+,从而猝灭卟啉的荧光,这为Cu2+荧光传感器的构建提供了理论基础。 实验结果表明, 在 pH(6.0~8.0),Cu2+浓度在2.0×10-8~1.0×10-5mol/L 之间,荧光强度变化的对数与离子浓度的对数呈线性关系。利用该方法对碳酸饮料中的Cu2+进行测定。
1 实验
1.1 试剂
聚氯乙烯(PVC)、癸二酸二辛酯(DOS)、CuCl2购自上海化学试剂公司。四氢呋喃(THF)以二苯甲酮为指示剂,在氩气保护加钠蒸馏除水得到。若没有特别指出,其它试剂均为分析纯且无须进一步纯化。实验用水均为二次蒸馏水。系列的 Cu2+标准溶液由1.0×10-2mol/L 的 Cu2+溶液经 NaOAc-HOAc(pH为 6.22)缓冲溶液逐步稀释得到。按照文献方法合成H2Pbpy(结构见图1)。
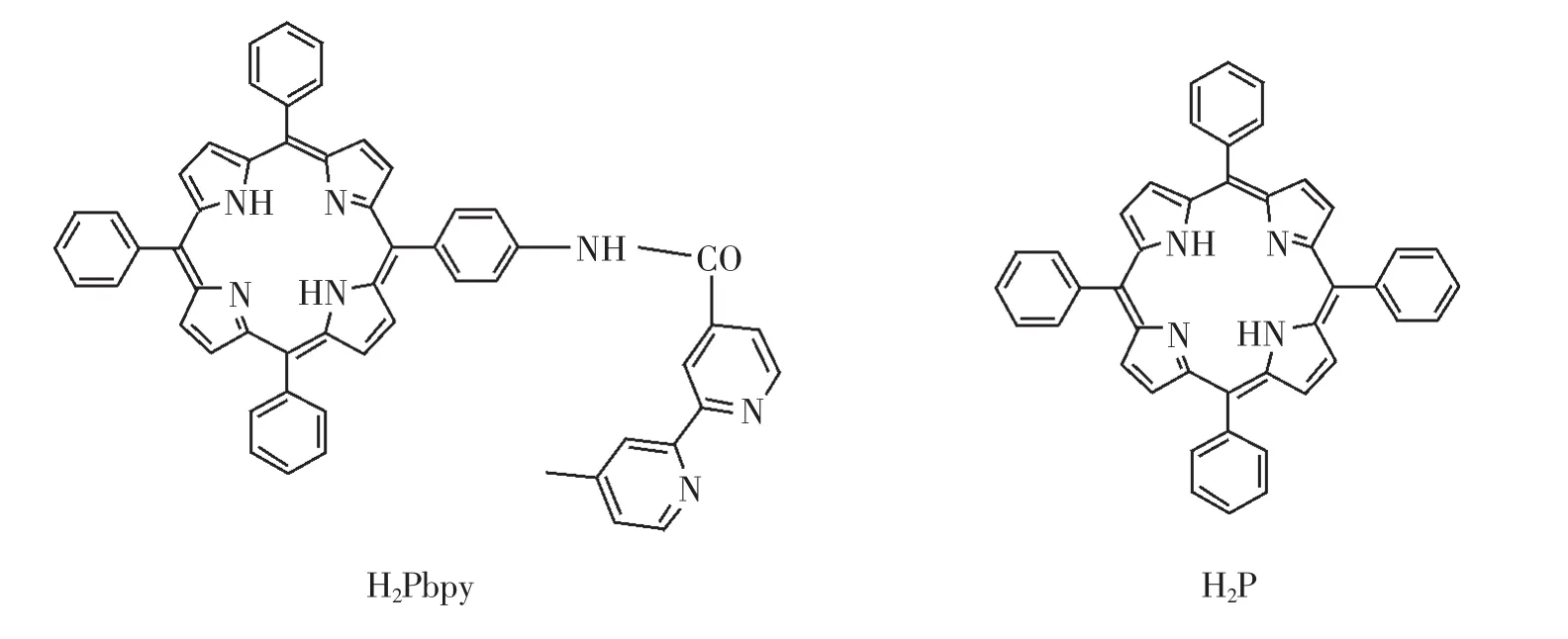
图1 H2Pbpy和H2P的结构式Fig.1 Structures of porphyrin derivatives and meso-tetraphenylporphyrin
1.2 仪器
所有荧光测量均在F4600荧光光谱仪(HITACHI)完成,激发和发射狭缝分别为5.0 nm和10.0 nm。紫外吸收光谱在UV-2450(SHIMADZU)完成。使用一个自制的聚四氟乙烯的流通池和一双臂光纤(30+30石英光纤,直径6 mm,长1 m)[14]用于Cu2+测量。激发光通过光纤的一臂进入流通池,而发射光从另一臂进入检测器。将涂有敏感膜的石英玻璃片(直径10 mm)放入一个带固定螺丝的流通池,并保持敏感膜与溶液接触。样品由蠕动泵(浙江国康仪器公司)输入流通池。溶液pH值用Mettler-Toledo Delta 320 pH计测量。
1.3 光极膜的制备
将 1.5 mg H2Pbpy,50 mg PVC 和 100 mg 增塑剂溶于2 mL新蒸馏的THF中制成光极膜溶液。为提高膜的粘附,对石英玻璃片(直径10 mm,厚1 mm)进行了活化,先用浓HNO3浸泡12 h,然后用3%的HF和10%的H2O2浸泡30 min,后用蒸馏水和乙醇洗净晾干。滴加0.1 mL光极膜溶液于旋转的玻璃片上(600 r/min),使之形成敏感光极膜。放置过夜蒸发除去THF,形成了一层很薄的聚合物敏感膜附着在玻璃片上。
1.4 测量过程
将光纤接到光谱仪的检测池上,使其传输激发光和发射光。测量时激发光波长固定在423 nm。样品溶液以0.8 mL/min的速度输入流通池的检测室。每次测量后,依次用0.3 mol/L的EDTA溶液(pH9)和缓冲溶液(0.1 mol/L NaOAc-HOAc,pH6.22)洗检测池,直至光极膜的荧光强度回到初始时。
1.5 吸收光谱的测定
为了研究响应机理,将 1.0×10-5mol/L H2Pbpy的乙醇溶液和等摩尔量的Cu2+的水溶液(pH6.22)在室温下混合。记录混合溶液的吸收光谱,并与H2P的乙醇溶液(1.0×10-5mol/L)与空白缓冲溶液(pH6.22)混合溶液的吸收光谱进行比较。
2 结果与讨论
2.1 敏感膜的荧光光谱
敏感膜在423 nm波长处激发,Cu2+的浓度变化引起敏感膜荧光光谱的变化见图2。荧光光谱记录λex为423 nm,在600~725 nm范围内荧光强度的变化。从图2可以看出敏感膜荧光发射波长在643 nm,随着Cu2+浓度的增加,敏感膜荧光强度逐渐下降,基于此设计出了Cu2+光纤传感器。
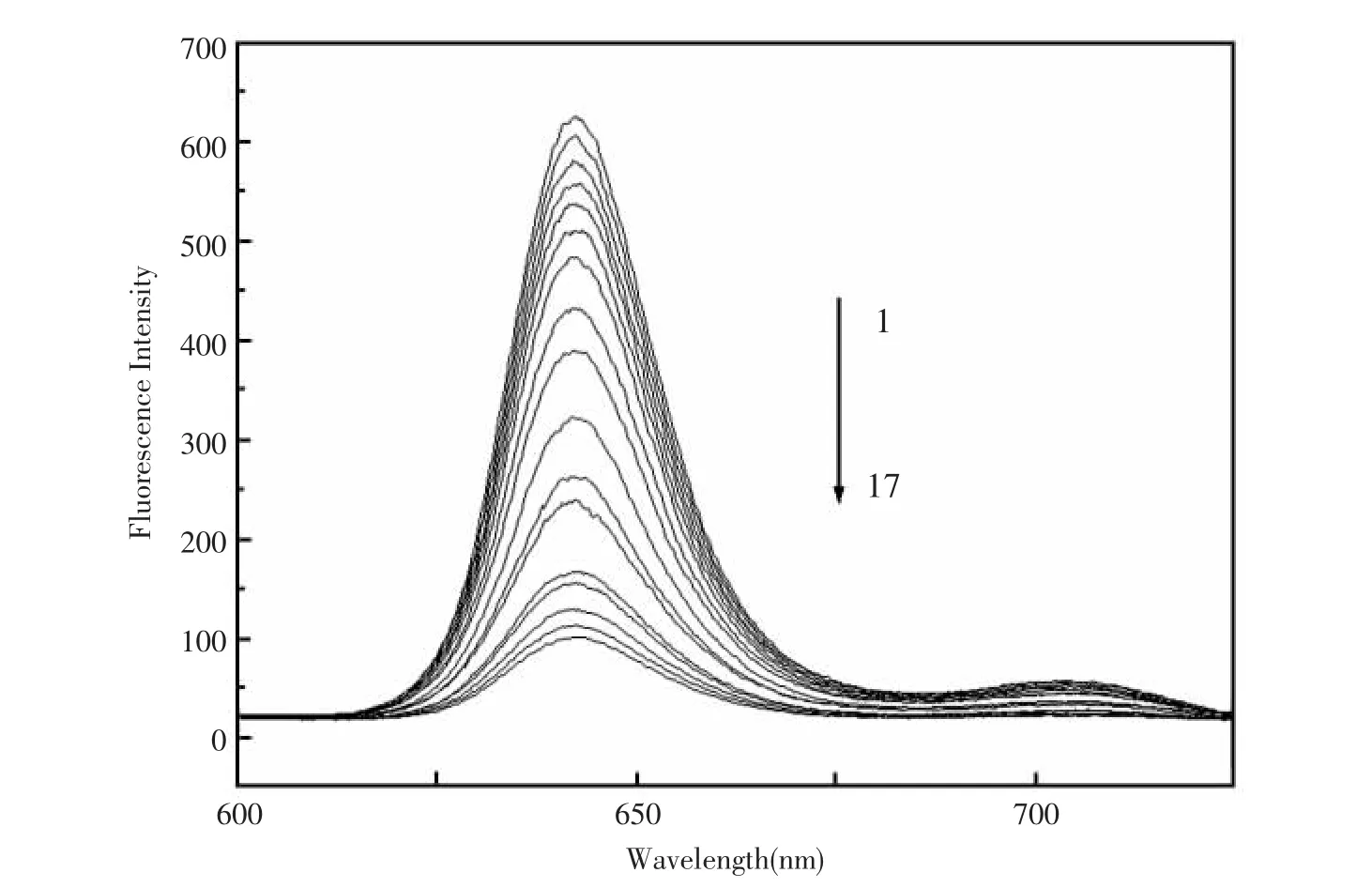
图2 不同Cu2+(mol/L)浓度下H2Pbpy敏感膜的荧光光谱(1)0;(2)1.0×10-8;(3)2.0×10-8;(4)3.2×10-8;(5)6.4×10-8;(6)1.0×10-7;(7)2.0×10-7;(8)3.2×10-7;(9)6.4×10-7;(10)1.0×10-6;(11)2.0×10-6;(12)3.2×10-6;(13)6.4×10-6;(14)1.0×10-5;(15)2.0×10-5;(16)3.2×10-5;(17)1.0×10-4(敏感膜组成:1%H2Pbpy,66%DOS and 33%PVC)Fig.2 Fluorescence emission spectra of the H2Pbpy sensing membrane in equilibrium with different concentrations of Cu2+
2.2 膜响应机理
Cu2+是一种顺磁性物质,能跟荧光物质作用发生光致能量转移或者是光致电子转移,猝灭荧光物质的荧光[15]。联吡啶络合Cu2+使卟啉发生光致电子转移而猝灭卟啉的荧光。为了研究光极膜响应机理,记录了H2Pbpy和H2P加入等摩尔Cu2+的吸收光谱变化(图3)。与四苯基卟啉的吸收光谱比较,H2Pbpy的Soret吸收由四苯基卟啉的409 nm红移至413 nm,这可能是由于联吡啶基团与卟啉基团之间有一定的作用造成的。加入等摩尔的Cu2+后,H2Pbpy的Soret吸收峰由413 nm蓝移至410 nm。吸收峰位移值的大小表明了荧光团和被螯合的Cu2+之间相互作用的强弱[14],位移值越大,作用越强。H2Pbpy的Soret吸收峰位移了3 nm,这是由于卟啉基团比较靠近识别基团。而H2P加入等摩尔Cu2+后,其吸收光谱几乎没有变化。说明卟啉没有跟Cu2+发生作用,这一点也可以由表1看出,H2P对Cu2+没有响应。因此,在当前实验条件下,卟啉基团只是作为报告基团,作为识别基团的是联吡啶部位。
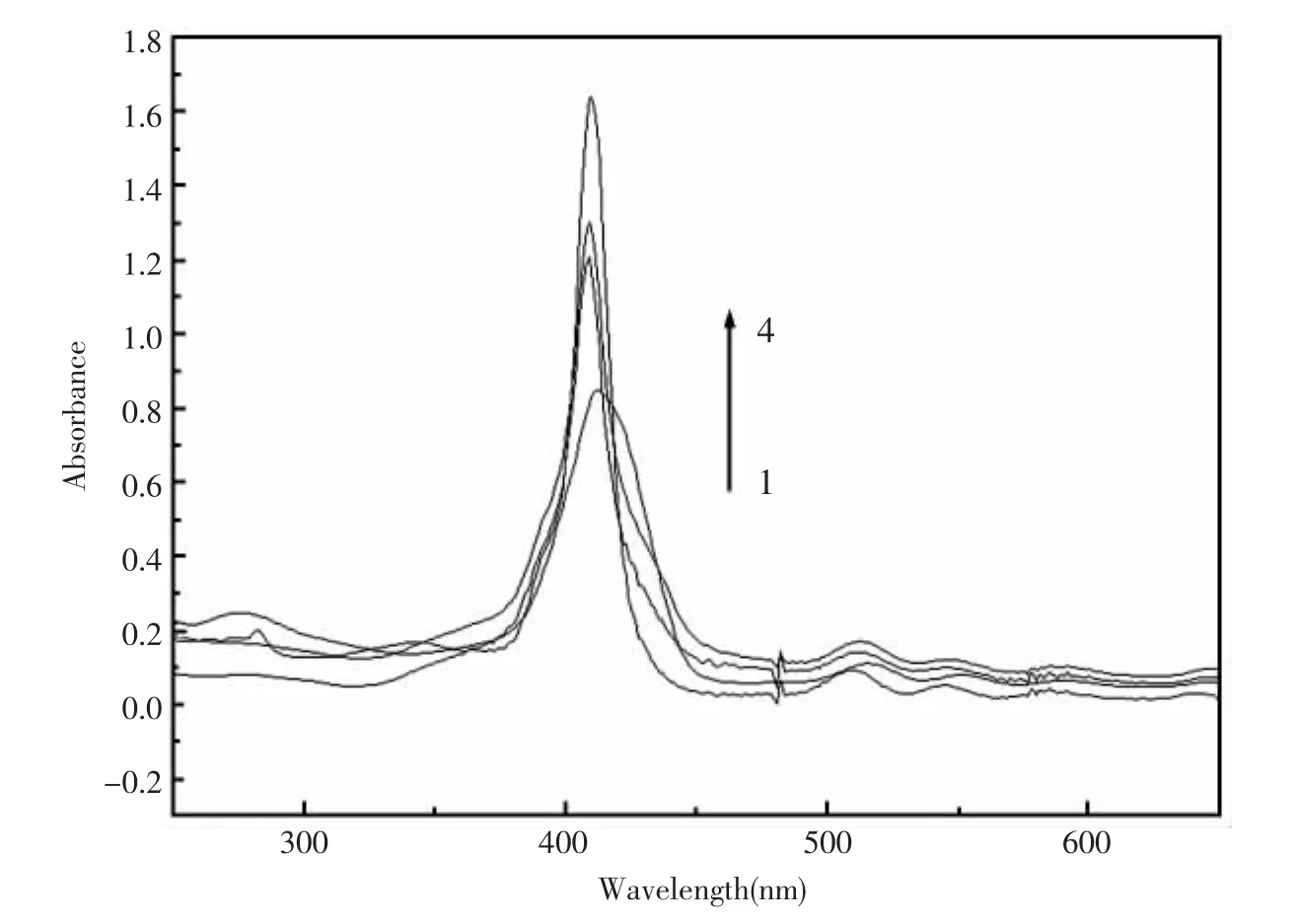
图3 加入等摩尔的 Cu2+,H2Pbpy(10 μmol/L)和 H2P(10 μmol/L)的吸收光谱变化(1)H2Pbpy吸收光谱;(2)加入等摩尔的Cu2+后H2P的吸收光谱;(3)H2P吸收光谱;(4)加入等摩尔的Cu2+后H2Pbpy的吸收光谱Fig.3 Changes in the UV-Vis spectra of H2Pbpy(10 μmol/L)and H2P(10 μmol/L)upon the addition of equivalent molar Cu2+
2.3 膜的优化
使用不同的敏感材料H2Pbpy和H2P与增塑剂DOS制成两种不同传感器,并考察这两种传感器性能,结果见表1。

表1 不同敏感膜对Cu2+的响应Tab.1 The effect of sensing materials on the response behavior of optodes
由表1可以看出,H2Pbpy为敏感材料的光极对Cu2+都有比较好的响应特性,而H2P的光极对Cu2+没什么响应。这是因为卟啉必须改变构像才能与Cu2+络合[16],速度很慢,而联吡啶是一个很好的Cu2+络合剂,速度非常快。因此,当PVC基质中只有卟啉存在时,不会对Cu2+产生响应。
考察了基质中敏感物质含量对传感器性能的影响。结果显示在表2中,发现其测量范围变化比较小,但是响应时间却是随着敏感材料浓度的降低而拉长,这可能是由于膜相中的敏感物质浓度过低,Cu2+需要花更多的时间才能接触到识别部位。膜层的敏感物质浓度太高将会引起荧光物质发生自猝灭现象,使得测量范围变差。结果表明含 1%H2Pbpy,66%DOS和 33%PVC的光极膜(光极5)对Cu2+有很好的响应。

表2 不同H2Pbpy含量的敏感膜对Cu2+的响应Tab.2 The effect of amount of H2Pbpy on the response behavior of optode
2.4 pH影响
固定 Cu2+浓度在 1.0×10-5mol/L,用 0.1 mol/L的HCl或NaOH溶液调节NaOAc-HOAc缓冲溶液到不同的pH下,测得H2Pbpy(λex=423 nm,λem=643 nm)的荧光强度并对pH作图(图4)。pH在6.0~8.0 范围内时,荧光猝灭效果最好,pH > 8 和pH<5.5时,猝灭效果都有些减弱。pH<5.5的酸性环境中,Cu2+不能完全与联吡啶络合。在pH为6.0~8.0 时,Cu2+很容易与联吡啶络合, 所以荧光猝灭作用最强。而当pH>8时,荧光猝灭效率减弱是因为Cu2+发生部分水解,联吡啶只能与未水解的Cu2+络合。因此,选择pH为6.22的NaOAc-HOAc(0.1 mol/L)缓冲溶液作为实验介质。
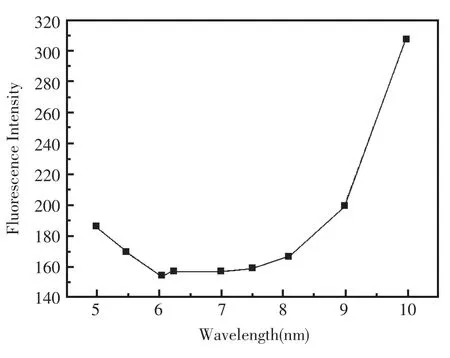
图4 不同pH下对Cu2+的响应(Cu2+浓度固定在1.0×10-5mol/L)Fig.4 Effect of pH on the determination of Cu2+with proposed optode(the concentration of Cu2+was fixed at 1.0×10-5mol/L)
2.5 光极膜的响应特性
依据修正的 Stern-Volmer方程[14],Cu2+浓度在 2.0×10-8~1.0×10-5mol/L 范围内时,log(ΔF/F)和log[Cu2+]呈良好的线性关系,方程为log(ΔF/F)=3.499+0.595 log[Cu2+], 相关系数为 0.998 04(n=12)。最低检测浓度5×10-9mol/l由空白值的标准差的三倍计算得到。Cu2+与H2Pbpy结合条件稳定常数为8.55×105由实验的荧光数据通过Stern-Volmer方程计算得到。Cu2+浓度低于 5.0×10-6mol/L时,传感器响应时间小于5 min。 光极膜的稳定性是通过连续测量 Cu2+浓度为5.0×10-6mol/L,10 h内记录24次而得到。荧光强度变化相对标准偏差为2.1%。每次测量后依次使用0.3 mol/L的EDTA(pH=9.00)和缓冲溶液冲洗检测池使光极膜荧光强度恢复到初始时。光极膜浸泡在二次蒸馏水中贮藏一个月,荧光强度没有明显的变化,这表明H2Pbpy在PVC膜中是非常稳定的。
2.6 选择性
继续考察了实验室常见的金属离子对Cu2+测定的干扰。 固定 Cu2+浓度在 5.0×10-6mol/L,加入干扰离子,记录加入前后荧光强度的变化。其结果见表3。大多碱金属和碱土金属离子浓度在小于1.0×10-2mol/L时对Cu2+测量没有明显的干扰。一些过渡金属离子浓度小于1.0×10-3mol/L时不会对Cu2+的测量产生干扰,只有Fe3+和Hg2+在浓度大于1.0×10-5mol/L时有轻微的干扰。
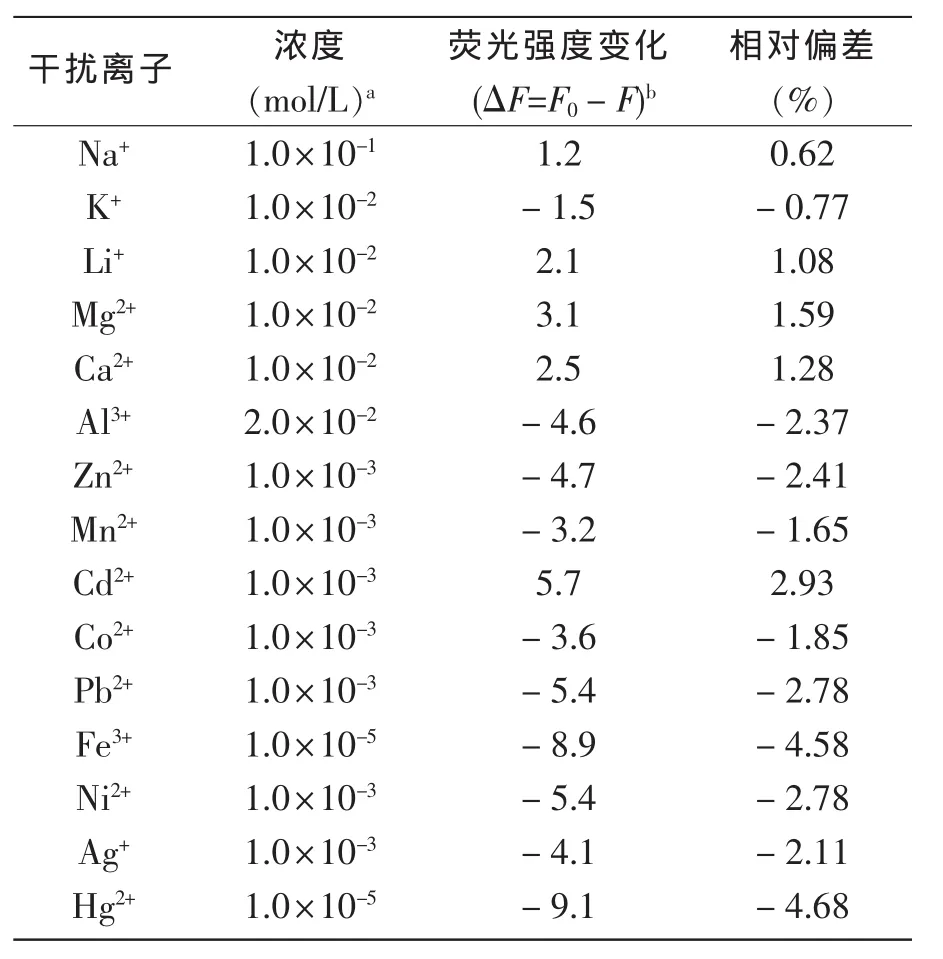
表3 其它离子对Cu2+测量的干扰Tab.3 Interference of different species with the fluorescence determination of Cu2+with the optode
2.7 碳酸饮料中微量铜的测定
取1 mL碳酸饮料到100 mL容量瓶中,用0.1 mol/L 的 NaOAc-HOAc(pH6.22)缓 冲溶液 准确定容到100 mL。结果与用原子吸收光谱法所测数据作比较,相对误差在5%内。实验结果(表4)表明该光纤传感器能够用于实际中测Cu2+。

表4 测定碳酸饮料中Cu2+Tab.4 Determination of Cu2+of carbonated beverage
3 结论
通过将卟啉衍生物(H2Pbpy)固定在PVC基质中制成Cu2+光纤传感器,该传感器在其它离子共存下对Cu2+有很高的选择性、且响应时间快,只有 Fe3+和 Hg2+在浓度大于1.0×10-5mol/L 时有轻微的干扰。传感器在pH为6.22,Cu2+浓度在2.0×10-8~1.0×10-5mol/l时相对荧光强度的对数与Cu2+浓度的对数有线性关系,检测限为5×10-9mol/L。当[Cu2+]<5×10-6mol/L时,响应时间小于5 min。用0.3 mol/L的EDTA和缓冲溶液连续清洗光极膜使之再生。通过测定碳酸饮料中Cu2+证明该方法具有应用的价值。
[1]Radisky D,Kaplan J.Regulation oftransition metal transport across the yeast plasma membrane[J].J.Biol.Chem.,1999,274(8):4 481~4 484.
[2]Rode B M,Suwannachot Y.The possible role of Cu(II)for the origin of life[J].Coord Chem.Rev.,1999,(190-192):1 085~1 099.
[3]Choi S H,Pang K,Kim K,et al.Cu2+Colorimetric Sensing and Fluorescence Enhancement and Hg2+Fluorescence Diminution in “Scorpionate”-like Tetrathienyl-Substituted Boron-Dipyrrins[J].Inorg.Chem.,2007,46:10 564~10 577.
[4]Csokai V,Kadar M,Mai D L H,et al.Synthesis,optical and electroanalytical characterizations of a thiacalix[4](N-phenylazacrown-5)ether-BODIPY ionophore[J].Tetrahedron,2008,64:1 058~1 063.
[5]Gholivand M B,Niroomandi P,Yari A,et al.Characterization of an optical copper sensor based on N,N′-bis(salycilidene)-1,2-phenylenediamine[J].Anal.Chim.Acta,2005,538(1-2):225~231.
[6]Safavi A,Bagheri M.Design of a copper(Ⅱ)optode based on immobilization of dithizone on a triacetylcellulose membrane[J].Sens.Actuators B,2005,107(1):53~58.
[7]Yin J,Guan X,Wang D,et al.Metal-Chelating and Dansyl-Labeled Poly(N-isopropylacrylamide)Microgels as Fluorescent Cu2+Sensors with Thermo-Enhanced Detection Sensitivity[J].Langmuir,2009,25(19):11 367~11 374.
[8]Domaille D W,Zeng L,Chang C J.Visualizing Ascorbate-Triggered Release of Labile Copper within Living Cells usinga Ratiometric Fluorescent Sensor[J].J.Am.Chem.Soc.,2010,132:1 194~1 195.
[9]Hennrich G,Walther W,Resch-Genger U,et al.Cu(Ⅱ)-and Hg(Ⅱ)-induced modulation of the fluorescence behavior of a redox-active sensor molecule[J].Inorg.Chem.,2001,40(4):641~644.
[10]Mitchell K A,Brown R G,Yuan D,et al.A fluorescent sensor for Cu2+at the sub-ppm level[J].J.Photochem.Photobiol.A.Chem.,1998,115(2):157~161.
[11]Mei Y,Bentley P A,Wang W.A selective and sensitive chemosensor for Cu2+based on 8-hydroxyquinoline[J].Tetrahedron Lett.,2006,47:2 447~ 2 449.
[12]Wu Q,Anslyn E.Catalytic signal amplification using a heck reaction.An example in the fluorescence sensing of Cu(Ⅱ)[J].J.Am.Chem.Soc.,2004,126(45):14 682 ~14 683.
[13]Royzen M,Dai Z,Canary J W.Ratiometric displacement approach to Cu(Ⅱ)sensing by fluorescence[J].J.Am.Chem.Soc.,2005,127(6):1 612~1 613.
[14]Zhang X B,Guo C C,Li Z Z,et al.An optical fiber chemica1 sensor for mercury Ions based on a porphyrin dimer[J].Anal.Chem.,2002,74(4):821~825.
[15]Krämer R.Fluoreszenz-chemosensoren für Cu2+-ionen:schnell,selektiv und hochempfindlich [J].Angew.Chem.,1998,110(6):804~806.
[16]Biesaga M,Pyrzynska K,Trojanowicz M.Porphyrin in analytical chemistry[J].A review.Talanta,2000,51(2):209~224.

