微生物燃料电池生物质能利用现状与展望
黄丽萍,成少安
1 大连理工大学环境学院 工业生态与环境工程教育部重点实验室,大连 116024 2 浙江大学热能工程研究所 能源清洁利用国家重点实验室,杭州 310027
微生物燃料电池生物质能利用现状与展望
黄丽萍1,成少安2
1 大连理工大学环境学院 工业生态与环境工程教育部重点实验室,大连 116024 2 浙江大学热能工程研究所 能源清洁利用国家重点实验室,杭州 310027
作为一种新概念的废物处理与能源化技术,微生物燃料电池研究在过去10年里取得了长足的进步和技术突破。本文在简要介绍微生物燃料电池研究现状基础上,系统综述了该技术及与其他技术耦合在生物质能利用方面的最新研究进展,重点分析了其中存在的问题,并展望了该技术在生物质能转化和利用方面的研究前景。
微生物燃料电池,有机废弃物处理,生物质能回收
Abstract:Microbial fuel cells(MFCs)that can harvest biomass energy from organic wastes through microbial catalysis have garnered more and more attention within the past decade due to its potential benefits to ecological environment.In this article, the updated progress in MFCs is reviewed, with a focus on frontier technologies such as chamber configurations, feedstock varieties and the integration of MFCs with microbial electrolysis cells for hydrogen production.And on the other hand, the challenges like development of cost-effective electrode materials, improvement of biomass energy recovery and power output, design and optimization of commercial MFC devices are presented.
Keywords:microbial fuel cells, organic waste treatment, biomass energy recovery
生物质能是植物叶绿素将太阳能转化为化学能贮存在生物质内部的能量,这些生物质包括所有动物、植物、农作物、林产物、海产物(各种海草)、微生物以及由这些有生命物质派生、排泄和代谢的城市垃圾和废水等。高效利用这些来源丰富、可再生的生物质能,被认为是取代化石燃料、减少温室气体排放、协调人类社会经济快速发展对能源的广泛需求与环境可持续发展矛盾的重要策略和途径,是当今世界各国广泛关注的热点。传统的生物质能转化方式主要有生物质气化、生物质液化、生物质固化、生物发酵等多种方式。与这些转化方式不同,近年发展起来的微生物燃料电池(Microbial fuel cells,MFCs)技术是一种新概念的废物处理和能源利用方式,具有在生物质能转化和利用方面发挥重要作用的潜力,发展前景广阔。
1 微生物燃料电池概况
MFCs是依靠微生物的催化作用将废弃物或污染物中化学能转化为清洁电能的技术,具有处理废弃物和联产电能的双重功效,代表着废弃物资源化的重要发展方向。过去10年时间里,有关MFC研究引起了世界各国的广泛关注,相关论文数量经历了指数级增长,研究内容在广度和深度上均有显著提升[1-2],在微生物、系统构型与材料等方面接连取得了重大发现和技术突破,特别是在微生物电子传递机制、系统输出功率、低成本高性能电极及其催化材料方面取得了长足进步[3]。在MFC微生物方面,依据接种来源不同,驯化富集的MFC电催化活性菌群组成也复杂多样。土杆菌科Geobacteraceae是 MFC阳极中最常见菌株,其他优势菌还包括γ-变形菌纲Gammaproteobacteria、β-变形菌纲Betaproteobacteria、根瘤菌目Rhizobiales以及梭菌纲Clostridia等[4]。而希瓦氏菌属Shewanella拥有丰富细胞色素的细胞膜表面、可分泌电子介体以及具有纳米线结构,具备提供和接收电子的双重能力,不仅是MFC阳极,也是MFC阴极特别是生物阴极 MFC的优势菌属[5-6]。高温条件下,接种海洋底泥的 MFC阳极存在Thermincola carboxydophila菌株,而接种污水的 MFC阳极驯化富集菌群含有脱铁杆菌属Deferribacter和栖热粪杆菌属Coprothermobacter[4]。因此,改变环境条件包括选择特定培养基、提供电子受体如 Fe(ΙΙΙ)和阳极电极、以及提供电子供体如阴极电极,并结合聚合酶链反应-变性梯度凝胶电泳(PCR-DGGE)、激光扫描共聚焦显微镜(LSCM)等技术,是 MFC特定微生物菌群(种)筛选和表征的常用方法。而借助分子生物学和基因工程技术产生缺陷型电活性微生物,是研究MFC电活性微生物电子传递机理的重要手段[4,7]。就电子传递机制而言,已经发现的产电微生物主要以直接电子传递、依靠分泌介体的间接电子传递、纳米导线电子传递等 3种方式完成电子传输[1,4,7]。对混菌体系而言,不具产电活性的菌细胞还可能依靠或“共享”某些菌体分泌的介体,参与系统的电子传递[8-10]。从代谢角度看,这些不具电催化活性的微生物的存在具有一定的意义。特别是对复杂底物而言,无电催化活性微生物可将复杂底物发酵或分解为简单底物,后者可作为电活性微生物的“燃料”被彻底转化为CO2[4]。因此,MFC系统的菌群间存在一定的协作与互助性[1,4-5,7]。在系统构型方面,已开发了包括平板式[11]、立方式[12]、上流式[13]、瓶式[14]、管式[15]、旋转阴极式[16]、阳极阴极连续式[17]、漂浮式[18]等形状多样、特点不同的MFC反应器,并就电极间距、阴阳极表面积比的优化[19]等方面开展了诸多卓有成效的研究,显著提高了系统的输出功率。在材料方面,基于碳材料的碳纸[11]、碳布[12]、碳粒[20]、碳纤维[14]、碳毡[21]、碳网[22]和离子交换膜[15]等阴阳极材料及其改性[23],以及低成本催化剂[24-25]的研制,结合离子交换膜(对双室MFC)、隔膜(对单室空气阴极MFC)[19,26-27]等的使用和溶液成分等的优化[12,19-20,28],配以合理的MFC反应器,已使输出功率由10年前的1 µW/m3增加到2 kW/m3,库仑效率也由最初的百分之几提高到目前的 80%~90%[1,3,29]。在大量的关于电子传递机理、反应器构型和材料的研究中,乙酸钠和葡萄糖以其代谢末端电子供体或结构简单等优点而成为普遍采用的MFC燃料。伴随着对MFC认识的不断深入和系统性能的提高,以各种生物质为燃料的MFC研究近年来引起了人们的关注,研究结果为MFC生物质能转化的产业化提供了前期技术支持和保证。
2 微生物燃料电池转化生物质能
2.1 微生物燃料电池转化生物质废水
作为生物质的重要组成部分,蕴藏大量能量的各类生物质废水是 MFC利用和转化的重要物质来源。大量的实验室研究结果表明,包括市政废水、各种食品加工废水、屠宰厂废水、养殖废水、啤酒废水等任何可被微生物降解的生物质废水均可作为MFC燃料,MFC由此也被认为是最有可能在污水处理领域得到实际应用[2-3]。在这些研究中,不同种类废水(电导率、有机质含量等不同)使用的MFC反应器构型不同,有些反应器构型相同,但电极材料、电极有效面积、电极间距以及电子受体类型也都不尽相同。诸多影响因素导致不同MFC系统转化不同类型生物质废水时的输出功率和处理效果显著不同,从而使这些结果的量化和比较具有一定的局限性[1]。在广泛开展的实验室系统MFC转化生物质废水研究的同时,澳大利亚昆士兰大学现代污水管理中心的Keller教授和Rabaey博士首次设计了总体积12 m3的MFC反应器,进行MFC转化和利用啤酒废水的放大试验,但MFC输出功率仅8 W/m3,未达到设计指标,表明实际废水较低的电导率是制约放大MFC输出功率的主要原因[3]。利用微生物燃料电池实现污水处理厂污泥的资源化利用也一直是人们关注的热点问题。近期的实验室研究结果表明,污泥中19%总有机碳、37%溶解性有机碳、15%~32%疏酸类物质能被 MFC降解和转化,同时产电9 W/m3。MFC提取污泥能量的结果可使污泥中芳香类化合物降低66%,胞外有机质的亲水性增加48%~65%[30-31]。虽然污泥的MFC资源化技术还有许多问题需要解决和突破,但这一新思路无疑为污泥的清洁化和资源化利用提供了有效途径。
2.2 微生物燃料电池转化植物纤维和纤维素
植物纤维是地球上分布广泛、储量丰富的生物质资源,一般是由40%~50%纤维素、25%~30%半纤维素和10%~20%木质素组成。MFC转化纤维素和植物纤维是近年来人们关注的热点之一。研究表明,梭菌属Clostridium类群之中不仅有已知的产电细菌,也是厌氧条件下纤维素分解的主要成员。Niessen等[32]首次报道了中温厌氧菌Clostridium cellulolyticum和嗜热菌Clostridium thermocellum直接降解纤维素并输出电能,但电能的产生是通过纤维素降解产物-氢气的氧化过程而实现,而不是细菌直接氧化纤维素产电。随后的研究工作表明,MFC中的电化学活性菌Geobacter sulfurreducens能与纤维素降解菌Clostridium cellulolyticum协同作用于羟甲基纤维素的降解,使其降解率由单纯Clostridium cellulolyticum作用下的42%提高到64%[33]。相比于纯培养的Enterobacter cloacae菌株,经MFC驯化筛选的混合菌群产电能力和纤维素降解能力明显高于前者[34]。通过富集造纸回用废水中的电化学活性菌群,MFC可以在降解废水中96%纤维素的同时输出电能[35]。而改变反应器构型和运行模式、优化反应停留时间以及介质的化学成分,可使体系电能输出提高近20倍[36]。同样,瘤胃微生物能有效降解纤维素,多聚酶链反应-变性梯度凝胶电泳(PCRDGGE)菌群分析表明,阳极上主要富集梭菌属菌株,而溶液介质中则富含丛毛单胞菌属Comamonas菌株[37]。从土壤中筛选的降解纤维素菌群含有沼泽红假单胞菌Rhodopseudomonas palustris等菌株,该菌群能直接降解玉米秸秆并输出电能0.5 W/m3[38]。而来源于污水处理厂的混合菌群能分别利用小球藻Chlorella vulgaris和大型水生植物Ulva lactuca输出电能277 W/m3和215 W/m3[39]。最近的研究表明,接种瘤胃微生物的MFC能直接利用水生植物Canna indica产电0.4 W/m3,Canna indica的纤维素、半纤维素和木质素去除率分别达 46%、61%和 22%,MFC菌群中存在有不动杆菌属Acinetobacter、明串珠菌属Trichococcus、类杆菌属Bacteroides以及基因信息与拟杆菌门Bacteroidetes接近的菌属[40]。同样,从土壤中筛选的纤维素混合菌群虽然能转化蒸爆预处理玉米秸秆中的固体物并产电,但其产电功率明显低于蒸爆预处理玉米秸秆的液体部分(表1),表明植物生物质燃料组成和生物有效性影响MFC电能输出[38,41]。虽然纤维素能在 MFC中被直接降解并产生电能,但总体而言,纤维素降解速率低,限制了MFC系统的电能输出。预处理纤维素或植物纤维可能是提高MFC电能输出的有效途径。
纤维素或植物纤维经预处理后,可转化为单糖如木糖、葡萄糖、阿拉伯糖、多元醇如木糖醇、半乳糖醇、核糖醇、阿拉伯糖醇、甘露醇、山梨醇以及一定量的呋喃、酚类等。MFC实现生物质能利用的研究主要集中在电化学活性菌对这些小分子有机物的有效转化方面。Catal等[42-43]和 Huang等[44-46]研究了间歇运行双室或单室 MFC转化单糖和醇类的产电性能,结果表明这些单糖和醇均可作为MFC燃料,输出功率最高可达44 W/m3,库仑效率13%~28%,COD去除率71%~92%。但不同醇类的加入使MFC的菌群组成发生变化,产电微生物适应底物输出电能的滞后期也随底物种类的不同而不同[43]。与单糖和醇类的电能输出不同,在所研究的2种呋喃和8种酚类化合物中,仅以5-羟甲基呋喃醛为燃料的MFC能输出较低电能,而其余呋喃和酚类化合物均不同程度抑制葡萄糖 MFC的电能输出[47]。因此,如何采用有效的预处理方法尽可能减少或避免酚类和呋喃类化合物的生成是 MFC转化纤维素或植物纤维所面临的主要问题。此外,反应器运行模式对微生物耐受此类物质的能力也有影响,反应器连续运行可使产生物乙醇的微生物耐受生物质预处理过程的多种抑制剂的能力提高[48]。因此,采用连续模式运行 MFC可能是减少或避免预处理抑制剂影响的另一有效途径。与上述关注预处理产物的MFC利用过程不同,Zuo等[41]直接利用中性和酸性蒸爆预处理玉米秸秆作为MFC燃料,系统输出功率1.3~1.6 W/m3。随后,Rezaei等[49]研究了酶解预处理
纤维素对MFC产电性能的影响,发现纤维素酶解预处理不仅不影响MFC的产电菌性能,而且因加快了纤维素水解速度使MFC输出功率提高10倍(表1)。小麦秸秆是一类富含纤维素、半纤维素和木质素的植物纤维,水解热处理的液相部分富含木糖、葡萄糖和阿拉伯糖。MFC能直接利用该水解产物输出功率2.1 W/m3,库仑效率16%~37%[50]。同样,蒸爆预处理玉米秸秆后的固体物中含有大量纤维素、半纤维素和木质素,与未经预处理的玉米秸秆相比,单室空气阴极 MFC能降解前者中 60%纤维素、15%半纤维素和11%木质素并输出电能0.7 W/m3,而对后者纤维素、半纤维素和木质素的降解率分别为42%、17%和4%,输出功率0.5 W/m3[38]。从能源消耗看,蒸爆或水解预处理加快纤维素降解,提高了MFC输出功率,但降低了系统总能量回收率。与无预处理的总能源回收率3.6%相比,经过预处理的系统总能源回收率仅为1.6%[38]。甲壳质是与纤维素结构类似的另一类资源丰富的生物质,主要以虾壳、蟹壳、昆虫表皮存在于环境中。MFC电活性微生物也可利用甲壳质输出电能,但甲壳质颗粒大小显著影响MFC输出功率[51]。菌群分析表明,降解大颗粒甲壳质的 MFC菌群分布不同于小颗粒和中等颗粒甲壳质。因此,以颗粒状生物质为MFC燃料时,颗粒大小是需要考虑的重要因素。
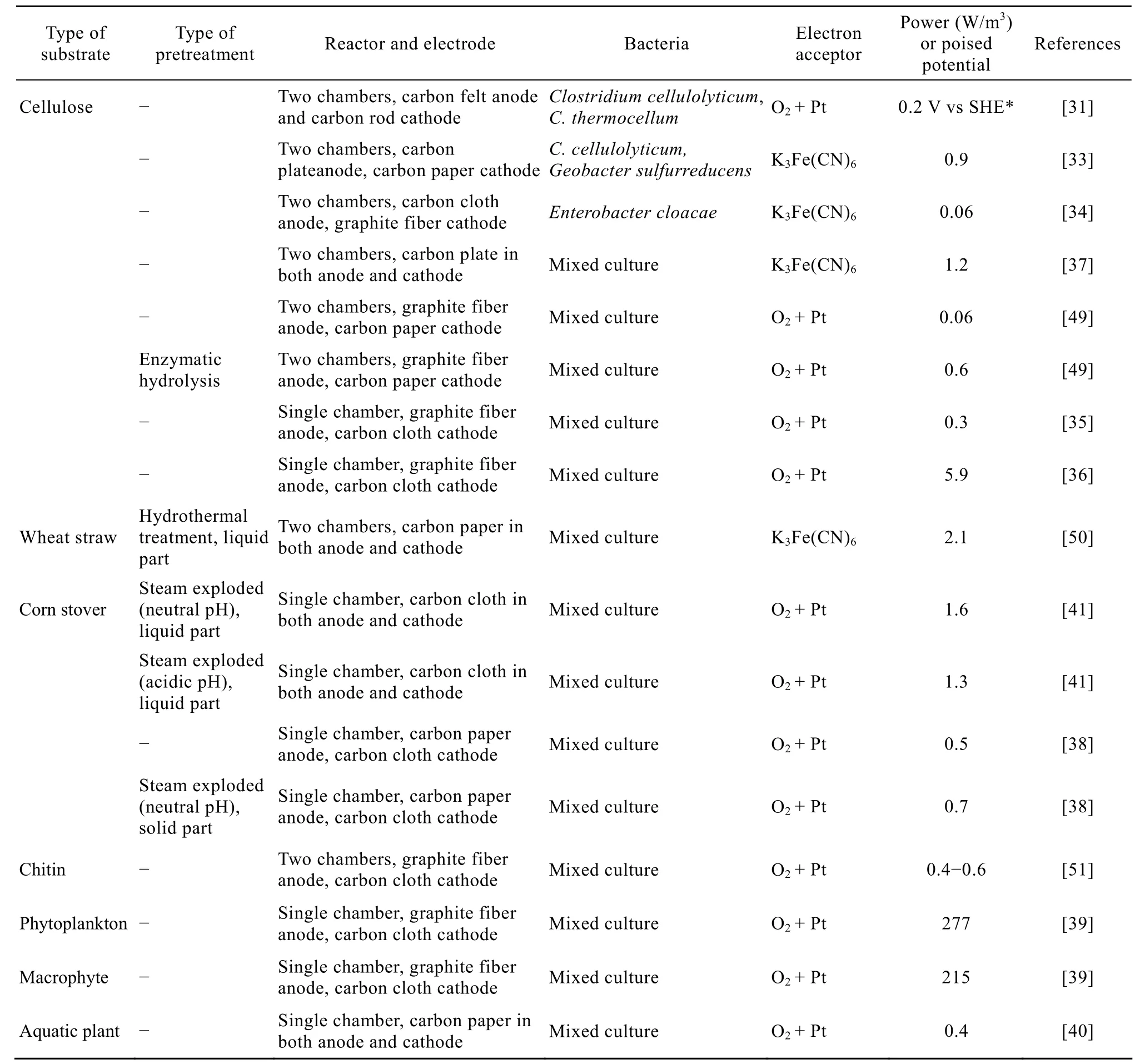
表1 MFC转化纤维素或植物纤维输出电能一览表Table 1 Biodegradation of cellulose and lignocellulosic biomass in microbial fuel cells
3 微生物燃料电池耦合其他技术转化生物质能
3.1 微生物电解池、微生物燃料电池耦合生物制氢
微生物电解池(MEC)是依靠微生物催化作用,在外加一定电压下生产氢气或某种产物。基于MEC产氢仅需外加较小电压(理论上 0.11 V)[52],Sun等[53]构建了MEC-MFC耦合系统,借助MFC产生的电能驱动MEC生产氢气。耦合系统产氢速度可达0.4 mL/(L·d),氢气收率为0.08 mol H2/mol乙酸。虽然系统的稳定性和氢气收率都还有待于改善和提高,但MEC-MFC耦合过程的实现无疑拓展了MFC生物质能转化和利用的领域和范围。
3.2 植物、微生物燃料电池耦合系统
水稻根部存在丰富的根际微生物,通过在水稻根部附近放置电极,借助根际微生物的电化学催化作用构建水稻-MFC耦合系统,利用和降解水稻根部附近有机物并输出电能,是MFC生物质能转化和利用的另一种方式[54]。与无水稻存在的 MFC空白相比,前者功率输出是后者的7倍,达到0.1 W/m2,表明水稻的存在强化了MFC性能。同样,植物芦苇甜茅(Reed mannagrass)-MFC耦合系统也可输出电能0.58 kW·h/(m2·年)[55]。这些研究结果预示着MFC具有与水稻、芦苇等植物耦合,在农田土壤或湿地污染修复领域发挥作用的潜能。
绿藻是一种生长快的低级水生植物。基于绿藻利用太阳光生长快的特性,考虑到厌氧消化和MFC对底物浓度的不同要求,Schamphelaire等[56]构建了太阳光驱动的绿藻生长-厌氧消化-MFC组合反应器。藻生长池出水进入MFC阴极,其中的溶解氧作为MFC阴极电子受体;生长的绿藻进入厌氧消化池;消化池出水进入 MFC阳极,有机质在 MFC中得到进一步降解后回流至藻生长池循环使用。系统获得了藻产量5.9~7.4 kg/(m2·年),甲烷产量0.5 NM3/kg藻,MFC产电 0.25 W/m3,产能总计2.2~5.7 W/m3。然而,因绿藻发酵也可能产生呋喃醛、糠醛、酚类等多种抑制剂[57],而影响该系统菌群活性,导致系统运行不稳定。
4 微生物燃料电池生物质能利用的发展趋势与展望
MFC自身潜在的优点使人们对其在生物质能转化利用的发展前景看好。目前,MFC的研究主要集中在两方面:一是通过分子生物学和基因工程技术剖析细胞与电极间的相互作用,改进和调控电活性微生物细胞,降低或去除电子转移过程的屏蔽作用或阻力[7,29,58-59],以及反应器构型的改进[1],以期进一步提高MFC产电功率和生物质能利用效率。二是开展 MFC产业化研究。从废弃物的利用角度看,MFC已具实际应用价值。但目前MFC制造成本偏高,使得经济价值降低。昂贵的阴极催化剂和阴极材料是MFC成本高的主要原因[3,37]。寻找高性能、低成本化学催化剂和阴极材料以及生物阴极是MFC生物质能利用的发展方向。在生物质来源方面,废水类生物质可以被MFC有效利用。对纤维类生物质特别是植物纤维,消除或减轻预处理或降解后生成的酚类、呋喃类等抑制剂对生物活性的影响是MFC资源化利用过程中需要重点解决的问题。最后,结合 MFC现有性能和特点发展起来的电能和化学品联产耦合过程如MFC副产H2O2[60-61]、利用CO2的MFC副产甲烷或有机物等[62-63]是 MFC发展的新方向。结合双室 MFC膜结构性能和特点开展起来的MFC海水淡化技术[64]以及MFC生产碱技术[65],也拓展了MFC的发展空间和应用范围。近年来,微生物技术、纳米材料技术、电化学技术、化学和环境工程的巨大发展和进步,为 MFC研究提供了有利的物质、知识和技术储备。因此,在不远的将来,MFC有望在生物质能的高效转化和利用方面取得重要进展。
REFERENCES
[1]Logan B.Exoelectrogenic bacteria that power microbial fuel cells.Nat Rev Microbiol, 2009, 7(5): 375−381.
[2]Pant D, Bogaert GV, Diels L,et al.A review of the substrates used in microbial fuel cells(MFCs)for sustainable energy production.Bioresour Technol, 2010,101(6): 1533−1543.
[3]Logan B.Scaling up microbial fuel cells and other bioelectrochemical systems.Appl Microbiol Biotechnol,2010, 85(6): 1665−1671.
[4]Lovley D.The microbe electric: conversion of organic matter to electricity.Curr Opin Biotechnol, 2008, 19: 564−571.
[5]Fredrickson JK, Romine MF, Beliaev AS,et al.Towards environmental systems biology ofShewanella.Nat Rev Microbiol, 2008, 6: 592−603.
[6]Freguia S, Tsujimura S, Kano K.Electron transfer pathways in microbial oxygen biocathodes.Electrochim Acta, 2010, 55:813−818.
[7]Lovley D.Extracellular electron transfer: wires, capacitors,iron lungs, and more.Geobiology, 2008, 6(3): 225−231.
[8]Rabaey K, Boon N, Höfte M,et al.Microbial phenazine production enhances electron transfer in biofuel cells.Environ Sci Technol, 2005, 39(9): 3401−3408.
[9]Pham TH, Boon N, Aelterman P,et al.Metabolites produced byPseudomonassp.enable a Gram-positive bacterium to achieve extracellular electron transfer.Appl Microbiol Biotechnol, 2008, 77(5): 1119−1129.
[10]Canstein H, Ogawa J, Shimizu S,et al.Secretion of flavins byShewanellaspecies and their role in extracellular electron transfer.Appl Environ Microbiol,2008, 74(3): 615−623.
[11]Min B, Logan B.Continuous electricity generation from domestic wastewater and organic substrates in a flat plate microbial fuelcell.Environ Sci Technol, 2004, 38(21):5809−5814.
[12]Liu H, Cheng S, Logan B.Power generation in fed-batch microbial fuel cells as a function of ionic strength,temperature, and reactor configuration.Environ Sci Technol, 2005, 39(14): 5488−5493.
[13]He Z, Minteer S, Angenent L.Electricity generation from artificial wastewater using an upflow microbial fuel cell.Environ Sci Technol, 2005, 39(14): 5262−5267.
[14]Logan B, Cheng S, Watson V,et al.Graphite fiber brush anodes for increased power production in air-cathode microbial fuel cells.Environ Sci Technol, 2007, 41(9):3341−3346.
[15]Zuo Y, Cheng S, Logan B.Ion exchange membrane cathodes for scalable microbial fuel cells.Environ Sci Technol, 2008, 42(18): 6967−6972.
[16]He Z, Kan J, Wang Y,et al.Electricity production coupled to ammonium in a microbial fuel cell.Environ Sci Technol, 2009, 43(9): 3391−3397.
[17]Freguia S, Rabaey K, Yuan Z,et al.Sequential anode-cathode configuration improves cathodic oxygen reduction and effluent quality of microbial fuel cells.Wat Res, 2008, 42(6/7): 1387−1396.
[18]An J, Kim D, Chun Y,et al.Floating-type microbial fuel cell(FT-MFC)for treating organic-contaminated water.Environ Sci Technol, 2009, 43(5): 1642−1647.
[19]Fan Y, Hu H, Liu H.Enhanced coulombic efficiency and power density of air-cathode microbial fuel cells with an improved cell configuration.J Power Sources, 2007,171(2): 348−354.
[20]Liu H, Cheng S, Huang L,et al.Scale-up of membrane-free single-chamber microbial fuel cells.J Power Sources, 2008, 179(1): 274−279.
[21]Borole A, Hamilton C, Vishnivetskaya T,et al.Integrating engineering design improvements with exoelectrogen enrichment process to increase power output from microbial fuel cells.J Power Sources, 2009, 191(2): 520−527.
[22]Wang X, Cheng S, Feng Y,et al.Use of carbon mesh anodes and the effect of different pretreatment methods on power production in microbial fuel cells.Environ Sci Technol, 2009, 43(17): 6870−6874.
[23]Cheng S, Logan B.Ammonia treatment of carbon clothanodes to enhance power generation of microbial fuel cells.Electrochem Commun, 2007, 9(3): 492−496.
[24]Yu E, Cheng S, Logan B,et al.Electrochemical reduction of oxygen with iron phthalocyanine in neutral media.J Appl Electrochem, 2009, 39(5): 705−711.
[25]Yuan Y, Zhou S, Zhuang L.Polypyrrole/carbon black composite as a novel oxygen reduction catalyst for microbial fuel cells.J Power Sources, 2010, 195(11):3490−3493.
[26]Zhang X, Cheng S, Wang X,et al.Separator characteristics for increasing performance of microbial fuel cells.Environ Sci Technol, 2009, 43(21): 8456−8461.
[27]Zhang F, Saito T, Cheng S,et al.Microbial fuel cell cathodes with poly(dimethylsiloxane)diffusion layers constructed around stainless steel mesh current collectors.Environ Sci Technol, 2010, 44(4):1490−1495.
[28]Ahn Y, Logan B.Effectiveness of domestic wastewater treatment using microbial fuel cells at ambient and mesophilic temperatures.Bioresour Technol, 2010, 101(2):469−475.
[29]Nevin K, Richter H, Covalla S,et al.Power output and columbic efficiencies from biofilms ofGeobacter sulfurreducenscomparable to mixed community microbial fuel cells.Environ Microbiol, 2008, 10(10): 2505−2514.
[30]Jiang J, Zhao Q, Zhang J,et al.Electricity generation from bio-treatment of sewage sludge with microbial fuel cell.Bioresour Technol, 2009, 100(23): 5808−5812.
[31]Jiang J, Zhao Q, Wei L,et al.Extracellular biological organic matters in microbial fuel cell using sewage sludge as fuel.Wat Res, 2010, 44(7): 2163−2170.
[32]Niessen J, Schröder U, Harnisch F,et al.Gaining electricity from in situ oxidation of hydrogen produced by fermentative cellulose degradation.Lett Appl Microbiol,2005, 41(3): 286−290.
[33]Ren Z, Ward T, Regan J.Electricity production from cellulose in a microbial fuel cell using a defined binary culture.Environ Sci Technol, 2007, 41(13): 4781−4786.
[34]Rezaei F, Xing D, Wagner R,et al.Simultaneous cellulose degradation and electricity production byEnterobacter cloacaein a microbial fuel cell.Appl Environ Microbiol,2009, 75(11): 3673−3678.
[35]Huang L, Logan B.Electricity generation and treatment of paper recycling wastewater using a microbial fuel cell.Appl Microbiol Biotechnol,2008, 80(2): 349−355.
[36]Huang L, Cheng S, Rezaei F,et al.Reducing organic loading in industrial effluents using microbial fuel cells.Environ Technol, 2009, 30(5): 499−504.
[37]Rismani-Yazdi H, Christy A, Dehority B,et al.Electricity generation from cellulose by rumen microorganisms in microbial fuel cells.Biotechnol Bioeng, 2007, 97(6):1398−1407.
教师提问:从性状杂交上看,图4、图5展示的杂交组合是什么关系?以此引导学生回忆正交和反交。受此启发,持控制眼色的基因位于Ⅱ-2区段观点的小组又设计了图6所示的杂交实验。然而,图5、图6所示的实验结果却又是相同的。
[38]Wang X, Feng Y, Wang H,et al.Bioaugmentation for electricity generation from corn stover biomass using microbial fuel cells.Environ Sci Technol, 2009, 43(15):6088−6093.
[39]Velasquez-Orta S, Curtis T, Logan B.Energy from algae using microbial fuel cells.Biotechnol Bioeng, 2009, 103(6):1068−1076.
[40]Zang G, Sheng G, Tong Z,et al.Direct electricity recovery fromCanna indicaby an air-cathode microbial fuel cell inoculated with rumen microorganisms.Environ Sci Technol,2010, 44(7): 2715−2720.
[41]Zuo Y, Maness P, Logan B.Electricity production from steam-exploded corn stover biomass.Energy Fuels, 2006,20(4): 1716−1721.
[42]Catal T, Li K, Bermek H,et al.Electricity production from twelve monosaccharides using microbial fuel cells.J Power Sources, 2008, 175(1): 196−200.
[43]Catal T, Xu S, Li K,et al.Electricity generation from polyalcohols in single-chamber microbial fuel cells.Biosens Bioelectron, 2008, 24(4): 849−854.
[44]Huang L, Zeng R, Angelidaki I.Exploiting electricity production from pentose using a mediator-less microbial fuel cell.Biosour Technol, 2008, 99(10): 4178−4184.
[45]Huang L, Angelidaki I.Effect of humic acids on electricity production integrated with xylose degradation in a microbial fuel cell.Biotechnol Bioeng, 2008, 100(3):413−422.
[47]Catal T, Fan Y, Li K,et al.Effects of furan derivatives and phenolic compounds on electricity generation in microbial fuel cells.J Power Sources, 2008, 180(1): 162−166.
[48]Brethauer S, Wyman C.Review: continuous hydrolysis and fermentation for cellulosic ethanol production.Bioresour Technol, 2010, 101(13): 4862−4874.
[49]Rezaei F, Richard T, Logan B.Enzymatic hydrolysis of cellulose coupled with electricity generation in a microbial fuel cell.Biotechnol Bioeng, 2008, 101(6): 1163−1169.
[50]Zhang Y, Min B, Huang L,et al.Electricity generation and microbial community analysis of wheat straw biomass powered microbial fuel cells.Appl Environ Microbiol,2009, 75(11): 3389−3395.
[51]Rezaei F, Richard T, Logan B.Analysis of chitin particle size on maximum power generation, power longevity, andCoulombic efficiency in solid-substrate microbial fuel cells.J Power Sources, 2009, 192(2): 304−309.
[52]Rozendal R, Hamelers H, Euverink G,et al.Principle and perspectives of hydrogen production through biocatalyzed electrolysis.Int J Hydrogen Energy, 2006, 31(12):1632−1640.
[53]Sun M, Sheng G, Zhang L,et al.An MEC-MFC-coupled system for biohydrogen production from acetate.Environ Sci Technol, 2009, 42(21): 8095−8100.
[54]Schamphelaire L, Bossche L, Dang H,et al.Microbial fuel cells generating electricity from rhizodeposits of rice plants.Environ Sci Technol, 2008, 42(8): 3053−3058.
[55]Strik D, Hamelers H, Snel J,et al.Green electricity production with living plants and bacteria in a fuel cell.Int J Energy Res, 2008, 32(9): 870−876.
[56]Schamphelaire L, Verstraete W.Revival of the biological sunlight-to-biogas energy conversion system.Biotechnol Bioeng, 2009, 103(2): 296−304.
[57]Almeida J, Bertilsson M, Gorwa-Grauslund M,et al.Metabolic effects of furaldehydes and impacts on biotechnological processes.Appl Microbiol Biotechnol,2009, 82(4): 625−638.
[58]Leang C, Qian X, Mester T,et al.Alignment of the c-type cytochrome OmcS along pili ofGeobacter sulfurreducens.Appl Environ Microbiol, 2010, 76(12): 4080−4084.
[59]Inoue K, Qian X, Morgado L,et al.Purification and characterization of OmcZ, an outer-Surface, octaheme c-Type cytochrome essential for optimal current production byGeobacter sulfurreducens.Appl Environ Microbiol, 2010,76(12): 3999−4007.
[60]Rozendal R, Leone E, Keller J,et al.Efficient hydrogen peroxide generation from organic matter in a bioelectrochemical system.Electrochem Commun, 2009,11(9): 1752−1755.
[61]You S, Wang J, Ren N,et al.Sustainable conversion of glucose into hydrogen peroxide in a solid polymer electrolyte microbial fuel cell.ChemSusChem, 2010, 3(3):334−338.
[62]Cheng S, Xing D, Call D,et al.Direct biological conversion of electrons into methane by electromethanogenesis.Environ Sci Technol, 2009, 43(10): 3953−3958.
[63]Cao X, Huang X, Liang P,et al.A completely anoxic microbial fuel cell using a photo-biocathode for cathodic carbon dioxide reduction.Energy Environ Sci, 2009, 2:498−501.
[64]Cao X, Huang X, Liang P,et al.A new method for water desalination using microbial desalination cells.Environ Sci Technol, 2009, 43(18): 7148−7152.
[65]Rabaey K, Bützer S, Brown S,et al.High current generation coupled to caustic production using a lamellar bioelectrochemical system.Environ Sci Technol, 2010,44(11): 4315−4321.
Biomass energy utilization in microbial fuel cells: potentials and challenges
Liping Huang1, and Shaoan Cheng2
1 Key Laboratory of Industrial Ecology and Environmental Engineering, Ministry of Education(MOE), School of Environmental Science and Technology, Dalian University of Technology, Dalian 116024, China 2 State Key Laboratory of Clean Energy Utilization, Department of Energy Engineering, Zhejiang University, Hangzhou 310027, China
Received:May 17, 2010;Accepted:June 23, 2010
Supported by:“Energy + X”(2008)Key Program through Dalian University of Technology, Program for Changjiang Scholars and Innovative Research Team in University(No.IRT0813), Open Project of State Key Laboratory of Clean Energy Utilization, Zhejiang University(No.ZJUCEU2010001).
Corresponding author:Liping Huang.Tel/Fax: +86-411-84707844; E-mail: lphuang2008@gmail.com Shaoan Cheng.Tel: +86-571-87952038; Fax: +86-571-87951616; E-mail: shaoancheng@zju.edu.cn大连理工大学“能源+X”(2008)交叉学科重点基金,长江学者和创新团队发展计划(No.IRT0813),浙江大学能源清洁利用国家重点实验室开放基金(No.ZJUCEU2010001)资助。

