共表达SHMT和TPase载体的构建及双酶法合成L-色氨酸
李鑫,刘军,赵沁沁,徐爱才
武汉工业学院生物与制药工程学院,武汉 430023
共表达SHMT和TPase载体的构建及双酶法合成L-色氨酸
李鑫,刘军,赵沁沁,徐爱才
武汉工业学院生物与制药工程学院,武汉 430023
利用重组大肠杆菌表达丝氨酸羟甲基转移酶(SHMT)和色氨酸酶(TPase),并利用双酶法合成 L-色氨酸。采用 PCR从大肠杆菌 K12基因组中扩增上述两种酶的基因,利用 pET-28a载体,构建单表达重组质粒 pET-SHMT、pET-TPase和共表达重组质粒pET-ST。将上述3种重组质粒转入大肠杆菌BL21(DE3)进行表达。SDS-PAGE结果表明,单表达基因工程菌BL21(DE3)/pET-SHMT和BL21(DE3)/pET-TPase分别在47 kDa(SHMT)和50 kDa(TPase)处有蛋白表达带;共表达基因工程菌BL21(DE3)/pET-ST在上述两处均有蛋白表达带。与宿主菌相比,单表达SHMT基因工程菌产酶活性提高了6.4倍;单表达TPase基因工程菌产酶活性提高了8.4倍;共表达SHMT和TPase基因工程菌产酶活性分别提高了6.1和6.9倍。利用工程菌所产酶进行双菌双酶法和单菌双酶法合成L-色氨酸。两菌双酶合成L-色氨酸的累积量达到41.5 g/L,甘氨酸转化率为83.3%,吲哚转化率为92.5%;单菌双酶合成L-色氨酸的累积量达到28.9 g/L,甘氨酸转化率为82.7%,吲哚转化率为82.9%。
丝氨酸羟甲基转移酶,色氨酸酶,串联表达,双酶法合成
Abstract:Hydroxymethyltransferase(SHMT)and tryptophanase(TPase)are key enzymes in biosynthesis of L-tryptophan.We constructed three recombinant plasmids, including pET-SHMT, pET-TPase, and pET-ST for over-expression or co-expression of SHMT and TPase inEscherichia coliBL21(DE3).The SDS-PAGE analysis showed that the recombinant proteins of 47 kDa and 50 kDa were expressed of pET-SHMT and pET-TPase, respectively.As compared to the host stain, the enzyme activity of SHMT and TPase was increased by 6.4 and 8.4 folds, respectively.Co-expression of both recombinant proteins, 47 kDa and 50 kDa, was also successful by using pET-ST and the enzyme activities were enhanced by 6.1 and 6.9 folds.We designed two pathways of dual-enzymatic synthesis of L-tryptophan by using these recombinant strains as source of SHMT and TPase.In the first pathway, the pET-SHMT carrying strain was used to catalyze synthesis of L-serine, which was further transformed into L-tryptophan by the pET-TPase expressing strain.These two steps sequentially took place in different bioreactors.In the second pathway, the pET-STcarrying strain, in which two enzymes were co-expressed, was used to catalyze simultaneously two steps in a single bioreactor.HPLC analysis indicated a high yield of 41.5 g/L of L-tryptophan was achieved in the first pathway, while a lower yield of 28.9 g/L was observed in the second pathway.In the first pathway, the calculated conversion rates for L-glycine and indole were 83.3% and 92.5%, respectively.In the second pathway, a comparable conversion rate, 82.7%, was achieved for L-glycine, while conversion of indole was much lower, only 82.9%.
Keywords:hydroxymethyltransferase, tryptophanase, co-expression, dual-enzymatic synthesis
L-色氨酸是人和动物重要的必需氨基酸,在医药、食品和饲料添加剂等方面具有广泛的用途。它是我国目前尚未实现工业化生产的少数几种氨基酸之一,每年需要大量进口。L-色氨酸生产方法有提取法、化学合成法、微生物发酵法和酶促转化法。其中,前 3种方法存在材料来源有限、需多步合成工艺和光学拆分以及得率低、周期长等缺点,而酶促转化法具有终产物积累量高、反应周期短、分离提纯容易等优点,是廉价生产L-色氨酸有效的方法[1-2]。以L-丝氨酸和吲哚为原料的酶法途径,是酶法生产L-色氨酸的一条重要途径[3],其主要缺陷是 L-丝氨酸价格贵,与L-色氨酸价格几乎相当。若能以廉价的原料生产丝氨酸,再以所得到的丝氨酸为原料生产 L-色氨酸,则可望实现 L-色氨酸的廉价生产。Hatakeyama等[4]报道了两步酶法合成L-色氨酸:以价廉的甘氨酸和甲醛为原料,在丝氨酸羟甲基转移酶的作用下,将甘氨酸和甲醛转化为L-丝氨酸;再在色氨酸酶的作用下,添加吲哚,则L-丝氨酸可转变为 L-色氨酸。在国内,韦平和等[5]也提出了两步酶法合成L-色氨酸。但Hatakeyama等所用的酶来自两种微生物细胞,增加了生产工艺的复杂性和成本。迄今未见单一细胞同时生产丝氨酸羟甲基转移酶和色氨酸酶,并用于酶法生产L-色氨酸的报道。
本研究构建单表达SHMT基因工程菌、单表达TPase基因工程菌、共表达SHMT和TPase基因工程菌。利用构建的3种基因工程菌株,进行两菌两次发酵产酶和单菌一次发酵产酶。采用双菌双酶法和单菌双酶法两种途径完成酶法合成L-色氨酸,对两种酶法合成途径进行比较,以期达到简化产酶菌的发酵和酶促转化工艺,降低L-色氨酸生产成本,为实现L-色氨酸的工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株
pET-28a表达载体、大肠杆菌 K12、大肠杆菌BL21(DE3)为本实验室保存。
1.1.2 生化试剂
限制性内切酶、T4 DNA连接酶及PyrobestTMDNA聚合酶均购自宝生物工程(大连)有限公司;质粒小量提取试剂盒、PCR产物回收试剂盒、细菌基因组提取试剂盒及琼脂糖凝胶回收试剂盒购自上海捷瑞生物工程有限公司;丙烯酰胺(Acr)及甲叉双丙烯酰胺(Bis)购自 Fluka公司;四甲基乙二胺(TEMED)及磷酸吡哆醛(PLP)购自Sigma公司;四氢叶酸为本实验室自制(硼氢化钠还原法[6]);其他试剂均为国产分析纯。
1.1.3 仪器
高效液相色谱仪(安捷伦 1200 HPLC);泵(安捷伦 1100/1200四元泵);检测器(安捷伦1200可变波长检测器)。
1.2 方法
1.2.1 基因的PCR扩增
PCR引物由上海生工生物工程技术服务有限公司合成。引物序列见表1。
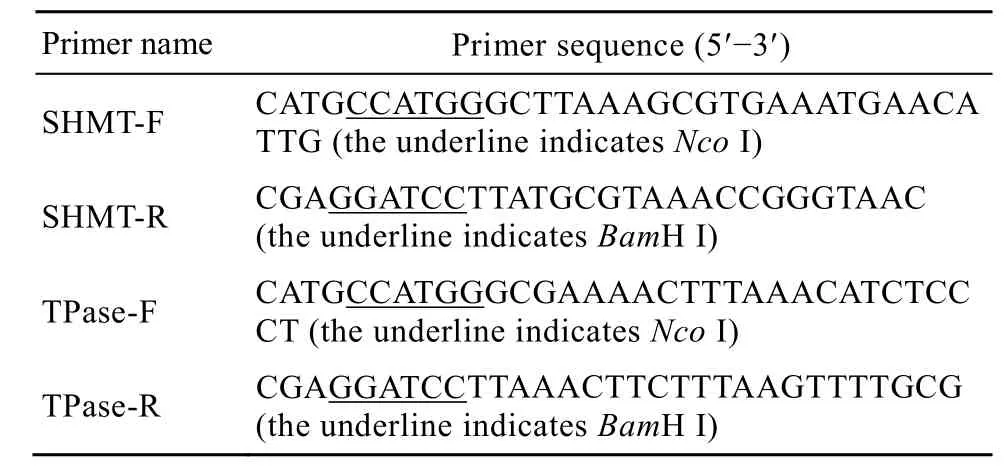
表1 PCR引物序列Table 1 PCR primer sequence
PCR 反应体系(50 μL):无菌三蒸水 40 μL,10×Buffer 5 μL,上、下游引物各 1 μL,模板 1 μL,dNTPs 1 μL,PyrobestDNA 聚合酶 1 μL。两基因 PCR 反应条件均为:94℃预变性5 min;94 ℃ 1 min ,53℃1 min,72 ℃ 2 min ,30个循环;72℃延伸10 min。
1.2.2 表达载体的构建
将PCR扩增到的编码SHMT和TPase的基因分别连接到 pET-28a载体上,构建单表达重组质粒pET-SHMT和pET-Tpase,再利用以上两个重组质粒构建共表达重组质粒pET-ST。PCR产物纯化和凝胶回收按试剂盒说明书进行操作,基因的酶切和连接按所用酶的商品说明书进行操作。
1.2.3 重组工程菌的诱导及酶活测定
将重组质粒转入大肠杆菌 BL21(DE3),构建基因工程菌。利用重组菌进行发酵产酶(方法参照pET操作手册),采用聚丙烯酰胺凝胶电泳(SDS-PAGE)分析蛋白表达情况[7],并对重组工程菌所产酶进行酶活测定(SHMT和 TPase酶活测定方法参照文献[8]和[9])。
1.2.4 双菌双酶法合成L-色氨酸
酶促反应以0.1 mol/L磷酸缓冲液(pH 8.0)作为溶剂,反应在500 mL四颈烧瓶中进行,反应液体积为350 mL,其中加入30 g经0.1%(W/V)十六烷基三甲基溴化铵(CTAB)裂解液处理过的产SHMT的菌体,30 g甘氨酸,10 mg PLP,0.5 g四氢叶酸,同时向反应液中加入适量巯基乙醇,并通氮气以免辅酶四氢叶酸被氧化[10-11]。反应温度37℃,初始pH为7.5,搅拌速度60 r/min。另一底物甲醛初始加入的浓度控制在20 mmol/L以下,此后以流加的方式加入甲醛,维持反应液pH控制在 6.8~7.2。当反应液pH不变化时,反应达到平衡,停止反应。离心弃菌体,将上述反应液装入另一反应罐,并向其中加入30 g经同样方法破碎处理的产TPase的菌体,9 g吲哚,5 mg PLP,200 μL TritonX-100,反应pH调节到8.8,反应温度37℃,搅拌速度60 r/min[5]。反应进行时每隔 6 h检测一次反应液中吲哚浓度(采用对二甲氨基苯甲醛作为显色剂,进行光度定量测定[12]),当吲哚浓度不再变化时停止反应。
1.2.5 单菌双酶法合成L-色氨酸
参考双菌双酶法反应条件,将经破碎处理的产双酶的菌体、甘氨酸、吲哚、PLP等原料一次性加入同一反应罐。为使主要反应底物甘氨酸和吲哚能被充分利用,并得到一定累积量的L-色氨酸,实验设计 3组甘氨酸和吲哚加入量,分别为甘氨酸+吲哚:① 20 g+5 g;② 25 g+7 g;③ 30 g+9 g,辅酶等其余原料的量同比例增减。反应体积仍为350 mL。整个反应过程中通氮气,反应温度 37℃,初始 pH为7.5,搅拌速度60 r/min,同样以流加的方式加入甲醛维持反应液 pH控制在 6.8~7.2。当反应液 pH不再变化以后,每隔2 h检测反应液中吲哚浓度。当反应液中吲哚浓度不再变化时,终止反应。
1.2.6 高效液相测定L-色氨酸含量
采用安捷伦1200系列安捷伦 C-18反相硅胶柱(5 μm;4.6 mm×250 mm);流动相:甲醇∶1%冰乙酸= 10∶90;柱流量:1 mL/min;柱温:30℃;可变波长扫描紫外检测器(VWD),检测波长为280 nm[3]。
2 结果
2.1 重组质粒pET-SHMT和pET-TPase的构建
提取大肠杆菌K12基因组,PCR分别扩增编码SHMT的基因和TPase的基因,结果见图1。
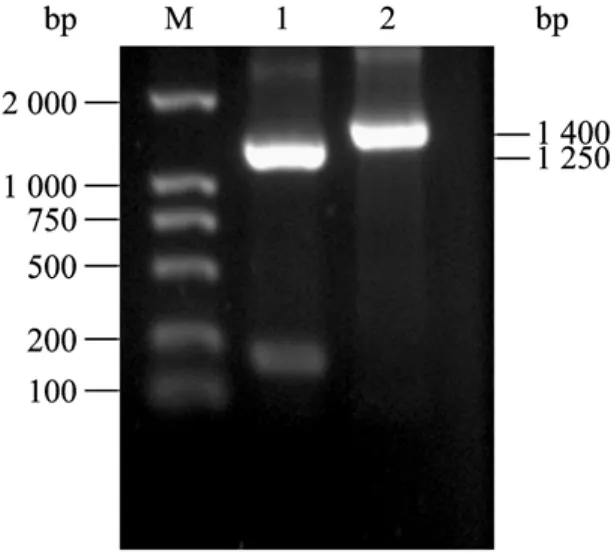
图1 PCR扩增编码SHMT和TPase的基因Fig.1 Amplification of gene coding SHMT and gene coding TPase by PCR.M: DNA marker DL2000; 1: PCR product of gene coding SHMT; 2: PCR product of gene coding TPase.
扩增产物与预计大小相符。回收PCR产物,经NcoI和BamH I双酶切,分别连接到经同样双酶切的 pET-28a上,构建两个重组质粒 pET-SHMT和pET-TPase,重组质粒构建过程见图2。用BglII/Hind III双酶切鉴定两个重组质粒,酶切结果见图3。酶切产生两条带,分子量大的与经酶切后的pET-28a条带大小一致;分子量小的为含有T7启动子和相应基因的DNA片段,较各自基因的PCR产物分子量大。经酶切鉴定的重组质粒由上海生工生物工程技术服务有限公司测序,测序结果与报道的序列(GenBank Accession No.NC_000913)一致。
2.2 SHMT和TPase共表达重组质粒pET-ST的构建
将已构建的质粒pET-TPase经BglII和Hind III双酶切,并回收含T7启动子和TPase基因的DNA片段。用BamH I和Hind III双酶切质粒pET-SHMT,回收酶切质粒,并与含 T7启动子和 TPase基因的DNA片段相连,构建共表达重组质粒 pET-ST,共表达重组质粒构建过程见图2。
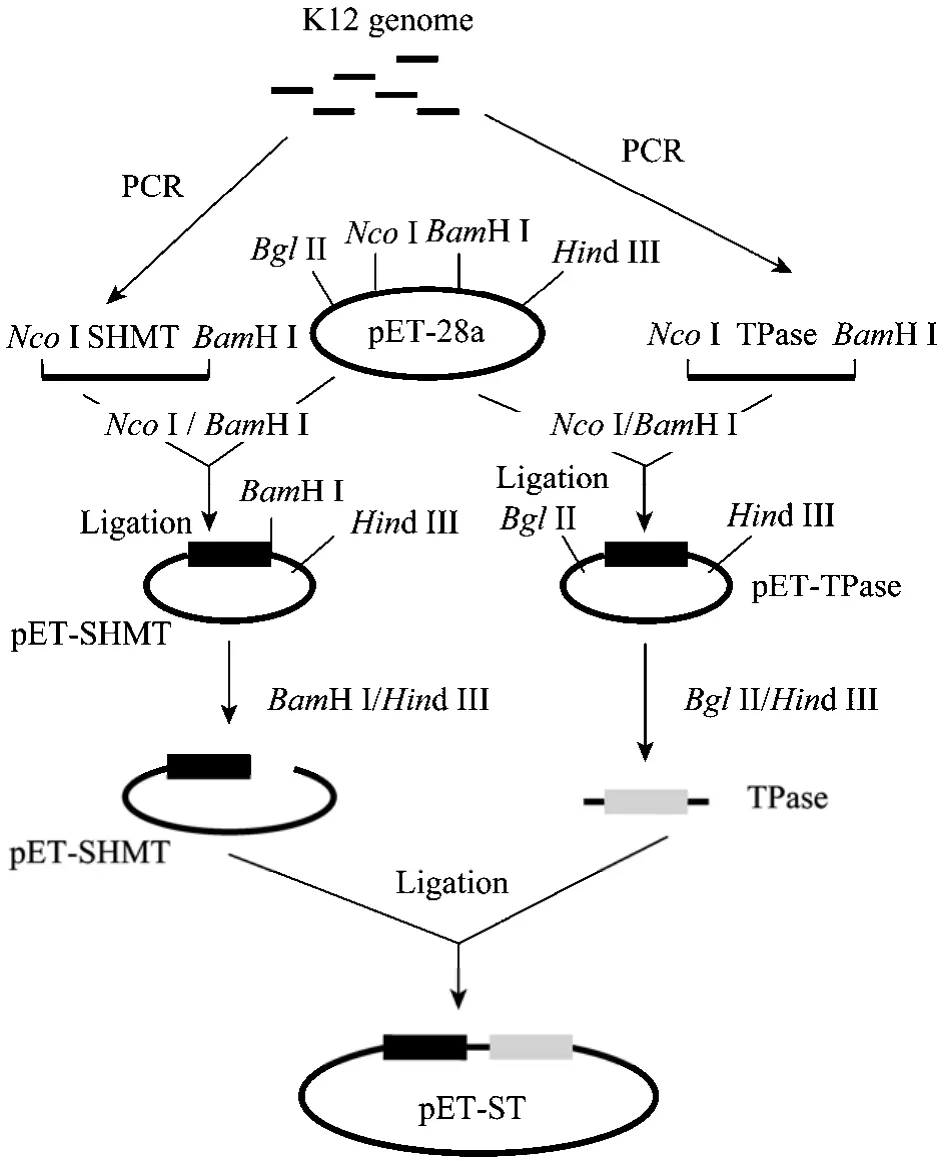
图2 pET-SHMT、pET-TPase和 pET-ST重组质粒的构建Fig.2 Construction of recombinant plasmids pET-SHMT,pET-TPase and pET-ST.
共表达质粒上SHMT和TPase的表达由各自的T7启动子控制。用BglII和Hind III双酶切鉴定重组质粒pET-ST,双酶切结果见图3,酶切产生的两条带,分子量大的条带对应经酶切后的 pET-28a片段;小片段的大小相当于含T7启动子的SHMT片段和含T7启动子的TPase片段之和,表明共表达质粒构建成功。
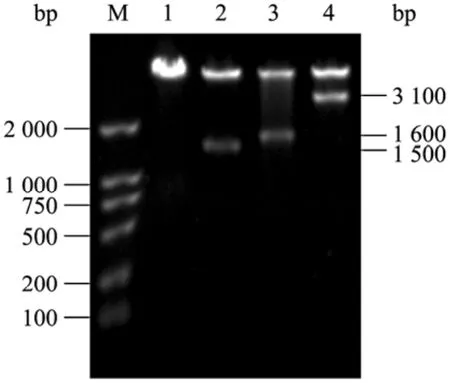
图3 酶切鉴定 3个重组质粒 pET-SHMT、pET-TPase和pET-STFig.3 Identification of pET-SHMT, pET-TPase and pET-ST recombinant plasmids.M: DNA marker DL2000; 1: digestion of plasmid pET-28a byBglII/Hind III; 2: digestion of plasmid pET-SHMT byBglII/Hind III; 3: digestion of plasmid pET-TPase byBglII/Hind III; 4: digestion of plasmid pET-ST byBglII/Hind III.
2.3 重组基因工程菌的诱导表达及酶活测定
挑取带有空载体的宿主菌 BL21(DE3)/pET-28a及 3种基因工程菌 BL21(DE3)/pET-SHMT、BL21(DE3)/pET-TPase和BL21(DE3)/pET-ST,分别接种到装有20 mL LB的100 mL三角瓶中,培养基中加入50 μg/mL卡那霉素(Kan),37℃培养过夜。按1%接种量接入装有50 mL LB的250 mL三角瓶中,37℃培养到OD600至 0.8~1.0,加入 IPTG 至终浓度为1 mmol/L。诱导6 h后,测定3种重组菌所产酶的活力。
将诱导6 h的2 mL细菌培养液离心获菌体,水洗涤一次后加入1 mL CTAB裂解缓冲液(含0.1%CTAB、0.1 mol/L磷酸缓冲液(pH 8.0))悬浮菌体,37℃温浴30 min,离心取上清,将上清样品和诱导6 h的全菌样品进行SDS-PAGE电泳对比分析,结果见图4所示。
从全菌电泳结果可见,诱导 6 h后,单表达基因工程菌BL21(DE3)/pET-SHMT和BL21(DE3)/pETTPase分别在分子量 47 kDa(SHMT)和 50 kDa(TPase)处有蛋白表达带;共表达基因工程菌BL21(DE3)/pET-ST在上述两处位置均有蛋白表达带。上清样品的电泳结果表明,3种基因工程菌诱导表达的可溶性目的蛋白量占各自上清液中蛋白总量的50%以上,相比全菌中诱导表达目的蛋白的量则较少,表明诱导产生蛋白大多以包涵体形式存在。共表达基因工程菌中可溶性SHMT和TPase的蛋白量略低于单表达SHMT和单表达TPase的可溶性蛋白量。
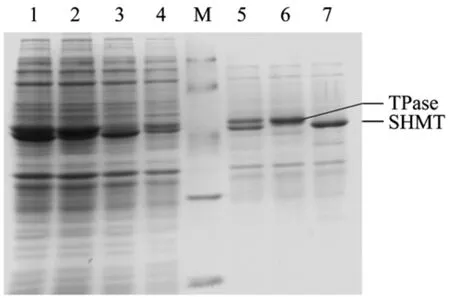
图4 SDS-PAGE电泳分析目的蛋白在重组菌中的表达及其可溶性Fig.4 SDS-PAGE analysis of protein expression and solubility in recombinant strains.M: protein molecular weight markers(20.1, 29.0, 44.3, 66.4, 97.2 kDa); 1: BL21(DE3)/pET-ST; 2: BL21(DE3)/pET-TPase; 3: BL21(DE3)/pET-SHMT;4: BL21(DE3)/pET-28a; 5: soluble proteins of SHMT and TPase in BL21(DE3)/pET-ST; 6: soluble proteins of TPase in BL21(DE3)/pET-TPase; 7: soluble proteins of SHMT in BL21(DE3)/pET-SHMT.
对带有空载体的宿主菌和3种基因工程菌进行酶活力测定,结果见图5。携带空载体的宿主菌BL21(DE3)/pET-28a,两种单表达基因工程菌BL21(DE3)/pET-SHMT,BL21(DE3)/pET-Tpase和共表达基因工程菌BL21(DE3)/pET-ST的SHMT酶活(U/mL)分别为 34.3、220.7、35.1、210.2;Tpase 酶活(U/mL)分别为13.5、12.8、113.7、93.5。相比携带空载体的宿主菌,两种单表达基因工程菌 SHMT和TPase酶活分别提高了6.4倍和8.4倍;共表达基因工程菌的SHMT酶活和TPase酶活分别提高了6.1倍和6.9倍。
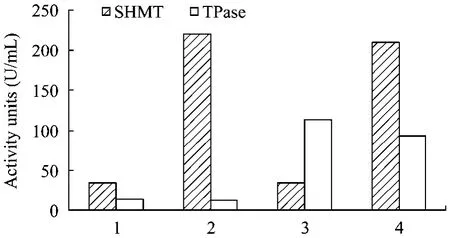
图5 对照菌株、单表达及共表达基因工程菌株SHMT、TPase酶活比较Fig.5 Activity of the enzymes SHMT, TPase in different strains.1: BL21(DE3)/pET-28a; 2: BL21(DE3)/pET-SHMT; 3:BL21(DE3)/pET-TPase; 4: BL21(DE3)/pET-ST.
2.4 双菌双酶法合成L-色氨酸
转化反应分为两步在两个反应罐中进行,第 1步反应合成L-丝氨酸,反应进行45 h达到平衡,消耗甲醛溶液(甲醛含量40%)约25 mL(25.4 g)。甲醛溶液以流加的方式加入,设定pH高于7.2开始流加甲醛,pH低于6.8停止流加。加入甲醛后,反应液pH降低,甲醛逐渐消耗后,反应液pH缓慢回升。当反应液pH持续在6.8左右不再回升,则反应达到平衡。以此方式加入甲醛,其残留量很低,消耗的甲醛全部用于合成L-丝氨酸,以此计算甘氨酸的转化率为83.3%。第2步,将L-丝氨酸合成反应液转移到另一反应罐中,加入吲哚,在 TPase催化下合成 L-色氨酸,反应进行 48 h,高效液相测定 L-色氨酸的累积量为41.5 g/L。计算得到吲哚转化率为92.5%。
2.5 单菌双酶法合成L-色氨酸
利用共表达基因工程菌产两种酶,使两步合成反应在同一反应罐中同时进行。3组实验结果见表2。
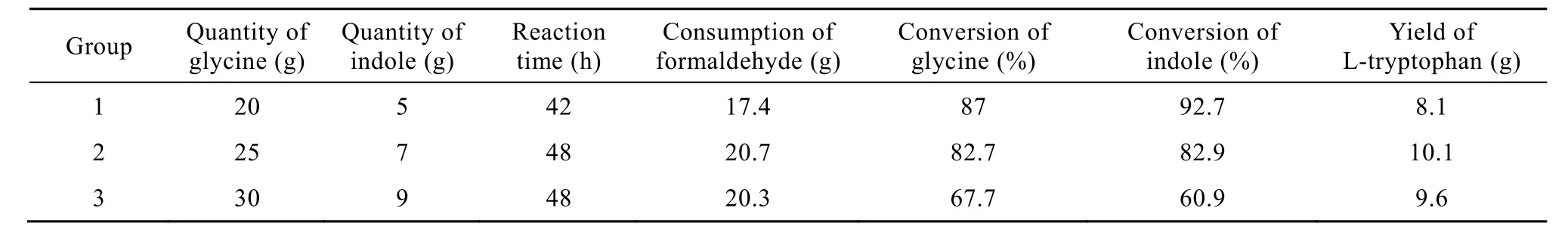
表2 原料甘氨酸和吲哚在不同投料量下单菌双酶法合成L-色氨酸Table 2 Dual-enzymatic synthesis of L-tryptophan at different quantities of two substrates of glycine and indole
第1组实验甘氨酸和吲哚加入量少,等体积条件下底物浓度相对较低,在加入相同菌体量的条件下,两种底物的转化率高,但L-色氨酸的累积量低于其他两组。第2组和第3组实验在反应时间、甲醛消耗量和L-色氨酸的累积量上相差甚少,但两种底物的转化率相差大,推测第3组实验的底物加入过量,加入原料未被酶充分利用。第 2组实验的原料转化率和产物累积量均较高,其最终的L-色氨酸的累积量为28.9 g/L,故该组实验的原料加入量为最适。相比双菌双酶法,单菌双酶法在反应时间上缩短45 h,成本更节省,但L-色氨酸的累积量略低。
3 讨论
以L-丝氨酸和吲哚为原料合成L-色氨酸的途径是酶法生产L-色氨酸的重要途径,该途径主要缺陷是L-丝氨酸价格贵,与L-色氨酸价格几乎相当。SHMT可利用廉价的甘氨酸和甲醛合成L-丝氨酸,克服了这一缺陷。催化这一酶促反应的除了色氨酸酶,还有色氨酸合成酶。尽管色氨酸合成酶动力学特征明显优于色氨酸酶,但原料之一的吲哚对其有强烈的抑制作用,而色氨酸酶对吲哚具有良好的稳定性。因此,本研究选择SHMT和TPase两种酶,构建单表达SHMT基因工程菌、单表达TPase基因工程菌和共表达SHMT和TPase基因工程菌。一般认为,多基因在质粒上共表达比单独表达时活性会降低。从本实验结果来看,串联在前的SHMT与单独表达时相比酶活基本持平;串联在后的 TPase尽管酶活不如单表达高,但与宿主菌相比提高6.9倍。单表达的表达量要显著高于共表达,但蛋白在表达量较高的情况下,部分蛋白形成没有活性包涵体,往往活性的大小与表达量之间呈非线性关系。
本研究所采用双酶法合成L-色氨酸最大优势在于,合成L-丝氨酸后不经过分离、精制等步骤,直接用于L-色氨酸的合成,降低了成本。我们设计了两种双酶法合成L-色氨酸的途径:双菌双酶法和单菌双酶法。采用双菌双酶法合成L-色氨酸,由于两种酶分别由两种重组菌进行表达,其表达的可溶性蛋白量和所产生的酶的活性都要优于两种酶共表达。此途径中两步酶促反应前后分开进行,每步反应都可以在酶最适合的条件下进行,前后两步反应不会互相影响,但反应的时间相对较长,而且反应过程中需要离心、更换反应罐等步骤,增加了成本。实验结果显示,利用此途径合成L-色氨酸,底物的转化率和产物累积量较高,从高效液相结果可知反应副产物很少。针对双菌双酶法途径,今后我们需要对两种酶的最佳反应条件(包括反应的温度、pH和原料用量等方面)作进一步优化,完善双菌双酶法的工艺,期望能提高L-色氨酸产量。单菌双酶法的优势在于可大幅缩短产酶和酶促反应的时间,且共表达基因工程菌所产两种酶的酶活并不低。但实验结果显示此途径合成L-色氨酸的积累量远低于双菌双酶法,分析原因可能是在同一环境中反应,需要兼顾两种酶的反应条件,使两者都无法达到最高的原料利用率。因此,单菌双酶法合成L-色氨酸工艺条件仍需继续探究,包括提高两种酶在同一重组菌中的表达量和酶活性,以及在合成反应过程中使两种酶同时达到相对最佳的活性,以期获得更高的原料转化率和产物累积量。
REFERENCES
[1]Zhao CG, Cheng LK, Xu QY,et al.Advance in microbial fermentation for production of L-tryptophan.Lett Ferment Technol, 2008, 4(37): 34−36.赵春光, 程立坤, 徐庆阳, 等.微生物法生产 L-色氨酸的研究进展.发酵科技通讯, 2008, 4(37): 34−36.
[2]Kawasaki K, Yokota A, Tomita F.L-Tryptophan production by a pyrucic acid-producingEscherichia colistrain carrying theEnterobacter aerogenestryptophanase gene.J Ferment Bioeng, 1996, 82(6): 604−606.
[3]Mateus DMR, Alves SS, Fonseca MMRD.Kinetics of L-tryptophan production from indole and L-serine catalyzed by whole cells with tryptophanase activity.J Biosci Bioeng, 2004, 97(5): 289−293.
[4]Hatakeyama K, Goto M, Terasawa M,et al.Process for the preparation of L-tryptophan: US, 5776740.1998-07-07.
[5]Wei PH, Wu WT, Wang M.Enzymatic synthesis of L-tryptophan by tryptophanase expressed in genetic engineering strain.Chin J Mod Appl pharm, 1999, 16(6):37−39.韦平和, 吴梧桐, 王旻.色氨酸酶基因工程菌酶法合成L-色氨酸.中国现代应用药学, 1999, 16(6): 37−39.
[6]Sun J, Wu WT, Chen ZH.Synthesis of coenzyme THFA and determination of its relative activity.Pharm Biotechnol, 2000, 7(1): 38−41.孙进, 吴梧桐, 陈志宏.辅酶四氢叶酸的合成及其活力测定.药物生物技术, 2000, 7(1): 38−41.
[7]Sambrook J, Fritsch EF, Maniatis T.Molecular Cloning: A Laboratory Manual.2nd ed.New York: Cold Spring Harbor Laboratory Press, 1989: 908−938.
[8]Cai YY, Wu WT, Shi YD.Construction and high-rate expression of SHMT genetic bacteria.Chin J Biotech,1996, 12: 28−33.蔡宇晹, 吴梧桐, 史燕东.SHMT基因工程菌的构建及高效表达.生物工程学报, 1996, 12: 28−33.
[9]Wei PH, Wu WT, Zhang YB.Molecular cloning and expression of trytophanase gene ofEscherichia coli.J China Pharm Univ, 1999, 30(2): 139−142.韦平和, 吴梧桐, 张玉彬.大肠杆菌色氨酸酶基因的克隆与表达.中国药科大学学报, 1999, 30(2): 139−142.
[10]Chen ZH, Wu WT, Xiang B,et al.The activity assay of recombined SHMT and the optimaization of the enzymatic reaction.Pharm Biotechnol, 1998, 5(2): 75−79.陈志宏, 吴梧桐, 项冰, 等.重组丝氨酸羟甲基转移酶活性测定及酶促反应条件的优化研究.药物生物技术,1998, 5(2): 75−79.
[11]Hsiao HY, Wei T, Campell K.Enzymatic production of L-Serine.Biotechnol Bioeng, 1986, 28(6): 857−867.
[12]Hu YH, Ouyang PK, Yang WG.A spectrophotometric method for the determination of indole with p-dimethylaminobenzaldehyde.Chin J Anal Chem, 1994,22(10): 1083.胡永红, 欧阳平凯, 杨文革.对二甲氨基苯甲醛光度法测定吲哚.分析化学, 1994, 22(10): 1083.
Construction of co-expression SHMT and TPase recombinant vector and dual-enzymatic synthesis of L-tryptophan
Xin Li, Jun Liu, Qinqin Zhao, and Aicai Xu
College of Biological and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China
Received:November 18, 2009;Accepted:June 7, 2010
Supported by:Educational Commission of Hubei Province of China(No.D200718002).
Corresponding author:Jun Liu.Tel: +86-27-83956793; E-mail: Junliu85@yahoo.com.cn湖北省教育厅重点项目(No.D200718002)资助。

