外源添加代谢中间体对产琥珀酸放线杆菌厌氧发酵制备丁二酸的影响
黄秀梅,姜岷,李建,郑晓宇,杨卓娜,方晓江,叶贵子
南京工业大学生物与制药工程学院 材料化学工程国家重点实验室,南京 210009
外源添加代谢中间体对产琥珀酸放线杆菌厌氧发酵制备丁二酸的影响
黄秀梅,姜岷,李建,郑晓宇,杨卓娜,方晓江,叶贵子
南京工业大学生物与制药工程学院 材料化学工程国家重点实验室,南京 210009
考察了外源添加中间代谢产物对菌体生长及发酵产酸的影响,结果表明添加 0.5 g/L磷酸烯醇式丙酮酸(PEP)时丁二酸产量最高。围绕产琥珀酸放线杆菌NJ113厌氧发酵产丁二酸的代谢网络进行代谢通量分析,发现添加PEP后己糖磷酸途径(HMP)与糖酵解途径(EMP)的通量比由39.4∶60.3提高至76.8∶22.6,解决了丁二酸合成过程中还原力不足的矛盾,导致PEP生成草酰乙酸的通量提高了23.8%,丁二酸代谢通量从99.8 mmol/(g DCW·h)增至124.4 mmol/(g DCW·h),而副产物乙酸及甲酸的代谢通量分别降低了22.9%、15.4%;关键酶活分析结果表明,添加0.5 g/L PEP后PEP羧化激酶比酶活达到1910 U/mg,与对照相比提高了74.7%,而丙酮酸激酶的比酶活降低了67.5%。最终丁二酸浓度为29.1 g/L,收率达到76.2%,比未添加PEP时提高了11.0%。
产琥珀酸放线杆菌,丁二酸,代谢通量分析,中间代谢产物,酶活
Abstract:We investigated the effect of adding intermediate metabolites on cell growth and succinate production.The yield of succinic acid achieved to the highest when 0.5 g/L phosphoenolpyruvic acid(PEP)was added.According to the metabolic network ofActinobaccilus succinogenesNJ113, the metabolic flux was calculated by metabolic flux analysis.The ratio of hexose monophosphate pathway to glycolytic pathway increased from 39.4:60.3 to 76.8:22.6 after adding 0.5 g/L PEP, thus the reducing power was better balanced.The flux of PEP to oxaloacetate was 23.8% higher, which made the succinic acid flux improve from 99.8 mmol/(g DCW·h)to 124.4 mmol/(g DCW·h)and the flux of acetic acid and formic acid decreased by 22.9% and 15.4%,respectively.The key enzyme activity analysis showed that the specific activity of PEP carboxykinase reached to 1910 U/mg with 0.5 g/L PEP addition, which was 74.7% higher than the control; and the specific activity of pyruvate kinase decreased by 67.5%.Finally, the concentration of succinic acid was 29.1 g/L with the yield of 76.2%.
Keywords:Actinobaccilus succinogenes, succinic acid, metabolic flux analysis, intermediate metabolite, enzyme activity
丁二酸(又名琥珀酸)作为TCA循环的中间代谢产物以及厌氧代谢的终端还原产物,广泛存在于动物、植物以及微生物中[1-2]。传统的生产方法是石化法,其污染大、成本高,严重抑制了丁二酸作为大宗化学品的发展潜力。随着生物工程技术的迅速发展和成熟,生物法生产丁二酸由于其高效率、环保性以及原料的可再生性而引起许多研究者的注意[3-4]。
近年来,基于途径分析及代谢流分析的调控手段非常普遍[5]。潘军华等[6]通过添加醋酸盐、生物素、泛酸盐等对 FP094菌株中由磷酸烯醇式丙酮酸(PEP)、丙酮酸(PYR)和草酰乙酸(OAA)构成的“三角区”进行扰动,定性分析了此扰动对赖氨酸合成所需前提物代谢流量的调节机制,从而提高赖氨酸的产量。王帅等[7]在谷氨酸发酵研究中,发现添加少量乳酸会促进丙酮酸含量的增加,而丙酮酸是谷氨酸的前提物质,最终谷氨酸产量提高15%。刘立明等[8]研究了添加TCA循环中间产物可以促进光滑球拟酵母CCTCC M202019生长及积累丙酮酸的影响,得出OAA更能促进细胞的生长,丙酮酸得率及生产强度分别提高6%和24%。
生物法制备丁二酸的过程主要是将 EMP途径中得到的PEP经由TCA循环的还原支路,通过一步CO2固定和两步还原反应生成丁二酸。该过程涉及的关键酶主要有磷酸烯醇式丙酮酸羧化激酶、苹果酸脱氢酶、富马酸酶和富马酸还原酶。McKinlay等[9]利用13C原子标记分析代谢中间产物中的同位素位置研究丁二酸的代谢途径,结果表明PEP是代谢过程中的一个重要节点,它将整个代谢流分配到两个支路:一部分PEP生成OAA,继而生成丁二酸,称作 C4支路;另一部分 PEP生成 PYR,进而生成乙酸、甲酸等副产物,称作C3支路。同时,草酰乙酸和苹果酸(MAL)可经脱羧反应生成丙酮酸,使代谢流在 C4和 C3支路间进行重新分配。因此,除PEP外,OAA、MAL和PYR也是代谢流分配中的重要节点。
目前,通过添加少量代谢中间体对丁二酸代谢途径进行扰动的研究在国内外还未见报道。本研究主要从代谢通量分析角度,考察添加少量代谢中间产物(如PEP、PYR等)对产琥珀酸放线杆菌NJ113代谢通量分布及关键节点的影响,并结合关键酶酶活分析说明其影响机理,为优化发酵过程控制提供参考。
1 材料与方法
1.1 菌种
产琥珀酸放线杆菌Actinobacillus succinogenesNJ113由本实验室自主筛选并保存。
1.2 培养基
种子培养基(g/L):葡萄糖 10(分消),酵母膏5,NaHCO310,NaH2PO4·2H2O 9.6,K2HPO4·3H2O 15.5,pH 7.0,121℃灭菌 15 min。
发酵培养基(g/L):葡萄糖 40(分消),酵母膏10,玉米浆 10,乙酸钠 1.36,KH2PO43,MgCl2·6H2O 0.2,CaCl20.2,NaCl 1,Na2HPO4·12H2O 0.31,NaH2PO4·2H2O 1.6,pH 7.0,121℃灭菌 15 min(摇瓶培养需加20 g/L碳酸镁)。
1.3 培养方法
种子采用100 mL血清瓶培养,装液量50 mL,接种量 2%(种子是相同条件下活化后的培养物),于37℃、180 r/min摇床中培养11 h;血清瓶发酵培养装液量 30 mL,接种量 3%,通无菌 100% CO2直至pH 6.8~7.0,摇床转速180 r/min,在37℃下培养 20 h;3 L 发酵罐(BioFlo 110 fermenter,NBS)装液量1.5 L,接种量7%,300 g/L Na2CO3控制过程pH 6.8,于 37℃、搅拌转速 200 r/min、100% CO2(通气量0.5 L/min)条件下培养。
1.4 分析方法
1.4.1 细胞干重测定
称出干燥10 mL离心管重量(G1),取4 mL发酵液置于离心管中,10 000 r/min离心5 min,弃上清液;再用4 mL蒸馏水清洗2次,离心,于60℃烘箱中干燥至恒重后称重(G2),则菌体干重(g/L)=(G2−G1)/4。
1.4.2 葡萄糖、乙醇及有机酸的测定
采用高效液相色谱法(戴安 Ultimate 3000系列),色谱柱为Aminex® HPX-87H型离子排斥色谱柱(300 mm×7.8 mm id,5 μm),以 0.005 mol/L H2SO4水溶液作为流动相,流速 0.6 mL/min,进样体积20 μL,柱温55℃,葡萄糖和乙醇利用示差折光检测器检测,丁二酸、乙酸、甲酸等利用紫外检测器检测,波长为215 nm。
1.4.3 酶活的测定
细胞抽提物的制备:取30 mL稳定期的发酵液于50 mL离心管中,10 000 r/min、4℃离心10 min,弃去上清液,用5 mL 100 mmol/L Tris-HCl(pH 7.0,含有 100 mmol/L Tris,20 mmol/L KCl,5 mmol/L MnSO4,2 mmol/L DTT,100 mmol/L EDTA)溶液洗涤2次后将细胞悬浮,置于冰槽中超声破碎20 min;结束后10 000 r/min、4℃离心20 min,将上清液转入另一离心管中,保存在−80℃冰箱待用。
蛋白质浓度的测定:Bradford法[10],以牛血清白蛋白作为标准。
PEP羧化激酶(Pepck)酶活测定[11]体系:300 mmol/L Tris-HCl(pH 6.6),300 mmol/L MgCl2,150 mmol/L MnCl2,1.125 mol/L NaHCO3,12 U/mL苹果酸脱氢酶,100 mmol/L ADP·Na2,3 mmol/L NADH,150 mmol/L PEP,细胞提取液;所有底物于37℃水浴20 min,然后采用联机紫外可见分光光度计于340 nm处测定反应的初速度。
丙酮酸激酶(Pyk)酶活测定体系[12]:300 mmol/L Tris-HCl(pH 7.5),300 mmol/L MgCl2,750 mmol/L KCl, 12 U/mL 乳酸脱氢酶,100 mmol/L ADP·Na2,3 mmol/L NADH,150 mmol/L PEP,细胞提取液;所有底物于37℃水浴20 min,然后采用联机紫外可见分光光度计于 340 nm处测定反应的初速度。
苹果酸脱氢酶(Mdh)酶活测定体系[11]:400 mmol/L Tris-HCl(pH 7.2),1.2 mmol/L NADH,15 mmol/L OAA,细胞提取液;所有底物于37℃水浴20 min,然后采用联机紫外可见分光光度计于340 nm处测定反应的初速度。
酶活单位的定义:一个酶活力单位(U)定义为1 min催化1 nmol底物转化为产物的量;比活力为每mg蛋白质所含的酶活力单位数。
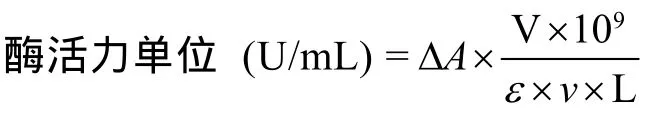
式中,ΔA为吸光度随时间的变化(min−1),V为反应体系体积(mL),ε为摩尔消光系数(NADH在 340 nm 时为 6.22×103L/(mol·cm)),v为样品量(mL),L为比色皿光径(cm),109为将 mol换算成nmol。
比活力(U/mg)=酶活力单位/蛋白浓度。
1.4.4 代谢过程及通量分析
根据相关文献[11]和[13],发酵产物以及酶活分析,建立了A.succinogenes以葡萄糖作为碳源合成丁二酸的代谢网络,主要包括糖酵解(EMP)、磷酸己糖(HMP)、C3、C4、维持消耗以及生物量的合成途径。在建立网络模型时做了以下假设和简化处理:1)细胞中的中间代谢物处于拟稳态,在整个反应中不积累;2)只考虑主要中心碳代谢反应的物流平衡;3)忽略培养基中有机氮源对细胞合成通量的贡献;4)能量供需平衡,即合成菌体与产物所需的能量和EMP、HMP产生的能量总数相等;5)在代谢过程中,由于一部分碳源用于细胞的维持、产能、CO2放出以及分泌其他一些未知的代谢产物等,造成碳源的不平衡现象,在代谢网络通量的计算时忽略该部分通量;6)A.succinogene细胞组成参考McKinlay等[9]的研究,单一化为 CH2O0.5N0.2统一处理。整个代谢网络包括 24个代谢反应方程,见表 1。
根据拟稳态假设求解通量,即假设细胞内的中间代谢物浓度变化速率为0,有Ar=X,其中,A为胞内代谢反应计量系数矩阵(n×m),r为代谢反应速率向量(m×1),X为代谢物净积累速率向量(n×1),m与n分别为反应方程和代谢中间体的个数。整个代谢网络包含24个代谢反应,其中中间代谢物为18个,自由度为6;可测速率有7个,即葡萄糖消耗速率以及丁二酸、乙酸、甲酸、乳酸、乙醇、细胞的生成速率。根据中间产物代谢平衡方程(表 2)列出矩阵A。由于可测定的速率大于自由度,该系统为超定系统,可用最小二乘法求得简单解,利用MATLAB软件线性规划求得代谢分布。在代谢通量的计算中,均以100 mmol/(g DCW·h)的葡萄糖为计算基准,所有代谢通量r的单位均为mmol/(g DCW·h)。

表1 代谢反应方程Table 1 Metabolic reactions
2 结果与讨论
2.1 外源添加中间代谢产物对发酵的影响
外源添加少量的代谢中间体可能对代谢网络中关键酶活产生影响,从而影响代谢产物的分布情况。本实验通过血清瓶发酵考察不同浓度的PEP、PYR、OAA及MAL对菌体生长及发酵产丁二酸的影响,这4种物质在培养基中的浓度范围为0~2 g/L,结果见表3。

表2 代谢通量方程Table 2 Equations of metabolic flux
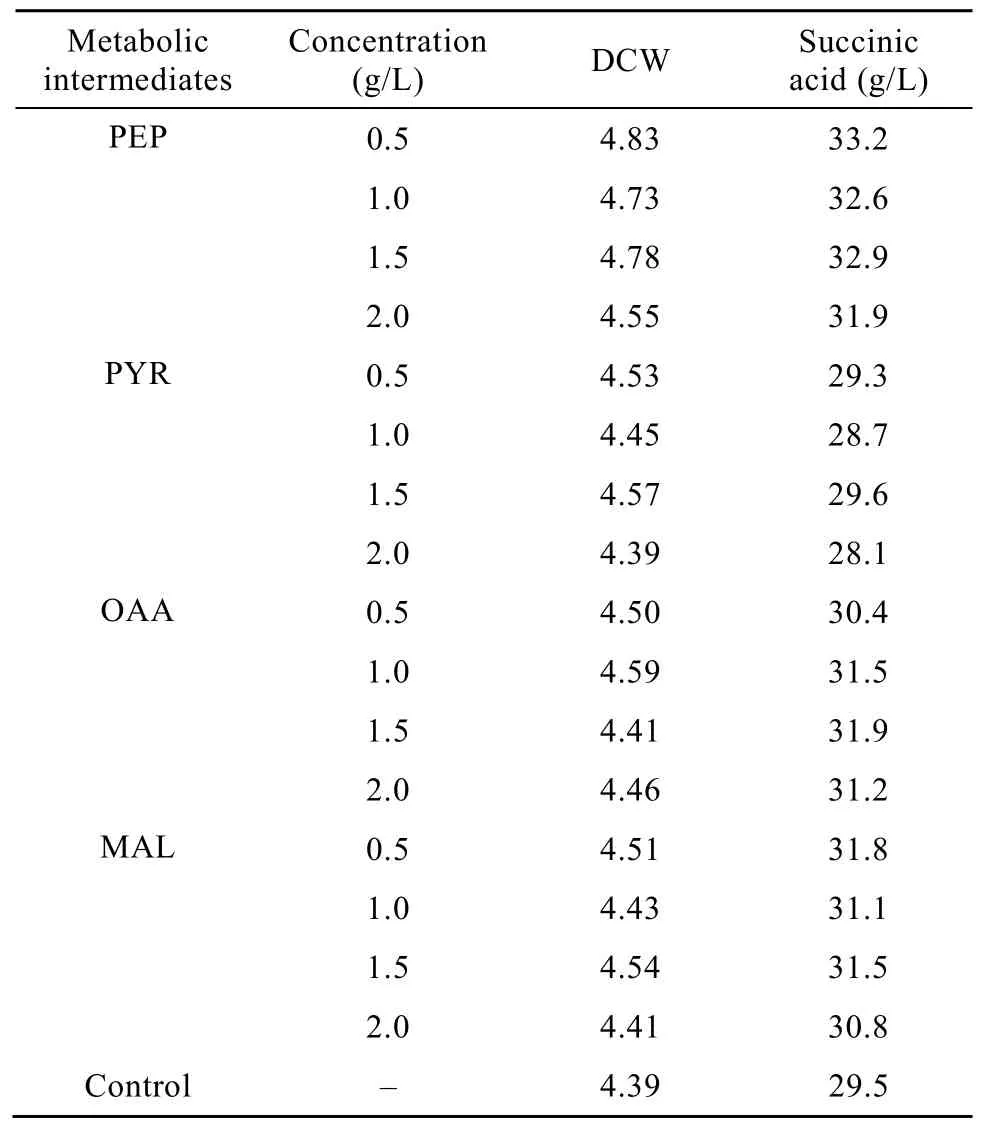
表3 添加中间代谢产物对发酵的影响Table 3 Effects of adding intermediate metabolite on succinate fermentation
由表3可知,外源添加各种中间代谢对菌体浓度及丁二酸产量都有一定的影响。添加少量 PEP、OAA以及MAL对菌体生长及产酸均有一定的促进作用,其中添加PEP的效果最好。当培养基中PEP浓度为 0.5 g/L时菌体浓度及丁二酸产量都达到最大,丁二酸收率达到83.2%,较对照提高9.3%;而继续增加 PEP浓度对菌体生长及丁二酸产量影响不明显,甚至出现下降趋势。因此,培养基中PEP的最佳添加浓度为0.5 g/L,以下实验主要考察添加0.5 g/L PEP对发酵过程的影响。
2.2 外源添加PEP对发酵结果的影响
在3 L发酵罐中考察添加0.5 g/L PEP对NJ113厌氧发酵产丁二酸的影响,结果见图1和图2。
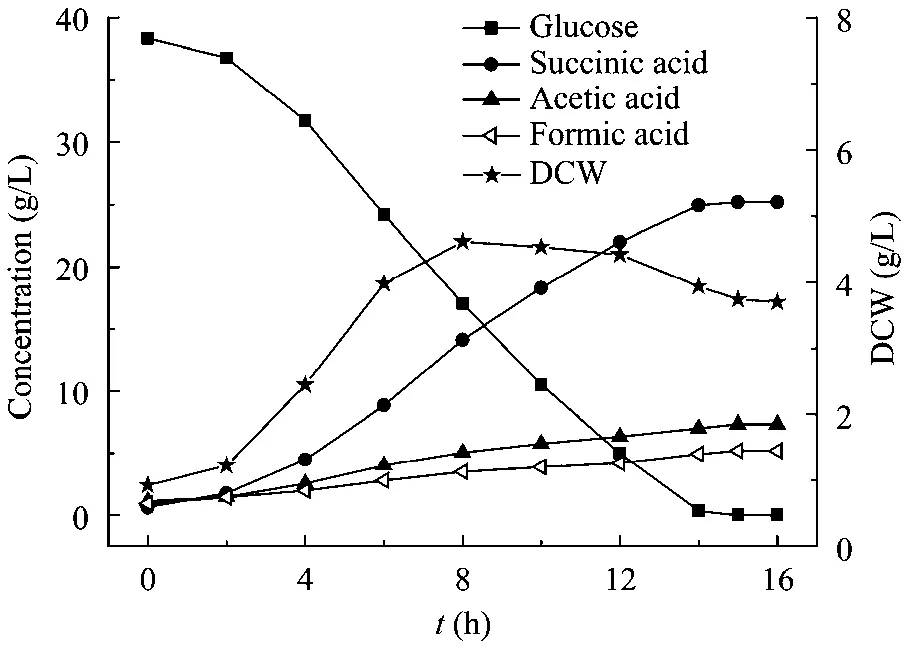
图1 不添加PEP的发酵过程曲线Fig.1 Process of succinic acid fermentation without addition of PEP.
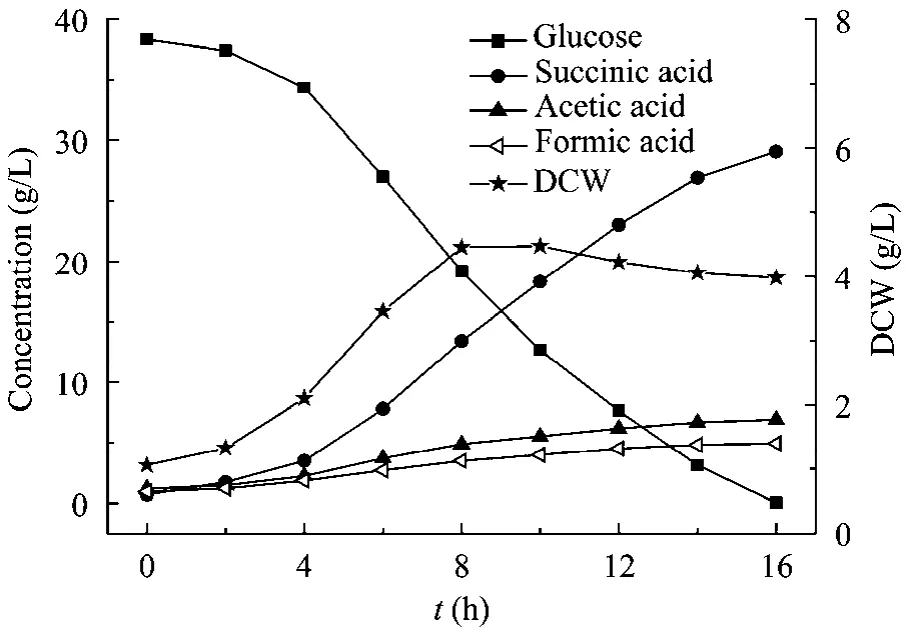
图2 添加0.5 g/L PEP的发酵结果Fig.2 Process of succinate fermentation with 0.5 g/L PEP added.
从图1、图2可以看出,添加PEP后整个发酵过程的变化趋势与对照(不添加 PEP的发酵过程)一致。菌体在2~8 h内生长最快,8 h时细胞干重达到最大,虽然较对照的略低,但其稳定期较长,衰亡速率较慢,最终丁二酸产量并没有下降,丁二酸浓度为29.1 g/L,收率达到76.2%,比未添加PEP时的 65.2%提高了 11.0%。副产物乙酸、甲酸的浓度与对照相比均有所降低。PEP作为A.succinogenesNJ113代谢途径的关键节点,少量PEP的加入可能扰乱了菌体的正常代谢,提高或降低了某些关键酶活,从而改变代谢产物的分布,最终导致丁二酸产量的提高。虽然添加PEP后发酵罐培养的丁二酸浓度较对照提高了,但是远低于摇瓶培养的水平,原因可能是发酵罐培养过程中流加的 Na2CO3溶液对发酵液产生了稀释作用,从而导致罐子的丁二酸浓度较摇瓶的低。
2.3 外源添加PEP对代谢通量分布的影响
代谢通量可以直观地反映不同途径的相互作用以及围绕代谢分支点的物质流分布,进而表征细胞的代谢能力[14]。为探讨外源添加PEP的影响机理,对A.succinogenesNJ113进行代谢通量分析。利用菌体细胞稳定且碳代谢流旺盛时(即稳定期)的培养检测参数作为代谢通量常数项,因此选择10 h、10.5 h、11 h、11.5 h、12 h取样分析发酵液中的菌体、葡萄糖、丁二酸、乙酸及甲酸的浓度,得到在11 h时的单位时间浓度变化率,并计算得到各反应(r1~rBM)的代谢通量。PEP添加与否的代谢通量分布情况如图3所示。
从图3中的通量分布情况可以看出,在发酵后期(11 h)消耗很少的碳源用于菌体的合成,添加0.5 g/L PEP的细胞合成通量与对照相比变化不大,底物葡萄糖主要用来合成产物丁二酸等。通量变化主要在通往HMP途径、C3及C4途径的摩尔通量上,其中PEP是影响丁二酸合成的关键节点,PYR是影响乙酸、甲酸等副产物生成的关键节点。添加PEP后流向C4途径的通量r13比对照提高了23.8%,丁二酸代谢通量从 99.8 mmol/(g DCW·h)增至124.4 mmol/(g DCW·h);同时,流向C3途径的通量r6有所降低,导致副产物乙酸及甲酸的代谢通量分别降低了 22.9%、15.4%,使得更多的碳源用于合成产物丁二酸,最终提高了丁二酸产量。
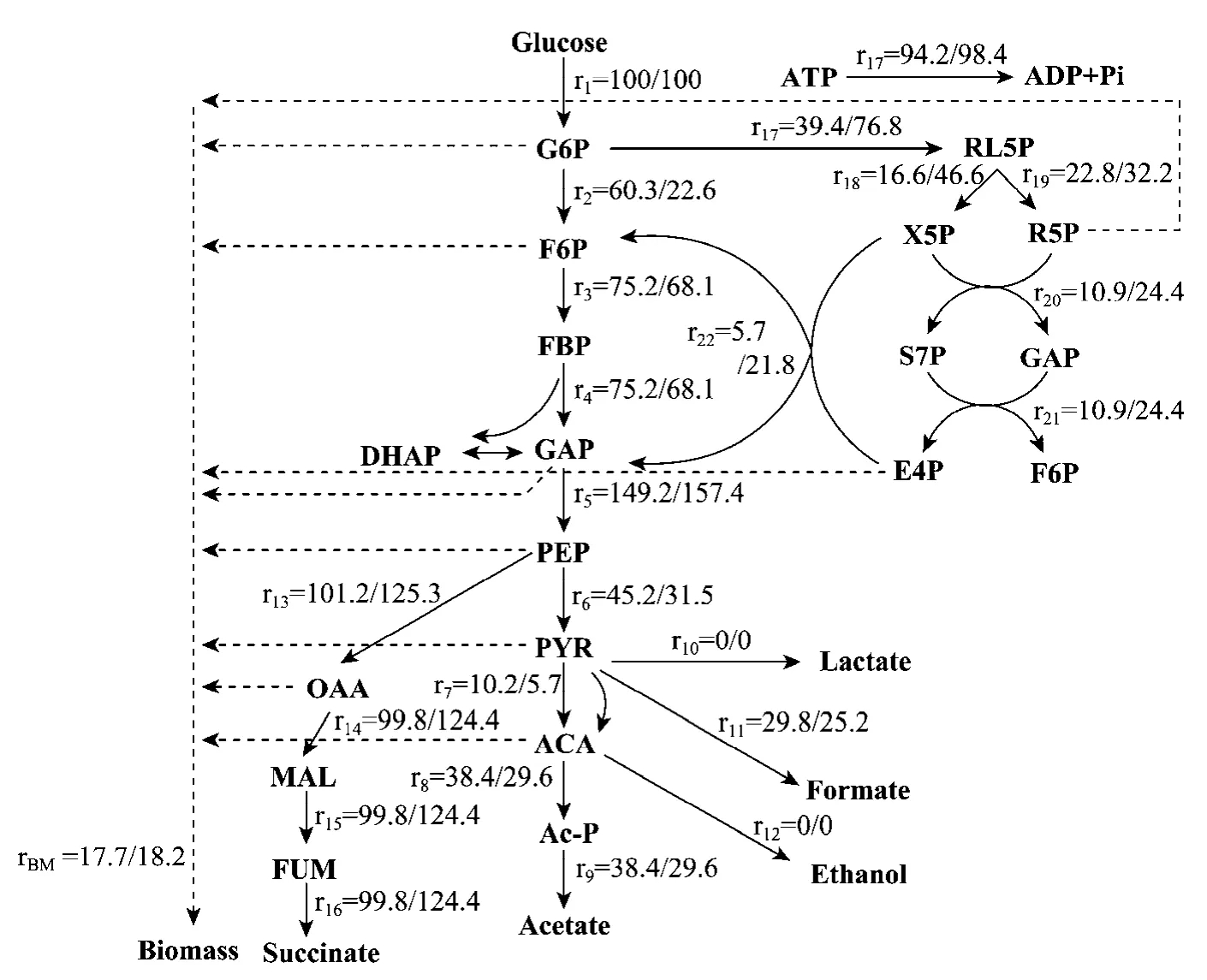
图3 添加PEP对代谢通量分布的影响(左边:不添加PEP;右边:添加PEP)Fig.3 Effects of adding PEP on metabolic flux distribution.Left flux from the control, right flux from the results of adding PEP.
2.4 外源添加PEP对关键酶活的影响
细胞代谢网络中的每一个反应都是由某种特定的酶催化的,酶活力的大小可以直接反映各个反应的速率。外界环境(如pH、温度等)的改变都会对酶活力产生不同程度的影响,从而影响代谢产物的分布情况。A.succinogenesNJ113代谢途径中的关键节点是PEP及PYR[9],PEP在Pepck作用下生成OAA进入C4途径,之后OAA在Mdh作用下生成苹果酸,最终生成目标产物丁二酸;而PEP也可以在Pyk作用下生成丙酮酸进入C3途径,生成副产物乙酸、甲酸等。实验测定稳定期时(11 h)添加PEP后发酵过程的关键酶活,并与对照比较,结果见图4。
由图4可知,关键酶Pepck的比活力变化非常明显,添加0.5 g/L PEP后Pepck比酶活达到1 910 U/mg,比对照提高了74.7%;同时Mdh也有所提高。而Pyk的比酶活有所降低,添加0.5 g/L PEP后Pyk为160 U/mg,与不添加PEP相比降低了67.5%。因此,Pepck酶活的提高使得进入C4途径的碳流量增加,从而减少进入C3途径的碳流量,这与Pyk酶活降低是一致的,最终合成更多的丁二酸,同时降低乙酸及甲酸的产量。
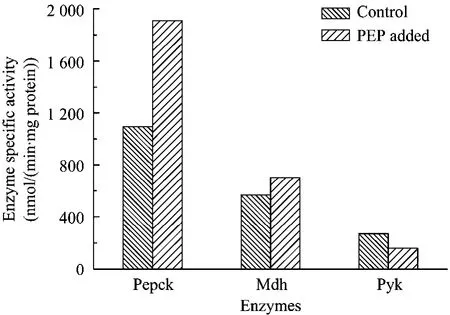
图4 添加PEP对关键酶活的影响Fig.4 Effects of PEP added on the key enzyme activity.
2.5 外源添加PEP对还原力通量分布的影响
在A.succinogenesNJ113厌氧代谢途径中,1 mol葡萄糖可以生成2 mol PEP以及2 mol NADH,而2 mol PEP生成2 mol丁二酸时需要消耗4 mol NADH,副产物乙酸、甲酸的形成过程不消耗也不产生 NADH,可见,产物丁二酸合成的矛盾是还原力不足,积累更多的NADH将有利于丁二酸的合成。代谢通量分析结果表明添加0.5 g/L PEP后HMP途径与EMP途径的通量比由对照的39.4∶60.3提高至76.8∶22.6,也就是说,通量更多地从G6P通过HMP途径进行代谢,并大量合成NADPH,NADPH除一部分用于细胞合成外,剩下的可在转氢酶的作用下转化为NADH[15]用于丁二酸合成,解决了NADH不足的矛盾。代谢网络中还原力[H]产生途径的通量分配情况见表4。
从表4可以看出,NADH产生途径主要有两条,即GAP到PEP(r5)和PYR到ACA(r7),添加PEP对NADH的通量没有明显的影响,但是NADPH的通量变化(r17)比较明显,与对照相比提高了97.5%,导致还原力[H]总通量增加。由于两种情况下的菌体浓度没有明显的变化,因此,添加PEP条件下有较多的NADPH可在转氢酶的作用下生成NADH,从而用于丁二酸的合成,最终提高丁二酸/(乙酸+甲酸)的比例。
3 结论
外源添加代谢中间体对菌体生长及发酵产丁二酸均有一定的影响,其中添加0.5 g/L PEP的效果最好。应用代谢通量分析方法得出添加0.5 g/L PEP后HMP与 EMP途径的通量比由 39.4∶60.3提高至76.8∶22.6,因此可以合成更多的 NADPH,进而转化为NADH,解决了还原力不足的矛盾,导致PEP生成OAA的通量提高了23.8%,丁二酸代谢通量从99.8 mmol/(g DCW·h)增至 124.4 mmol/(g DCW·h)。最终丁二酸浓度为29.1 g/L,收率达到76.2%,比未添加PEP时提高了11.0%,同时副产物乙酸、甲酸等与对照相比均有所降低。关键酶活分析结果表明,添加0.5 g/L PEP后可显著提高Pepck的比活力,PEP比酶活达到1 910 U/mg,与对照相比提高了74.7%;同时 Mdh也有所提高。而 Pyk的比酶活有所降低,添加PEP后Pyk为160 U/mg,较对照降低了67.5%。这与丁二酸产量增加、副产物产量减少是一致的。
REFERENCES
[1]Song H, Lee SY.Production of succinic acid by bacterial fermentation.Enzyme Microb Technol, 2006, 39: 352−361.
[2]Zeikus JG, Jain MK, Elankovan P.Biotechnology of succinic acid production and markets for derived industrial products.Appl Microbiol Biotechnol, 1999,51(5): 545−552.
[3]Willke T, Vorlop KD.Industrial bioconversion of renewable resources as an altenative to conventional chemistry.Appl Microbiol Biotechnol, 2004, 66(2):131−142.
[4]Lee PC, Lee WG, Lee SY,et al.Fermentative production of succinic acid from glucose and corn steep liquor byAnaerobiospirillum succiniciproducens.Biotechnol Bioprocess Eng, 2000, 5: 379−381.
[5]Heijnen JJ, Gulik WM, Shimizu H,et al.Metabolic flux control analysis of branch points: an improved approach to obtain flux control coefficients from large perturbation data.Metab Eng, 2004, 6: 391−400.
[6]Pan JH, Pan ZM, Zeng MJ,et al.Effects of nutrition factors on the biosynthesis of lysine in a lysine producerBrevibacterium lactofermentumFP094.J Wuxi Univ Light Ind, 2002, 21(2): 130−134.潘军华, 潘中明, 曾嵋涓, 等.营养因子对乳酸发酵短杆菌合成赖氨酸的影响.无锡轻工大学学报, 2002,21(2): 130−134.
[7]Wang S, Zhang WG.Effects and optimization of accession lactic acid and succinic acid in glutamate fermentation.Sci Technol Food Ind, 2008, 7: 76−78.王帅, 张伟国.添加乳酸和琥珀酸对谷氨酸发酵的影响及优化研究.食品工业科技, 2008, 7: 76−78.
[8]Liu LM, Li Y, Du GC,et al.Addition of TCA cycle intermediates enhances pyruvate production.Chin J Biotech, 2004, 20(1): 115−119.刘立明, 李寅, 堵国成, 等.添加TCA循环中间产物加速光滑球拟酵母积累丙酮酸.生物工程学报, 2004,20(1): 115−119.
[9]McKinlay JB, Shachar HY, Zeikus JG,et al.DeterminingActinobacillus succinogenesmetabolic pathways and fluxes by NMR and GC-MS analyses of13C-labeled metabolic product isotopomers.Metab Eng, 2007, 9(2):177−192.
[10]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem, 1976,72: 248−254.
[11]Van der Werf MJ, Guettler MV, Jain MK,et al.Environmental and physiological factors affecting thesuccinate product ratio during carbohydrate fermentation byActinobacillussp.130Z.Arch Microbiol,1997, 167: 332−342.
[12]Samuelov NS, Lamed R, Lowe S,et al.Influence of CO2-HCO3−levels and pH on growth, succinate production, and enzyme activities ofAnaerobiospirillum succiniciproducens.Appl Environ Microbiol, 1991, 57(10):3013−3019.
[13]McKinlay JB, Zeikus JG, Vieille C.Insights intoActinobacillus succinogenesfermentative metabolism in a chemically defined growth medium.Appl Environ Microbiol, 2005, 71(11): 6651−6656.
[14]Hao WL, Liu JZ, Zhao BH.Principle and application of metabolic engineering for microbiology.Biotechnol Bull,2007, 5: 18−23.郝伟丽, 刘景芝, 赵宝华.微生物代谢工程原理与应用.生物技术通报, 2007, 5: 18−23.
[15]McKinlay JB, Vieille C.13C-metabolic flux analysis ofActinobacillus succinogenesfermentative metabolism at different NaHCO3and H2concentrations.Metab Eng,2008, 10: 55−68.
Effect of adding intermediate metabolites on succinate production by Actinobacillus succinogenes
Xiumei Huang, Min Jiang, Jian Li, Xiaoyu Zheng, Zhuona Yang, Xiaojiang Fang, and Guizi Ye
State Key Laboratory of Materials-oriented Chemical Engineering, College of Life Science and Pharmacy, Nanjing University of Technology,Nanjing 210009, China
Received:November 13, 2009;Accepted:February 23, 2010
Supported by:National Basic Research and Development Program of China(973 Program)(No.2009CB724701), National Natural Science Foundation of China(No.20606017), Foundation of State Key Laboratory of Materials-oriented Chemical Engineering, “Qinglan Project” of Jiangsu Province, “The Six Talent Summit” of Jiangsu Province(No.06-A-047).
Corresponding author:Min Jiang.Tel: +86-25-83172078; Fax: +86-25-83172075; E-mail: jiangmin@njut.edu.cn国家重点基础研究发展计划(973计划)(No.2009CB724701),国家自然科学基金(No.20606017),材料化学工程国家重点实验室基金,江苏省“青蓝工程”,江苏省“六大人才高峰”(No.06-A-047)资助。

