WBE联合EIS技术研究缺陷涂层下金属腐蚀
张 伟 王 佳 李玉楠 王 伟
(1中国海洋大学化学化工学院,山东青岛 266100; 2钢铁研究总院青岛海洋腐蚀研究所,山东青岛 266071;3金属腐蚀与防护国家重点实验室,沈阳 110015)
WBE联合EIS技术研究缺陷涂层下金属腐蚀
张 伟1,2王 佳1,3,*李玉楠1王 伟1
(1中国海洋大学化学化工学院,山东青岛 266100;2钢铁研究总院青岛海洋腐蚀研究所,山东青岛 266071;3金属腐蚀与防护国家重点实验室,沈阳 110015)
用电化学阻抗谱(EIS)结合丝束电极(WBE)技术研究了缺陷涂层浸泡在3.5%(质量分数)NaCl溶液中的劣化过程.从浸泡开始到完好涂层鼓泡失效,缺陷涂层丝束电极阻抗响应一直是缺陷区电极腐蚀反应过程特征,而完好涂层的劣化过程和涂层下的腐蚀反应过程特征被“平均掉”.根据电极表面的电流分布,结合阻抗谱技术实现了对表面任意局部阴极和阳极区阻抗测试.研究发现,浸泡开始时,缺陷涂层阴极电流和阳极电流均出现在缺陷区,随着腐蚀过程的发展,阳极电流仍然保持在缺陷区,但阴极电流逐渐向完好涂层下扩展.根据实验结果,对缺陷处和涂层下金属腐蚀反应发生发展的机理进行了深入讨论.
电化学阻抗谱; 丝束电极; 有机涂层
Abstract:We investigated the corrosion of steel under defective coatings in 3.5%(mass fraction)NaCl solution by the wire beam electrode(WBE)and electrochemical impedance spectroscopy(EIS)technique.During the entire coating deterioration process,the EIS diagrams were dominated by the substrate corrosion process of the defect while the coatings and underlying electrochemical processes were“ averaged” out.However,according to the current distribution maps plotted using the WBE,EIS responses of the anodic and cathodic regions of the defect and underlying coatings were detected.Initially,the high anodic and cathodic current densities were only monitored at the defect areas and then the cathodic sites spread out beneath the coatings around t2948he defect while the anodic sites remained on the defect.The substrate corrosion initiation and development mechanism of the defect and underlying coatings is discussed based on experimental results.
Key Words: Electrochemical impedance spectroscopy;Wire beam electrode;Organic coating
电化学阻抗谱(EIS)因其能用于高阻抗体系的测试并提供大量的涂层和基底金属腐蚀反应发生发展的信息而被广泛地应用于聚合物涂层劣化过程的研究.EIS能在很宽的频率范围对涂层体系进行测试,因此能在不同的频率段得到涂层电阻、涂层电容以及涂层下基底金属腐蚀反应的反应电阻、双电层电容等与涂层性能和涂层下基底金属腐蚀反应的相关信息,使得该方法已经成为涂层保护性能研究的一种最主要的电化学方法[1].
但是,由于阻抗谱响应反映的是涂层/电极体系界面平均信息,如果涂层下腐蚀反应发生的面积较小,局部的腐蚀反应信息就会被“平均”掉.实际上,涂层下金属腐蚀反应发生以后,腐蚀反应微电流从阳极到阴极要两次穿越涂层,一次是阴极表面涂层,一次是阳极表面涂层.由于两部分电阻是并联关系,所以电化学阻抗谱在很大程度上反映的是较小部分的涂层阻抗[2].已有研究表明,当涂层表面存在较大面积缺陷时,比如划痕或者机械损伤,电化学阻抗谱反映的又主要是与缺陷处腐蚀反应和腐蚀产物生成沉积相关的电化学过程[3].这就给阻抗谱的解析带来很大的困难,不利于深化认识局部涂层劣化过程的机理,有时甚至会得出错误的结论.
局部电化学技术为研究涂层局部劣化机理提供了可能.最近发展起来的局部电化学阻抗谱(LEIS)技术,因其能提供微区涂层破损处(像鼓泡和划痕)的阻抗谱信息,弥补了传统电化学阻抗谱的不足而被广泛地应用于有机涂层劣化过程的研究当中[4-5].Zou等[6]研究发现,在涂层鼓泡起始阶段,由于界面腐蚀反应面积较小,相对于整个涂层对总阻抗的贡献可以忽略,所以在传统的阻抗谱响应上反映不出鼓泡处的电化学信息.而LEIS响应在局部鼓泡起始阶段却发现了明显高于整体的涂层快速吸水过程.但是研究还发现,由于完好涂层的阻抗较大,使得测试的信噪比较小,使得LEIS技术很难检测到完好涂层小于500 Hz的阻抗谱响应.Macedo等[7]通过使用LEIS对比研究不同种类的有机劣化过程发现,由于涂层种类繁多,仅根据涂层表面的阻抗变化来建立与基底金属腐蚀反应过程之间的关系是不可能的.从LEIS的原理上讲,测试过程中它需要保持探针和表面的距离为一固定值,对电极表面形貌要求很高[8].一旦涂层表面出现划痕或者鼓泡,研究者必须不断调整探针高度以得到准确的测试结果.
丝束电极(WBE)技术是另外一种被用来研究涂层劣化机理的局部电化学技术[2,9-11].Tan等[2,10]最早将该技术引入到有机涂层失效过程研究当中,发现了电极表面涂层的不均匀性,即涂层表面存在较薄弱的“虚点”.由于他没有结合使用其他电化学测试技术,所以仅根据涂层表面的阻抗信息来推断涂层下金属腐蚀反应机理有很大的不确定性[7].然而,尽管丝束电极技术的制备方法和原理我们已经了解很多[12],但是到目前为止,该项技术还未实现商品化,这也成为该技术被广泛应用的障碍.
本实验室在Labview环境下构建了一套便捷的WBE测试系统,该系统已经应用于微生物膜/金属表面的不均匀腐蚀研究当中[13-14].电化学阻抗谱虽然能对涂层表面的微观缺陷作出快速的响应,却不能提供准确的缺陷位置及涂层下腐蚀反应阴阳极分布信息[15].而WBE技术却能提供电极表面的电位分布和电流分布,我们可以据此来判断界面腐蚀反应的阴阳极分布及不同极性区域的腐蚀反应速度,从而弥补阻抗谱方法的不足.但是WBE技术所提供的涂层劣化过程的信息却远远不及EIS准确而丰富.
本文试图通过本实验室自主搭建的WBE结合EIS技术研究带有缺陷的有机涂层劣化过程.希望在研究涂层局部不均匀劣化过程的细节上获得更加准确可靠的信息,并在研究方法上有新的认识.
1 实验部分
1.1 丝束电极的制备
电极材料是Q235普通碳钢(Φ=1.6 mm),将钢丝彼此绝缘,用环氧密封成11×11矩阵电极,电极之间的距离为0.8 mm,见图1a.用800#水磨砂纸将试样表面打磨、抛光后,依次用丙酮和乙醇冲洗吹干,然后涂刷铁红酚醛防锈底漆.在室温下防尘搁置7 d使其充分固化,固化后涂层厚度为(100±10)μm.依据121根电极在试样中的位置编号,1#,2#,…,121#.用裁纸刀在电极表面划痕,划痕位置为59#-63#电极,划痕宽度约1 mm,示意图见图1b.
1.2 EIS测试
EIS测试采用M273A恒电位仪和1260频率响应分析仪组成的电化学阻抗测试系统,测试频率范围为105-10-2Hz,正弦波信号振幅为10 mV.电解池采用三电极体系,参比电极为饱和甘汞电极,辅助电极为铂片,丝束电极为工作电极,根据需要可选取121根电极中任意单根或多根测试.电解质溶液为3.5%(质量分数)NaCl,实验中所用的蒸馏水均为二次蒸馏水.采用Z-View软件对数据进行处理,EIS测试均在室温下的屏蔽箱中进行.
1.3 WBE测试
WBE实验装置是本实验室自主搭建的,由美国NI公司的 PXI1033、2535、4017、4022 等模块化仪器组成,其中数字万用表PXI4071+4022为NI公司最新产品,七位半测试精度:10 nV-100 V,1 pA灵敏度(100 nA量程).输入阻抗大于1010 Ω,PXI2535为高速矩阵开关(4×136),开关频率50000 Hz.测控软件利用Labview8.5自定义编制.局部电流测量是断开一个电极,其余120根相互短接,测量此电极与其余耦合电极之间的电流.上述过程有Labview软件编程自动控制,所得数据用Surfer 8.0作图.所有表面电流测试与EIS测试过程一样浸泡在3.5%NaCl溶液中.关于这套WBE测试系统的详细介绍请参考相关文献[13-14].

2 结果与讨论
2.1 电极表面电流密度分布和涂层形貌演化
图2为不同浸泡时间的电极表面的电流密度分布.右侧彩色刻度的单位是μA·cm-2,负值为阴极电流,正值为阳极电流,绝对值越大,说明阴极或阳极电流密度越大.
对于我们的测试体系,电极表面表现出的阳极电流对应着基体金属的腐蚀溶解过程,电流密度越大,腐蚀反应速度也越快,金属腐蚀也就越严重;而阴极电流则对应着溶解氧在金属表面的还原反应过程,阴极氧还原反应不会造成阴极区金属的腐蚀,反而会由于氧还原过程在金属表面形成的局部强碱性环境使得金属表面生成一层保护膜被保护起来.但是,溶解氧还原反应过程生成的具有强氧化性的中间产物和局部强碱性环境则会消弱涂层与金属间的结合力,加速涂层从金属表面的剥离[16].
浸泡1 d后,缺陷处分别出现了较大的阳极电流和阴极电流,阳极电流密度最大达到20 μA·cm-2,阴极最大值达到-10 μA·cm-2,而涂层下电极电流密度均在 0 μA·cm-2附近,见图 2a.可以说,此时基体金属的阳极溶解和氧的阴极还原反应过程均只在缺陷处发生,由于涂层的保护涂层下电极未被腐蚀.
浸泡2 d后,阴极电流开始向涂层下扩展,在靠近缺陷的48#电极处出现了一个较大的阴极电流,如图2b所示.涂层下阴极区的出现说明说随着缺陷区腐蚀反应的不断进行,溶解氧的阴极还原反应开始在靠近缺陷处涂层下发生,涂层开始从电极表面剥离.

浸泡14 d后,涂层下阴极电流区逐渐向外扩展,除48#电极外,在靠近缺陷处的49#,50#,51#,52#,70#和74#等处也发现了较大的阴极电流,见图2c.到38 d时,阴极区占到整个电极面积的1/2左右,而阳极电流依然保持在缺陷处,呈岛屿状被阴极区域包围,见图2d.涂层下腐蚀反应开始以后,单根电极均表现为阴极,随着界面腐蚀反应的不断进行,阴极区沿缺陷处逐渐向完好涂层下扩展.说明随着氧在界面区还原反应的不断进行,涂层从金属表面的不断剥离,阴极区域也逐渐向外扩展.
到63 d后,阴极氧还原区域进一步向电极边缘扩展,同时在涂层下的81#和82#电极处发现了较大的阳极电流,见图2e.到95 d后,在2#电极处又出现一处较大阳极电流密度,见图2f.这三处电极在腐蚀反应开始时均为阴极电流,浸泡后期电流密度发生极性转换变为阳极电流,可能的原因将在后面的叙述中详细讨论.
图3是浸泡14 d和95 d后的涂层表面形貌照片.14 d后,涂层表面缺陷处已经被腐蚀产物堵塞,但是涂层表面完好,并未见有鼓泡.这说明尽管在2 d时涂层下的阴极氧还原反应过程已经开始发生,但到涂层鼓泡还需要相当长的一段时间.到95 d后,在电流密度分布发现较大阳极电流的2#,81#和82#电极处涂层鼓泡已经破裂,腐蚀产物呈黄褐色.

用丙酮轻轻擦去电极表面涂层,发现不同位置处的基体表面腐蚀形貌差别较大,见图4.缺陷处5根电极和涂层下2#,81#和82#电极表面均被黑色腐蚀产物覆盖,金属表面出现较深的蚀坑.上述8根电极在实验的不同阶段均表现出较大的阳极电流,强烈的阳极溶解反应使得基体金属腐蚀严重.而涂层下的4#,5#,6#,7#等(已在图中标注)电极表面局部出现了浅色腐蚀斑点,其余涂层下电极依然保持光亮表面.这是因为这些电极尽管在界面腐蚀开始时也表现为阴极电流,但实验后期电流极性也发生过极性转换,变为阳极电流,只是电流密度较小,未在电流密度图上表现出来.对于这些电极,转换后的阳极电流密度较小,所以基体金属腐蚀较轻.值得注意的是,在61#和81#电极局部表面尽管出现被黑腐蚀产物覆盖的蚀坑,但部分表面依然呈现光亮的裸金属光泽.关于上述现象可能的原因也将在接下来的讨论中进一步详细说明.
以上通过对浸泡过程电极表面电流密度分布和涂层表面形貌的分析可以得出如下结论:浸泡开始时,基体金属的阳极溶解和溶解氧的阴极还原反应只在缺陷处发生,随着腐蚀反应的发展,阳极反应依然保持在缺陷处,但阴极反应却沿着缺陷处逐渐向完好涂层下扩展,涂层逐渐从电极表面剥离.
2.2 涂层劣化过程的阻抗谱响应变化

需要特别说明的一点是,本实验中所有的阻抗谱测试结果均未进行面积归一化处理.原因是缺陷处暴露出来的基体金属的面积很难准确计算,并且随着划痕处腐蚀反应区域的不断增大,面积也会不断变化,面积归一化很难实现.

图5是浸泡1 d后不同位置的阻抗谱响应和等效电路拟合结果.对于涂层下的116根(总电极除去缺陷处5根后)电极,Nyquist图表现为一高阻抗的半圆弧,Bode图低频阻抗108Ω,相位角在很宽的范围内接近-90°.为典型的涂层完好阶段的阻抗谱响应[1],见图5A和5C.阻抗谱响应与图2a所示的涂层下电流密度分布相一致,说明此时涂层完好,涂层下未有腐蚀反应发生.对于这段时间的阻抗谱响应可由图6a所示的等效电路来描述,其中,Rs为溶液电阻,Rc为涂层电阻,Cc涂层电容.
对于缺陷处的60#电极,阻抗谱Nyquist图也表现为一个半圆弧,Bode图相位角在测试区间内只有一个最大值,表现为一个时间常数特征.但低频模值为8.0×103Ω,远小于涂层下的116根电极,为典型的碳钢裸金属腐蚀反应阻抗特征[17],而总电极阻抗响应形状和阻抗均与60#电极相近,见图5B和5D.总阻抗与缺陷处电极阻抗响应相近,而与完好涂层阻抗响应相差甚远,说明总阻抗响应的主要是缺陷处电化学腐蚀反应过程信息.这与文献报道的涂层表面存在划痕时,EIS响应反映的主要是与缺陷处金属腐蚀反应相关的界面信息一致[3-4,18].对于这段时间的总电极和60#电极阻抗谱响应所对应的物理模型在图6b给出,其中,Cdl为界面腐蚀反应的双电层电容,Rt为界面腐蚀反应的电荷转移电阻.

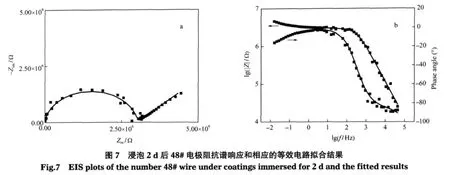
图7是浸泡2 d后48#电极阻抗谱响应,阻抗谱Bode图低频阻抗为106-107Ω,小于完好涂层108Ω,相位角在测试范围内为两个最大值,显示两个时间常数特征.但是Nyquist图却表现为一高频半圆弧和一低频段与实轴成约45°的Warburg阻抗扩散尾.第二个时间常数的出现说明此时腐蚀性介质已经渗透到48#电极处的涂层/基底界面,基底腐蚀反应开始发生,这与浸泡2 d后48#电极处开始出现较大阴极电流相一致.与高频端对应的时间常数来自于涂层电容及涂层表面微孔电阻的贡献,与低频端对应的时间常数则来自于涂层/金属界面腐蚀反应相关的双电层电容及电荷转移电阻.从电流密度分布图知道,48#电极表现为较大的阴极还原电流密度,所以我们认为低频扩散尾的出现可能是腐蚀反应受氧还原扩散过程控制,使得代表界面腐蚀反应特征的半圆弧被Warburg扩散阻抗所掩盖[19].采用图8a所示的等效电路对阻抗谱进行拟合得到较好的拟合结果,其中,Zw为Warburg扩散阻抗,其余各元件的物理意义与上同.
而在浸泡2 d后,总电极和60#电极的阻抗谱形状和阻抗大小均与图5相近.可以看出,即使完好涂层下界面腐蚀反应发生以后,总阻抗响应依然主要是缺陷处的电化学信息.这是因为对于整个电极表面的电化学过程来说,涂层和涂层下的界面腐蚀反应过程与缺陷处基体金属的腐蚀反应在等效电路模型中是一个并联关系,当涂层和涂层下界面腐蚀反应的阻抗远大于缺陷处腐蚀反应阻抗时,总阻抗响应主要是电极表面较低阻抗处,即缺陷处的电化学信息,而涂层和涂层下腐蚀反应信息就会被“屏蔽”了.
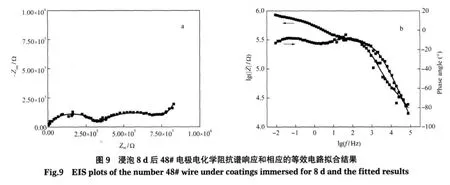
图9是48#电极浸泡8 d后的阻抗谱响应.可以看出阻抗谱Nyquist图表现为高频和中间频段的两个半圆弧和一个低频约45°的Warburg阻抗扩散尾.Bode图低频阻抗降低到106Ω以下,相位角在整个测试频段有3个峰值,表现为3个时间常数特征.中间频段半圆弧的出现可能是随着电极表面氧还原反应的不断进行,涂层不断从金属表面劣化剥离,界面腐蚀反应加速,使得代表界面腐蚀反应信息的时间常数从低频扩散尾中分离出来[3-4,18-19].阻抗谱响应高频段半圆弧代表的是与涂层相关的阻抗信息,中间频段响应的是界面腐蚀反应信息,低频Warburg阻抗扩散尾的出现说明48#电极界面腐蚀反应依然受氧还原扩散控制.采用图8a所示的等效电路模型拟合,拟合结果较好,见图9.
尽管浸泡8 d后48#电极阻抗再次降低,但总电极和60#电极的阻抗谱形状和阻抗大小均与图5一致,总阻抗响应依然是缺陷处的界面腐蚀反应电化学信息.但是根据电极表面的电流分布,应用传统的EIS技术却能实现对局部阴极和阳极反应区域的阻抗谱测试.

浸泡14 d后,总阻抗响应Nyquist图出现两个半圆弧.相应的Bode图相位角出现两个最大值,表现为两个时间常数特征,见图10.相应地,划痕处60#电极也表现出相似的两个时间常数特征(图谱未给出).实际上,从完好涂层到涂层剥离鼓泡直至完全失效的整个测试过程中,总能在缺陷处的单根电极中找到与总电极相一致的阻抗谱响应,而这种阻抗谱响应不管是形状还是低频模值又都与涂层下48#电极阻抗响应相差甚远,所以在接下来的叙述中我们只讨论总阻抗响应特征.
从图3a所示浸泡14 d后涂层表面形貌可以看出,缺陷处的划痕已经被黄褐色的腐蚀产物塞满,所以阻抗谱高频半圆弧的出现可能是随着缺陷处腐蚀产物的沉积,在缺陷处形成了一道锈层,和涂层一样在阻抗谱高频段表现为一个半圆弧.对于这段时间阻抗谱响应由图8b所示的物理模型给出,其中Cr为锈层电容,Rr为锈层电阻,Cdl为锈层下金属腐蚀反应的双电层电容,Rt为腐蚀反应电荷转移电阻,拟合结果见图10.
图11是48#电极10-95 d的阻抗谱响应.与浸泡8 d后的阻抗谱响应一致,10-31 d阻抗谱一直表现为高频和中间频段的两个半圆弧和一个低频约45°的Warburg阻抗扩散尾的三个时间常数特征,见图11a.到39 d时,阻抗谱响应变化为一个高频半圆弧和一个低频扩散尾,只是扩散尾与实轴的夹角偏离 45°,见图 11b.
从31 d和39 d的阻抗谱图可以看出,39 d时阻抗谱高频圆弧半径远较31 d大,由于高频段圆弧代表的是与涂层相关的电化学过程,圆弧半径的增加说明涂层阻抗增加.出现这种现象的原因可能是基体金属阳极溶解和阴极氧还原生成的腐蚀产物向涂层中的扩散阻塞了涂层微孔通道,使得涂层电阻增加[20];我们之所以认为可能是腐蚀产物的作用主要是因为在实验结束时,48#电极表面有腐蚀斑点出现.同时,涂层阻抗的增加也使得界面区腐蚀反应受传质扩散过程控制,加上测试体系可能受到了弥散效应的影响,低频扩散尾阻抗偏离45°.


浸泡95 d后,48#电极阻抗谱表现为一个高频半圆弧和低频带有扩散特征的半圆弧,采用图8a所示的等效电路模型取得很好的拟合结果,见图11c.95 d后48#电极涂层虽然已明显鼓泡,但鼓泡尚未破裂(图4),所以我们认为高频圆弧代表的应该是该处涂层和涂层下沉积锈层的综合电化学响应,低频扩散尾的出现说明界面腐蚀反应过程依然受到传质过程控制.
图12是46-94 d浸泡过程中总阻抗响应随时间变化.从图中可以看出,浸泡46 d时,Nyquist图除了高频半圆外,在低频段出现了一个明显有扩散特征的半圆弧.低频扩散半圆弧的出现说明锈层下腐蚀反应过程受传质过程控制,由于总阻抗响应反映的主要是缺陷处腐蚀反应的电化学信息,所以传质过程可能是基底金属阳极腐蚀产物向溶液中的迁移,也可能是溶解氧向阴极腐蚀反应区的扩散.浸泡53 d时,低频扩散尾消失,取而代之的是一容抗弧,阻抗谱再次表现为两个半圆弧.扩散尾消失的原因可能是与基底金属结合紧密的锈层作为阴极去极化剂参与了电化学反应被消耗掉了[21].到62 d时,低频段再次出现扩散尾,66 d时扩散尾消失,94 d时又开始出现.阻抗谱响应低频段交替出现半圆弧和带有扩散特征的半圆弧的现象可能是反映了缺陷区腐蚀产物在电极表面的沉积覆盖和阴极还原过程.对于出现低频半圆弧的阻抗谱响应我们采用图8b的等效电路模型拟合,而出现低频带有扩散特征的半圆弧的阻抗谱响应则采用图8c所示的物理模型拟合,两种阻抗谱响应均取得了很好的拟合结果,图12b给出了94 d时阻抗谱响应和响应的拟合结果.
2.3 电极表面单根电极电流密度变化过程反转现象
图13是涂层下48#,81#和缺陷处60#,61#电极的电流密度随时间变化.对于48#电极,浸泡开始的60 d电流密度尽管呈现较大波动,但均为阴极电流.从61 d开始,电流极性发生转换,变为阳极电流,只是电流密度远较阴极时小.而缺陷处的60#电极,大多数时间里表现为阳极电流,但是分别在20,21和61 d时,电流密度发生极性转换变为阴极电流.同样是缺陷处的61#电极,浸泡的前42 d却一直表现为阴极电流,43 d时也发生极性转换变为阳极电流(30 d曾短暂转换为阳极电流).对于81#电极,浸泡开始的前30 d内,电流密度均接近零,30 d开始出现阴极电流,电流密度随时间逐渐增大,到60 d时达到最大.浸泡60 d以后,电流极性发生逆转转变为阳极电流,且电流密度值远较60 d时的阴极电流密度大.


可以看出,浸泡过程中,不管是缺陷处还是涂层下的单根电极都发生过电流极性转换,缺陷处电流由阳极转换为阴极,也有阴极转换为阳极,而涂层下单根电极只发现了由阴极转换为阳极的过程.
Doherty[19]和Reddy[22-23]等应用扫描Kelvin探针(SKP)技术在涂层表面的缺陷处发现了由阳极到阴极的电位逆转现象.浸泡开始时缺陷处暴露金属表现为阳极,随着腐蚀产物被溶解氧氧化为FeOOH并覆盖在金属表面的阳极区,阻碍了氧向阳极区的扩散,结果新的阳极在缺陷区周围重新形成,红色铁锈FeOOH被逐渐还原为黑色的Fe3O4,可能的反应是这样的:

因此,划痕处基底金属阳极溶解就会停止,转变为腐蚀产物的阴极还原过程.
对于缺陷处的60#电极在实验中间阶段分别出现了短暂的电流密度由阳极到阴极的极性转换,实验结束时电极表面被厚厚的黑色锈层覆盖,我们认为可能是发生了腐蚀产物FeOOH的还原反应过程.
上述机理却无法解释缺陷处和涂层下由阴极到阳极的电流极性转换现象.我们认为可能的原因是这样的:当表面腐蚀反应开始时,任一单根电极表面均同时进行着金属的阳极溶解和溶解氧在表面的阴极还原两个反应.

对于单根电极来说,如果金属阳极溶解反应的电流密度大于阴极还原的电流密度,那么该电极对外就会表现出阳极电流,反之,表现为阴极电流.浸泡开始时,由于缺陷处电极直接与电解质溶液接触,腐蚀反应最先在这里发生,部分电极表现为阳极电流,部分为阴极电流(61#电极).尽管61#电极在浸泡开始时表现为阴极电流,但基体的阳极溶解反应也在进行,只不过是电流密度相对于阴极较小而已.溶解氧还原反应形成的局部强碱性环境使得阴极区表面进入钝化状态而被保护,而阳极区金属发生腐蚀溶解,这就是在14 d时61#电极表面也被黄褐色的锈层覆盖的原因.
随着溶解氧在缺陷处涂层/金属界面区的还原,涂层也不断向四周剥离扩展,电解质溶液也很快沿界面向剥离处扩散.当剥离前沿到达48#电极表面时,腐蚀反应开始发生.相对于缺陷处暴露出的“新鲜”金属强大的阳极还原能力,48#电极更倾向于发生溶解氧的阴极还原,这就是涂层下腐蚀反应开始时电极最先表现出阴极电流的原因.
涂层的大面积剥离,电解质溶液可以很容易地扩散到涂层/金属界面区.当缺陷处电极被腐蚀产物沉积覆盖使得阳极溶解反应受到阻碍时,涂层剥离区域(像48#)和缺陷处原本表现为阴极电流的电极(像61#)的阳极溶解反应就会被加速,从而导致电流密度的极性转换,由阴极电流转变为阳极电流;而缺陷处的部分电极随着锈层参与阴极还原反应也会发生极性转换,由阳极电流转换为阴极电流,像60#电极.阳极电流密度大的电极基体金属腐蚀较为严重,像2#,81#和82#电极,电流密度较小的电极腐蚀较轻,像48#电极.对于61#和81#电极,尽管极性转换对外表现为阳极电流,但是电极表面的局部区域溶解氧的还原反应使得阴极区金属被保护起来,这也是涂层下表现为阴极电流的电极表面未被腐蚀的原因.
3 结 论
(1)缺陷涂层丝束电极腐蚀反应开始时阴极和阳极电流均出现在缺陷区,随着溶解氧在缺陷处涂层/金属界面还原反应的不断进行,阳极电流保持在缺陷区,但阴极电流沿着缺陷处不断向四周完好涂层扩散.
(2)从涂层完好到鼓泡失效,缺陷涂层丝束电极总阻抗响应反映的主要是缺陷区电极过程特征,涂层劣化和涂层下金属腐蚀反应过程信息被缺陷区“掩盖”.
(3)在缺陷处和涂层下均发现了电流极性转换的现象,但发生转换的原因并不相同.缺陷处电流密度的极性转换是由于腐蚀产物参与了阴极还原;而涂层下电流密度的转换是由于缺陷处腐蚀反应受阻而引起的涂层下阳极反应过程加速.
(4)研究结果表明,丝束电极和传统电化学阻抗谱技术的结合使用不仅能够提供电极表面缺陷处和涂层下阴极和阳极区域的电流分布,而且能提供不同位置涂层劣化和涂层下腐蚀反应发生发展的过程信息.两者的结合使用,弥补了传统电化学阻抗谱只能反映电极表面平均信息的不足.
1 Zhang,J.Q.;Cao,C.N.Corrosion and Protection,1998,19(3):99 [张鉴清,曹楚南.腐蚀与防护,1998,19(3):99]
2 Tan,Y.J.Prog.Org.Coat.,1991,19:89
3 van Der Weijde,D.H.;Van Wexing,E.P.M.;De Wit,J.H.W.Electrochim.Acta,1996,41:1103
4 Zhong,C.;Tang,X.;Cheng,Y.F.Electrochim.Acta,2008,53:4740
5 Dong,C.F.;Fu,A.Q.;Li,X.G.;Cheng,Y.F.Electrochim.Acta,2008,54:628
6 Zou,F.;Thierry,D.Electrochim.Acta,1997,42:3293
7 Macedo,M.C.S.S.;Margarit-Mattos,I.C.P.;Fragata,F.L.;Jorcin,J.B.;Pébère,N.;Mattos,O.R.Corrosion Sci.,2009,51:1322
8 Pernkopf,W.;Sagl,M.;Fafilek,G.;Besenhard,J.O.;Kronberger,H.;Nauer,G.E.Solid State Ionics,2005,176:2031
9 Tan,Y.J.;Shiti,Y.Prog.Org.Coat.,1991,19:257
10 Wu,C.L.;Zhou,X.J.;Tan,Y.J.Prog.Org.Coat.,1995,25:379
11 Le Thu,Q.;Bonnet,G.;Compere,C.;Le Trong,H.;Touzain,S.Prog.Org.Coat.,2005,52:118
12 Tan,Y.J.Corrosion Sci.,1999,41:229
13 Zhang,X.;Wang,W.;Wang,J.Corrosion Sci.,2009,51:1475
14 Wang,W.;Zhang,X.;Wang,J.Electrochim.Acta,2009,54:5598
15 Grundmeier,G.;Schmidt,W.;Stratmann,M.Electrochim.Acta,2000,45:2515
16 Leng,A.;Streckel,H.;Hofmann,K.;Stratmann,M.Corrosion Sci.,1999,41:599
17 Yang,Z.N.;Zhang,Z.;Su,J.X.;Zhang,J.Q.;Li,Z.G.;Yang,A.A.;Cao,C.N.Acta Metallurgica Sinica,2005,41:860 [杨仲年,张 昭,苏景新,张鉴清,李自刚,杨阿娜,曹楚南.金属学报,2005,41:860]
18 Jorcin,J.B.;Aragon,E.;Merlatti,C.;Pébère,N.Corrosion Sci.,2006,48:1779
19 Dohery,M.;Sykes,J.M.Corrosion Sci.,2004,46:1256
20 Allahar,K.N.;Hinderliter,B.R.;Bierwagen,G.P.;Tallman,D.E.;Croll,S.G.Prog.Org.Coat.,2008,62:87
21 Hu,J.M.;Zhang,J.Q.;Xie,D.M.;Cao,C.N.Acta Phys.-Chim.Sin.,2003,29(2):144 [胡吉明,张鉴清,谢德明,曹楚南.物理化学学报,2003,29(2):144]
22 Reddy,B.;Dohery,J.M.;Sykes,J.M.Electrochim.Acta,2004,49:2965
23 Reddy,B.;Sykes,J.M.Prog.Org.Coat.,2005,52:280
Evaluation of Metal Corrosion under Defective Coatings by WBE and EIS Technique
ZHANG Wei1,2WANG Jia1,3,*LI Yu-Nan1WANG Wei1
(1College of Chemistry and Chemical Engineering,Ocean University of China,Qingdao 266100,Shandong Province,P.R.China;2Qingdao Marine Corrosion Institute,Central Research Institute for Steel and Iron,Qingdao 266071,Shandong Province,P.R.China;3State Key Laboratory for Corrosion and Protection of Metals,Shenyang 110016,P.R.China)
O646;TG174.46
Received:July 28,2010;Revised:August 19,2010;Published on Web:September 6,2010.
*Corresponding author.Email:jwang@mail.ouc.edu.cn;Tel:+86-532-66781903.
The project was supported by the National Natural Science Foundation of China(50971118).
国家自然科学基金(50971118)资助项目

