利用红外光谱和拉曼光谱研究离子液体结构与相互作用的进展
张力群 李浩然
(浙江大学化学系,杭州 310027)
利用红外光谱和拉曼光谱研究离子液体结构与相互作用的进展
张力群 李浩然*
(浙江大学化学系,杭州 310027)
热力学实验、理论计算以及计算机模拟是离子液体微观结构与相互作用研究中常用的三种手段,但是目前采用这些手段对离子液体结构的认识尚处于初步探索阶段,还没有完全找到离子液体性质随结构变化的规律,尚未完全能够对离子液体进行“设计”,这也使得对离子液体的进一步开发和应用受到极大的限制.近年来,谱学方法成为研究溶液结构的重要手段.其中,红外光谱(IR)和拉曼光谱(Raman)等谱学手段在离子液体的结构与相互作用研究中发挥着越来越重要的作用.本文着重概述了红外光谱和拉曼光谱在纯离子液体及离子液体混合溶液结构与相互作用方面的研究进展、挑战以及发展方向.
离子液体; 红外光谱; 拉曼光谱; 结构; 相互作用
Abstract:Experimental methods,theoretical calculations as well as computer simulations are the three most often used approaches to investigate the microscopic properties and interactions of ionic liquids(ILs).The relationship between the structure and properties of ILs,which is the foundation for designing new functional ionic liquids and promoting their applications in cleaner production,are not thoroughly understood.Recently,spectroscopic methods have been developed to study the structures of solutions.Among the various spectroscopic methods,infrared spectroscopy and Raman spectroscopy play important roles in investigations on the structural properties and interactions of ionic liquids.We thus review the applications and progress of these two spectroscopic methods on structural and property studies of pure ionic liquids and ionic liquids/solvent mixtures.Additionally,we address the associated challenges and prospects.
Key Words: Ionic liquid;IR spectrum; Raman spectrum; Structure;Interaction
自上世纪90年代以来,离子液体作为一种新兴的绿色溶剂,由于其具有挥发性低、液程宽、对许多有机和无机物质都表现出良好的溶解能力以及极性可调节等独特的性质,在合成、催化、分离和电化学等许多应用领域都引起了人们的广泛关注和研究[1-3].离子液体种类繁多,结合方式千变万化,找到结构与性质之间关系的规律是离子液体功能化设计的必由之路,也是离子液体理论和应用研究的不可或缺的基础,并将进一步推动离子液体的开发与应用,从而对整个绿色化学领域产生影响[4-5].
在分子热力学领域,实验(宏观热力学性质测量)、理论模型(宏观相平衡数据回归模型)和计算模拟(量子化学计算以及分子动力学模拟)是探索溶液体系结构性质的三种常用手段.目前对于溶液的微观结构还没有可以直接测量的实验手段,分子动力学模拟中存在所用力场的可靠性检验的问题,量子化学计算中所能计算的体系大小受到计算能力的限制,因而也不能全面反映离子液体的微观结构状态.近年来,谱学手段,特别是光谱手段已经在溶液结构和相互作用研究方面发挥着越来越重要的作用[6].常用光谱方法中的红外光谱和拉曼光谱,由于制样简单、测量方便快捷和能够给出溶液内部微观信息等优点,在离子液体结构测量以及相互作用研究中有着广泛应用,是研究离子液体的十分可靠的实验手段和表征方法.目前,关于离子液体的微观结构和相互作用研究已有部分综述工作,但大部分综述总结的都是分子动力学模拟方面的工作[7-10].利用谱学手段研究离子液体微观结构性质方面的综述工作相对较少.例如,Berg[11]综述了拉曼光谱和从头算计算方法在离子液体结构研究方面的工作.Castner等[12]综述了拉曼感应克尔效应光谱以及荧光光谱在离子液体分子间的相互作用以及溶剂化过程中结构变化研究中的应用.Hamaguchi等[13]对线性和非线性拉曼光谱在咪唑类离子液体局部结构研究中的应用做了综述.Wang等[14]对核磁共振波谱在测定离子液体及其在混合体系中的结构、动力学特征以及聚集行为等方面的应用做了综述.Giernoth等[15]综述了核磁共振波谱在离子液体结构探讨中的应用.然而,以上大部分综述工作多集中于一种谱学手段,对于红外光谱等光谱方法在离子液体微观结构研究应用方面的综述非常少.因而,本综述中,我们着重对红外光谱和拉曼光谱在离子液体结构以及相互作用研究中的应用进行了归纳总结,期待对后续工作有所启发.
1 红外光谱在离子液体结构与相互作用研究中的应用
红外光谱是由分子中振动能级或转动能级的跃迁而产生的,属于分子光谱.红外光谱的振动基频峰与化学键的强度之间有着密切的关系.红外光谱区间可以大致划分为三个区间,即近红外区(11000-4000 cm-1)、中红外区(4000-400 cm-1)和远红外区(400-10 cm-1).由于中红外区包含的光谱信息最丰富,因而绝大多数关于离子液体的红外光谱研究主要集中在该区域,这也是我们接下来要详细介绍的.
在离子液体结构,尤其是其中的氢键网络结构、离子对结构和离子聚集结构等的研究方面,红外光谱发挥着重要的作用.近年来,应用红外光谱研究离子液体结构的文献逐年增加[16-72].红外光谱的频率位移、峰强度变化和峰面积变化等性质,定性或定量地反映着离子液体中各种相互作用力以及结构的微小变化.许多红外手段,如变温红外、高压红外以及溶液体系中的变浓度红外光谱等都用于研究离子液体随外界温度、压强以及浓度变化而发生的结构变化.
1.1 红外光谱的峰强度及峰位移变化在离子液体及其混合体系结构研究中的应用
1.1.1 纯离子液体的结构
红外光谱的峰位移及强度的变化是反映离子液体体系中氢键作用的灵敏探针,它最早被用于研究离子液体的氢键行为,也是目前最常用的方法.早在1988年,美国空军研究院的Dymek等[16]就通过红外光谱研究氯化甲基乙基咪唑/氯铝酸型离子液体的结构特征,发现氯离子与咪唑环之间的作用导致咪唑环上的C2,4,5—H的振动频率发生了移动.咪唑类离子液体的分子结构式以及原子标号见图1.这表明氯离子不仅与咪唑环上的C2—H有氢键作用,而且由于离子液体的π-π堆积结构,氯离子与咪唑环的C4,5—H之间也有相互作用.这种对离子液体空间结构的初步猜测也和图2中用AM1方法优化所得的空间构型是比较一致的.Katsyuba等[17]通过比较纯离子液体以及CDCl2稀释的离子液体的红外光谱时,发现尽管咪唑环的C2—H与阴离子之间存在着氢键作用,但是与把阴阳离子紧紧结合在一起的库仑静电力相比,氢键作用是比较弱的.Carper等[18-19]通过拉曼和红外光谱以及密度泛函的理论计算,研究了咪唑型离子液体碳链从乙基变化到丁基过程中振动光谱的变化情况,发现阴阳离子之间存在着氢键作用,理论计算和光谱测量的结构吻合得很好.

然而,最近Lassègues等[20]通过同位素取代以及计算气态下阳离子的非谐频率的方法,对咪唑类离子液体阳离子咪唑环上的C—H伸缩振动峰进行了新的阐释.他们认为当烷基取代的咪唑类离子液体的阴离子为弱配位时,如二-(三氟磺酰亚胺)[(CF3SO2)2N-]、[P]等,则 3200-3000 cm-1区域主要为C—H伸缩振动与咪唑环的两个面内弯曲振动峰(1587和1535 cm-1)的费米共振的耦合模式.从而,该研究认为在阴离子为弱配位的离子时,咪唑阳离子与阴离子之间不存在直接的C—H…阴离子的强氢键作用.然而,Ludwig等[21]对此新的阐释方法提出了质疑,认为该观点与目前学术界关于咪唑环的C—H键与阴离子之间存在着强氢键作用的主流观点相悖.以往文献报道中认为,咪唑环的C2—H的伸缩振动频率比C4,5—H的伸缩振动频率要低大致40 cm-1,因而C2—H与阴离子之间形成的氢键作用要比C4,5—H更强.Ludwig等[21]结合IR频率红移以及NMR中的氢质子化学位移的变化,给出了咪唑环C—H与阴离子之间氢键作用的证据.Lassègues等[22]对Ludwig等的质疑作出回应,界定了只有在阴离子为弱配位的咪唑类离子液体中,该结论才是正确的.

1.1.2 离子液体混合体系的结构
红外光谱不仅在纯离子液体的结构探索中发挥着重要作用,而且对离子液体混合物体系结构的认识方面也有着不可替代的作用.离子液体混合物体系中研究较多的是离子液体/水体系、离子液体/有机物体系、离子液体/CO2体系.
1.1.2.1 离子液体/水、离子液体/有机物体系的结构
在离子液体/水溶液体系的红外光谱研究中,目前比较一致的结论是,水分子优先与离子液体的阴离子之间形成氢键作用.该结论是Kazarian等[23]通过衰减全反射红外光谱研究离子液体与从空气中吸收的水分之间的相互作用时最先发现的,目前该工作已被引用400多次,这一结论已经基本达成共识.从空气中吸收的少量水分子不会发生自身缔合,而是倾向于与离子液体的阴离子相互作用.在离子液体和水的相互作用中,阴离子起主导作用.随着水分含量的增加,如图3所示,红外光谱特征峰的峰形和位置都没有发生变化,因而他们认为水分子在离子液体中的存在形式只有一种,即两个水分子与阴离子 [B]、[P]之间形成对称的氢键结构A…H—O—H…A.水分子与阴离子间形成氢键能力的强弱顺序通过光谱位移可以估计出氢键的能量,该氢键的形成焓在 (8±13)kJ·mol-1范围内.Danten等[24]利用水分子的OH伸缩振动变化,研究了在大量离子液体中极少量水分子与四氟硼酸和六氟磷酸型咪唑类离子液体相互作用的情况.水分子在3600-3800 cm-1有两个清晰的峰,分别是水分子的OH对称伸缩振动ν1和不对称伸缩振动ν3.微量水在离子液体中主要还是与离子液体形成A…H—O—H…A的氢键作用,与Kazarian等报道不同的是,作者着重强调了三体静电力对阴阳离子之间的结合方式,以及对离子液体与水分子之间作用方式的重要影响.水分子与离子液体之间形成的氢键更具有静电性.李浩然课题组[25-28]在研究蓝移氢键的基础上,也利用红外光谱研究了咪唑类离子液体与有机溶剂二甲亚砜(DMSO)之间的氢键作用,并从本质上解释了该蓝移氢键形成的原因[29],及红外频率与氢键之间的关系[30].尉志武等[31]也对吡啶类离子液体与DMSO之间的氢键作用进行了详尽地探讨.

红外光谱还是研究离子液体中缔合作用的重要手段.Takamuku课题组[32]通过衰减全反射红外光谱(ATR-IR)以及2H NMR弛豫的方法研究1-甲基-3-乙基咪唑四氟硼酸离子液体[Emim][BF4]与水分子之间的相互作用情况.在XW(水的质量百分含量)<0.2时,水分子主要与离子液体的阴离子作用,而当XW>0.3时,有30%的水分子会自身发生缔合.同时也对不同浓度比[Emim][BF4]/D2O混合溶液进行2H NMR弛豫测量,计算出了水分子在离子液体中转动的活化能大概是(21.92±0.04)kJ·mol-1,解释了桥型氢键BF4…H—O—H…BF4限制了水分子在离子液体中的转动,这也是导致大量离子液体中少量水分子转动活化能相对较大的原因,NMR的结果也佐证了红外光谱得到的结论.同时,广角X射线散射实验的结果发现水分子的加入使得C2—H与B—F之间的距离变小,咪唑阳离子C2—H与四氟硼酸跟阴离子之间的作用增强,而与C4,5—H与四氟硼酸根阴离子之间的作用减弱.
值得一提的是,红外光谱的峰强度还可以用于过量谱的分析和处理,从而得到更为丰富的信息.尉志武等[33]通过对红外光谱的吸收强度进行过量谱分析,同时结合二维相关分析,研究了咪唑型离子液体与水的相互作用.过量红外光谱的分析结果发现,离子液体阴离子与水分子的氢键作用随着水含量的增加而增强,咪唑环上C—H与水分子的作用则被削弱.
1.1.2.2 离子液体/CO2体系的相互作用及结构
由于部分离子液体对CO2有一定的吸附作用,因而从分子水平上研究离子液体与CO2分子之间的相互作用对加深其吸附机理的认识就显得尤为重要.Kazarian等[34]是致力于该领域研究的先锋,他们采用衰减全反射红外光谱(ATR-IR)研究了高压下离子液体[Bmim][PF6]和[Bmim][BF4]吸收CO2的红外光谱,发现离子液体的阴离子与CO2分子存在着弱的路易斯酸碱作用.最近,该课题组[35]又结合衰减全反射红外光谱和透射红外光谱(transmission-IR)对[Bmim][PF6]和CO2分子之间插入苯分子后的分子间相互作用进行了研究.
Andanson等[36]通过红外光谱和拉曼光谱对CO2在离子液体[Bmim][PF6]中的溶解能力进行了定量分析.该课题组[37]还研究了离子液体/水/CO2三元体系的衰减全反射红外光谱,发现离子液体中的水分含量对CO2在离子液体中的溶解能力影响不大.Andanson等[38]发现由于离子液体的阴离子与CO2分子相互作用,生成碱性更强的新的阴离子[X-CO2]-(X为阴离子),从而影响溶解在离子液体中的CO2的分子状态.
1.2 用红外光谱峰面积研究离子液体/水溶液中结构变化
红外光谱中峰面积的变化可以定量反映离子液体中结构开始发生变化的浓度点.Kim等[39]通过红外光谱和拉曼光谱研究了1-甲基-3-丁基咪唑四氟硼酸离子液体[Bmim][BF4]/H2O体系中随浓度变化的结构变化情况.随着水分子的加入,咪唑环上的氮甲基以及丁基末端甲基C—H伸缩振动峰蓝移了10 cm-1左右.水分子的O—H伸缩振动区的波形变化,表明离子液体加入水中导致了水分子中的氢键网络结构逐步被打破.如图4和图5所示,峰频率位移以及峰面积的变化表明,当水的浓度为(32±2)和(45±2)mol·L-1时,[Bmim][BF4]/H2O 混合液体系在这两个浓度点会发生显著的结构变化.
1.3 用变温红外研究离子液体微观结构的化学平衡

变温红外光谱是研究物质相变、分子间相互作用,尤其是氢键作用、化学反应等物理和化学过程的有力工具.当物质发生相变后,晶格会破坏,分子之间的相互作用及分子的构型会发生变化,使红外光谱发生明显变化.而且随着温度的升高,分子之间的氢键作用会受到破坏,与分子间氢键有关的振动谱带的频率会发生位移,谱带的强度和形状都可能会发生变化,因而利用变温红外可以研究体系中是否存在氢键作用.离子液体阴阳离子之间存在氢键作用,因而变温红外可以得到阴阳离子结合强弱的信息.离子液体在微观上的结构到底是怎样的呢?是自由离子混合物,大的离子对,还是离子团簇?目前,该问题还没有被彻底认识清楚.Yokozeki等[40]研究了温度对咪唑类离子液体咪唑环C—H伸缩振动模式的影响.通过分析频率移动,峰形变化以及吸光度随温度变化的情况,建立了一个简单的力学模型和化学平衡模型,得到离子团簇或离子对断裂的吸热焓以及离子对或氢键团簇的解离度变化范围.但是具体的化学平衡过程不能仅通过红外光谱来预测,它仅能提供一些动力学和热力学的初步信息.

Ludwig等[41]用变温红外研究了二(三氟甲基磺酰亚胺)咪唑型离子液体的结构从273到343 K的变化情况,其中3050到3200 cm-1是咪唑环上C2—H和C4,5—H的伸缩振动峰.将C—H伸缩振动峰区域进行分峰,如图6所示,咪唑环上的C—H伸缩振动可以分成四个峰,分别是 3104、3125、3153和3174 cm-1,低波数的两个峰为C2—H伸缩振动峰,高波数的两个峰为C4,5—H的伸缩振动峰,这是由于C2上的正电性强一些,阴离子倾向于优先和C2—H作用.当C2,4,5—H三个质子全部与阴离子间形成氢键作用的时候,红外频率是处于低波数的,这种结构可以被归属为网络状结构的离子液体的C—H伸缩振动,当咪唑环上的三个C—H质子没有完全与阴离子作用,这时C—H伸缩振动峰处于较高波数,可以归属为离子对状结构的离子液体.随着温度的升高,离子液体的网络状结构在减少,离子对状结构在增加,这表明升高温度有利于离子液体中离子对的形成.
1.4 用高压红外光谱研究离子液体体系中的氢键作用及水溶液中微观结构变化

高压红外光谱主要用于研究样品在高压下的红外光谱变化.之所以区别于常压红外,是由于高压使化合物的密堆积增大,分子之间距离缩小,分子间作用力增强,从而导致化合物的空间结构发生变化.同时高压使分子内的化学键长度缩短,力常数增大,反映在红外上就是谱带的“蓝移”.此外,高压还可以使物质发生相变.张海洲课题组[42-46]在高压红外光谱研究溶液体系的氢键作用方面做了许多工作.
他们用高压红外研究氯化1-甲基-3-丁基咪唑离子液体[Bmim][Cl]在水中的结构特点.随着水的大量加入,丁基侧链的C—H振动频率发生蓝移,这表明在富水区,离子液体的烷基链与水分子之间有氢键作用形成[43].咪唑环上的C—H伸缩振动随压强增大呈现无规则不单调变化,这表明咪唑环的C—H与水分子团簇之间的C—H…O作用随压强增大是不断增强的.C2—H伸缩振动频率的变化可以反映阴阳离子之间的相互作用.他们早期的高压红外光谱研究工作也发现离子液体中的电荷作用导致C—H…O作用增强[44].
该课题组[45]还用高压红外光谱研究了离子液体/水混合物中离子聚集结构的改变状态.分别对两种咪唑型离子液体纯物质以及水混合物中的红外光谱从常压到2.5 GPa进行测量,发现离子液体随着压强增大倾向于以网络结构存在.对于离子液体/水混合体系,咪唑环上的C—H伸缩振动在高压下分裂成四个峰,新出现的两个峰位于3117和3190 cm-1,可以被归属为咪唑环C—H与水分子之间的相互作用峰.在高压下咪唑环烷基链也在3025 cm-1出现了一个新的峰,这表明水在烷基链附近形成了一定的结构.水分子的O—H伸缩吸收峰显示在离子液体/水混合体系中有两种水分子状态:自由状态的O—H和与离子液体形成氢键的O—H.实验表明,随着压强的增大,混合物中自由的O—H逐渐减少,而与离子液体结合的O—H逐渐稳定.水分子的存在,削弱了阴阳离子之间的氢键作用[46].同时,作者比较了[Bmim][BF4]/H2O体系与[Bmim][BF4]/CH3OH体系中相互作用模式的异同,发现在离子液体/醇体系中,随着压强的增大,自由状态的O—H并没有减少并且稳定存在,甲醇分子的氢键协同效应及其结构的特点可能是造成与离子液体/水体系作用模式差异的原因.
1.5 用基质隔离傅里叶红外光谱(matrix-isolation FTIR)研究离子液体蒸发时的结构特点
离子液体在气态的结构也是学术界研究的热点,存在着诸多争议,如Cooks等[47]发现气态中孤立的阳离子的存在;Eberlin等[48]发现1-丁基-2,3-二甲基咪唑·三乙基硫双(三氟甲基磺酰)亚胺([Bdmim+][NT])在气态下以中性缔合体形式存在;质子型离子液体1-甲基咪唑·乙酸丁酯([Hmim+][CH3COO-])气态下质谱的实验结果认为该离子液体在气态下以中性分子对形式存在,并不存在缔合[49].这些结论主要是通过质谱得到的.基质隔离的红外光谱也能够给出离子液体在气态下的结构特征.如Shibuya等[50]通过Ne基质隔离红外光谱,发现咪唑型离子液体在气态时呈现阴阳离子1∶1的离子对的形式存在.
1.6 通过红外振动频率变化来预测离子液体的酸性、极性、熔点等物理化学性质
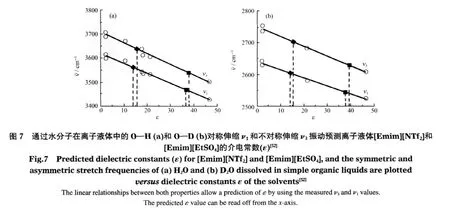
寇元等[51]以吡啶和乙腈分子为探针,用红外光谱法研究了常用室温离子液体的酸性.采用吡啶为探针分子时,出现在1450和1540 cm-1吸收带可以分别指示离子液体的Lewis和Brønsted酸性;采用乙腈为探针分子时,位于2253 cm-1的C=N伸缩振动向高波数移动并伴有新峰的出现,可以指示离子液体的Lewis酸性.Ludwig课题组[52]通过研究离子液体中水分子的聚集状态来预测离子液体的极性.离子液体的极性通常采用溶剂化变色试剂的变化以及荧光探针等方法来测量,非常不方便.利用水分子在离子液体和其他有机溶剂中的OH对称伸缩振动ν1和不对称伸缩振动ν3的差值(如图7所示),可以来推测离子液体的介电常数.采用该法得到[Bmim][BF4]的介电常数为14.9,这和通过微波介电光谱仪测得的介电常数值(11.7±0.7)非常接近.这种方法可以用于测量其他离子液体的介电常数值.然而,此方法仅适应于测量碳链较短的离子液体,对有些在水溶液中存在极性和非极性区域的咪唑类离子液体介电常数的测量,该方法的准确性还有待进一步验证.
离子液体的红外伸缩振动模式可以关联离子液体的结构、振动频率和熔点之间的关系.Katsyuba等[53]利用振动光谱和密度泛函理论研究咪唑型离子液体中离子对的可能结构.通过量子化学计算预测了各种可能的位置组合的阴阳离子的振动光谱,发现阳离子的振动模式不仅和阳离子自身结构有关,而且还与阴阳离子之间的结合情况有关.阴阳离子之间的聚集,对咪唑环上C—H伸缩振动以及阴离子的伸缩振动有着显著的影响,其他的振动模式所受影响非常小,从而可以将阴阳离子之间相互作用的模式单独区分出来,将离子对之间的偶合模式视为非谐振子振动模式.这个简单的模型可以关联离子液体的结构、振动频率和熔点之间的关系.Hunt[54]通过比较研究C2—H未被甲基取代和被甲基取代后的氯化咪唑型离子液体的振动光谱,并结合量子化学计算,解释了C2—H甲基取代后熔点和黏度增大而非减小的原因,他们初步猜想可能是熵的减小程度要大于氢键减少的程度.
2 二维红外光谱在研究离子液体与水分子相互作用中的应用
二维相关分析光谱是Noda博士首先提出的[55],由于其能分辨重叠的波谱,能给出在外界扰动下发生变化的先后顺序信息等,近年来被广泛地应用于振动光谱的二维相关分析方面.
二维相关红外光谱可以区分不同阴阳离子的离子液体与水分子作用的不同模式.Lendl等[56]利用二维相关红外光谱和多元曲线分辨技术研究了离子液体/水体系及离子液体/甲醇体系中水分子和甲醇分子的聚集状态.在所研究的三个咪唑类离子液体与甲醇的混合物中,甲醇在浓度高于0.8%(质量分数)时便倾向于形成二聚体.[Emim][BF4]/H2O和[Bmim][BF4]/H2O体系中当水分子的浓度高于此浓度时也倾向于自身缔合,但是在疏水性离子液体[Bmim][PF6]中却没有发现水的二聚体形式.二维相关分析是探测分子间氢键作用的一个有力工具,它能给出混合溶液中随浓度变化,水分子或甲醇分子在离子液体中的不同存在状态.
二维相关红外光谱可以给出浓度扰动下结构变化的动态信息.如李浩然课题组[57]用二维相关红外光谱技术研究了[Emim][BF4]/H2O体系的溶剂化过程.研究发现,离子液体在水中的溶剂化过程如下:随着混合体系中水的摩尔分数的增加,离子液体和水分子的结构都在随之发生变化,水分子优先与离子液体阴离子作用,其次才与阳离子作用.离子液体中阴阳离子之间的氢键网络结构逐步被破坏,混合液中开始出现离子团簇结构,然后离子团簇又进一步解离为溶剂分子包围的离子对结构.水分子包围的离子对结构成为此浓度范围内离子液体存在的主要形式.尉志武课题组[33]也利用二维相关光谱,研究了随着水含量的增加,咪唑型离子液体与水的相互作用.
二维相关红外光谱还可以给出温度扰动下结构变化的动态信息.武培怡课题组[58]利用二维相关红外光谱技术研究了离子液体[Bmim][BF4]和水(2.5%,摩尔分数)混合液在80℃时等温加热时离子液体与水分子之间的相互作用.他们主要关注了三个红外振动谱带,即OH伸缩振动谱带(3755-3300 cm-1)、咪唑环上C—H的伸缩振动峰(3300-3020 cm-1)与阴离子B—F的伸缩振动峰(1310-1260 cm-1)的变化.通过对离子液体/水混合液等温加热下红外谱图的分析,发现咪唑环上C—H的伸缩振动峰面积和阴离子B—F的伸缩振动峰面积有一个有趣的“V”形变化.在加热过程中,由于水的蒸发,使得水分子与阴阳离子之间的氢键作用减少,从而“V”形变化的前半部分是下降的.同时阴阳离子之间的静电作用逐渐增强,导致“V”形变化的后半部分是上升的.
3 近红外光谱在研究离子液体/水/醇体系氢键作用中的应用
近红外光谱是介于可见光区和中红外光区之间的光谱,其波长范围为0.75-2.5 μm,对应的波数范围为13330-4000 cm-1.中红外区出现的吸收谱带主要是分子基频振动吸收谱带,近红外区出现的吸收谱带基本上都是分子倍频振动和合频振动吸收谱带.近红外光谱是有机物定性、定量和结构分析的最有效的手段之一,它具有快捷、无损、测试样品的形态广、适用性强等优点,成功地应用于各个领域.由于近红外光在光纤中有着良好的传输特性,可以进行在线检测,用于监测化学反应的进程.其缺点是近红外光谱的变动性比较大,样品状态、测定方式及测定条件都会影响测量结果,且灵敏度不够高.
Wang等[59]用近红外光谱和二维相关红外光谱分析的方法研究了甲醇对两种离子液体水溶液结构的影响.在 [Amim][Cl]/H2O混合液中,甲醇会与水分子竞争咪唑环的C2—H,与水分子竞争C4,5—H的相互作用小些,但是在[Bmim][BF4]/H2O中,甲醇分子与咪唑环的C2—H和C4,5—H的作用是差不多的.
Tran等[60]用近红外光谱研究了咪唑类离子液体[Bmim][BF4]、[Bmim][PF6]和[Bmim][Tf2N]在空气中的吸水量以及对其结构的影响.[B]与水分子之间的作用最强,与[P]之间的作用最弱.在24 h内,[Bmim][BF4]对水分的吸收能力远强于[Bmim][PF6].
4 远红外光谱在研究离子液体中阴阳离子之间氢键作用的应用
远红外光谱区位于400-10 cm-1,在该区域内能观察到的谱带大致可以分为以下几类:重原子之间的伸缩振动和弯曲振动;晶格振动;分子间氢键振动;气体或液体分子的扭转振动;环状分子的环变形(环折叠)振动;气体分子的纯转动.
远红外光谱可以给出离子液体在低波数范围的阴阳离子分子内及分子间的氢键作用信息.结合远红外光谱测量和从头算方法,Fumino等[61]研究了咪唑类离子液体中阴阳离子之间的作用能.他们发现最低波数的频率可以归属为阴阳离子之间形成的氢键+CH—A-的弯曲和伸缩振动模式.随着不同阴离子与咪唑阳离子之间形成离子氢键的强度的增大,该氢键的伸缩振动模式会移向高波数,这也和计算所得的阴阳离子之间的平均结合能相关,清楚地反映阴阳离子之间作用能的大小.该课题组[62-63]研究表明咪唑类离子液体的性质可以通过调节离子液体体系中的氢键作用及库仑静电作用的比值来加以调节.对于[Emim][NTf2]这种相互作用在远红外区特别明显,位于83.5 cm-1的峰是氢键作用的体现,而位于100-200 cm-1之间的红外峰则是库仑静电力的体现.Ludwig课题组[64]运用远红外光谱研究了胺型离子液体的空间结构,通过计算归属199和224 cm-1为NH…O氢键的对称伸缩振动,134和159 cm-1为NH…O氢键的不对称伸缩振动(νas(HBs)和νss(HBs),如图8所示.该低波数的振动和水分子的振动模式比较类似,都可以形成三维空间氢键网络结构.不同的是,水分子可以形成四面体形结构单元的氢键网络结构,如图9所示,然而胺型离子液体形成的氢键网络结构却不是四面体结构单元.因此远红外光谱是离子液体体系中阴阳离子之间相互作用强度和类型的非常灵敏的探针.
通过分子动力学模拟得到的远红外光谱和实验测得的光谱进行比较,可以对模拟中力场的好坏进行检验.Ludwig课题组[65]利用远红外光谱的测量,成功地对咪唑类离子液体的蒸发焓进行了预测.该课题组[66]还探讨了远红外光谱对离子液体分子动力学模拟力场发展的贡献.分子力场的参数通常是通过中子散射或X射线衍射得到的成对相关能,核磁共振得到的自扩散系数以及蒸汽压测量得到的蒸发热得到的.然而,离子液体的很多性质现在无法准确测得.因此通过对离子液体远红外区振动光谱的测量结果,来验证分子动力学模拟力场的好坏是一个非常有效的办法.

远红外光谱还可以用来研究离子液体与水分子之间的相互作用.Lendl等[67]通过远红外光谱来研究离子液体和水分子之间的相互作用.在600至20 cm-1范围内研究了两种亲水性和一种疏水性离子液体与水分子之间的相互作用.在远红外区300 cm-1以上是水分子与离子液体相互作用最强的谱带区.该峰的位置可以反映离子液体与水分子之间作用力的强弱.在[B]型离子液体中,200 cm-1以下发现了由水分子和阴离子之间形成的氢键,但是在[P]型离子液体中,却没有发现类似的谱带,说明水分子与[P]的作用非常弱.借助多元曲线分辨的方法,发现在亲水性离子液体中存在水分子的二聚体,而在疏水性离子液体中,却没有发现水分子的二聚体形式.
还有很多用红外光谱研究离子液体结构的工作[68-72],限于篇幅本文难以一一提及.

5 拉曼光谱在研究离子液体微观结构中的应用
拉曼散射的产生与分子的极化率变化是密切相关的.拉曼散射光和瑞利散射光的频率之差称为拉曼位移,位移值相对的能量变化对应于分子的振动和转动能级的能量差.红外光谱是分子在振动跃迁过程中有偶极矩的改变,而拉曼光谱是分子在振动跃迁过程中有极化率的改变,所以对于与对称中心有对称关系的振动,红外测不出,拉曼可测出,因此拉曼光谱是红外光谱的补充.拉曼光谱的主要优点是能够提供所谓“分子指纹”的振动峰的信息,从而对离子液体结构的细微变化会有反应.同时,拉曼光谱可以测量许多不同状态的体系的振动光谱,尤其是反映离子液体中存在的局部结构变化[13,73-93].目前,用于离子液体研究的主要是傅里叶变换拉曼(FTRaman)和共聚焦拉曼(confocal Raman microscope).
5.1 用拉曼光谱研究阴阳离子中的顺反构象现象
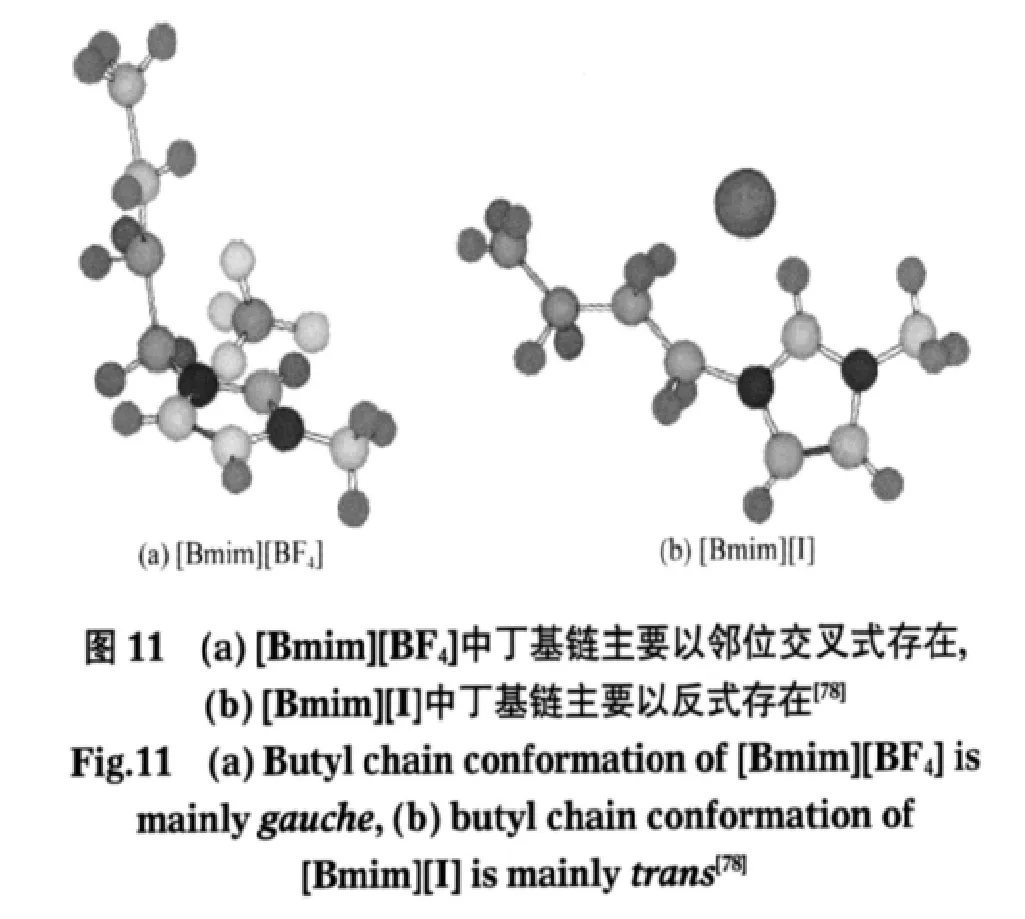
拉曼光谱可以用于测量离子液体的构型变化[73-81].Hayashi等[74]利用拉曼光谱测量离子液体咪唑环侧链烷基链的顺反构型变化.625 cm-1对应丁基链反式(trans)构型,600 cm-1对应丁基链交叉式(gauche)构型,两者的比率可以反映离子液体中不同异构体的比例.Holomb课题组[75]也利用红外和拉曼光谱研究了[Bmim][BF4]离子液体中由于丁基链的顺反形成的各种不同的分子构型.Berg课题组[76]通过拉曼光谱研究了离子液体[Bmim][PF6]、[C6mim][Cl]和[C6mim][PF6]的结构.[Bmim+]的拉曼光谱显示丁基碳链有顺式和反式两种结构,这也是长链离子液体中普遍存在的结构特点.Ishiguro课题组[77]结合拉曼光谱和量子化学计算研究了离子液体的阴离子二三氟甲基磺酰亚胺(TFSI-)在液态的两种不同对称性C1和C2的异构体之间的转化焓.Kim课题组[78]还通过振动光谱研究了不同阴离子对离子液体结构的影响.在离子液体/水混合物中,随着水含量的变化,[Bmim][BF4]的红外谱图没有明显的变化,而[Bmim][I]的红外谱图却变化明显.[Bmim][I]与D2O的混合有利于咪唑环上酸性最强的H质子与D2O发生同位素交换,然而[Bmim][BF4]与D2O即使混合较长时间也不会发生任何同位素交换.同时,如图10所示,拉曼光谱在600 cm-1的波数变化表明[Bmim][BF4]和[Bmim][I]的丁基链构型随着水浓度的变化而变化,[Bmim][I]中的丁基链主要以反式存在,而[Bmim][BF4]中丁基链主要以顺式存在(如图11所示).Berg等[79]通过拉曼光谱研究发现,胍类离子液体中的低对称性结构是导致该类离子液体常温下呈液体的主要原因.
5.2 用拉曼光谱研究离子液体/水混合体系中的相互作用及微观结构变化
Hamaguchi等[82]通过拉曼光谱和X射线单晶衍射仪研究了有水和无水存在情况下,氯化1-丁腈-3-甲基咪唑型离子液体的分子结构变化的情况.水分子的存在改变了丁腈的结构,这可能是由于水分子和阴离子之间的氢键作用导致离子液体排布松散造成的.这也表明,水分子的存在对于离子液体结构有着很大的影响,这也是在离子液体研究和应用中必须检测离子液体中是否含水的重要原因.Berg等[83]结合拉曼光谱和量子化学计算,发现胍类离子液体在水溶液和乙醇中通过N—H+…Cl-作用形成二聚体结构,然而在225℃时,该离子液体在气态下的拉曼光谱在2229 cm-1处出现气态下由N—H+…Cl-作用牢牢结合在一起的离子对“分子”结构的特征峰.Fazio课题组[84]研究了水分子对离子液体[Bmim][BF4]结构变化的影响.对3000-3800 cm-1波段的拉曼光谱和红外光谱的分析,发现离子液体中水分含量非常少时,水分子之间会迅速聚集.水含量进一步增大时,水分子间会局部聚集成空间网络状结构.水分子加入,使得离子液体极性基团倾向于与水分子作用,而疏水性的碳链基团却聚集在一起形成类似于胶束的结构.在水的摩尔分数大于0.7时,离子液体离子对之间的作用会极大地削弱.

5.3 用拉曼光谱研究离子液体与溶质分子之间的相互作用
拉曼光谱还可以用于离子液体与溶质分子之间相互作用的研究[85-87].Fujisawa等[85]应用拉曼光谱研究离子液体与二苯基环丙烯酮以及苯酚蓝之间的相互作用情况.Hamaguchi等[86]用皮秒时间分辨拉曼光谱仪研究了反1,2-二苯乙烯与离子液体的相互作用情况.Schafer等[87]采用共聚焦拉曼光谱研究了离子液体与高分子膜之间的相互作用.
5.4 用拉曼光谱研究含金属的离子液体的微观结构及相互作用
拉曼光谱可以用于测量含金属的离子液体的结构特征.Sitze等[88]采用拉曼光谱和从头算量子化学的方法研究了[Bmim][Cl]/FeCl2·FeCl3形成的离子液体体系结构,对不同比例会出现的FeCl、FeC、Fe2C阴离子的结构做了表征.Rubim等[89]采用拉曼光谱研究了[Bmim][Cl]/ZnCl2以及[Bmim][Cl]/NbCl5不同比例混合所得离子液体的结构.常用于电池电解质材料的锂离子在离子液体中有着良好的溶解性能,因而近年来锂离子与离子液体的相互作用研究也是热点[90-95].Passerini等[91]用拉曼光谱研究了吡啶类离子液体与锂盐的相互作用.Ishiguro等[92]研究了锂盐Li+TFSI-在阴离子为TFSI-的离子液体随浓度变化的拉曼光谱,发现位于744 cm-1的自由态的锂离子的特征峰强度随着锂离子浓度增加而不断削弱,从而得出离子液体的TFSI-阴离子与锂离子相配位,锂离子可能与两个TFSI-阴离子的四个氧原子之间形成四配位的结构.Torresi等[93]对Li+TFSI-在四氟硼酸1-丁基-2,3-二甲基咪唑离子液体中随浓度变化的拉曼光谱进行了研究,发现两种不同的聚集体构型.Jacobsson等[94-95]结合拉曼光谱和量子化学计算,对锂离子与离子液体阴离子之间的配位能力进行了研究.
从上述可以看出,红外光谱与拉曼光谱已经成为研究离子液体微观结构与相互作用的重要手段[96-110],本综述只是从一个侧面来反映该领域的进展,难免挂一漏万.
6 结束语
总结归纳离子液体结构与振动光谱性质之间的相互关系,对于加深理解离子液体的结构与性质之间的关系有着举足轻重的意义.尽管目前该领域已经取得了部分进展,但是还有许多争议以及科学问题存在.譬如说离子液体在液态以及溶液中的结构到底是怎样的,是以自由离子、离子对还是离子簇的结构存在,是否存在各种结构的平衡,平衡常数如何来计算等系列问题,还有待于进一步探讨研究.而且目前红外光谱与拉曼光谱性质研究较多的是咪唑型离子液体,其它类型的离子液体研究还相对较少.同时,利用红外光谱与拉曼光谱定性研究比较多,定量研究还比较少,这些都是未来具有挑战性的研究领域.
1 Brennecke,J.F.;Maginn,E.J.AIChE J.,2001,47:2384
2 Chiappe,C.;Pieraccini,D.J.Phys.Org.Chem.,2005,18:275
3 Endres,F.;El Abedin,S.Z.Phys.Chem.Chem.Phys.,2006,8:2101
4 Seddon,K.R.Green Chem.,2002,4:G25
5 Zhang,S.J.;Yao,X.Q.;Liu,X.M.;Wang,J.Q.Progress in Chemistry,2009,21:2465 [张锁江,姚晓倩,刘晓敏,王金泉.化学进展,2009,21:2465]
6 Johnston,K.P.;Meredith,J.C.;Harrison,K.L.Fluid Phase Equilib.,1996,116:385
7 Padua,A.A.H.;Gomes,M.F.;Lopes,J.Acc.Chem.Res.,2007,40:1087
8 Shim,Y.;Jeong,D.;Manjari,S.;Choi,M.Y.;Kim,H.J.Acc.Chem.Res.,2007,40:1130
9 Lynden-Bell,R.M.;Del Popolo,M.G.;Youngs,T.G.A.;Kohanoff,J.;Hanke,C.G.;Harper,J.B.;Pinilla,C.C.Acc.Chem.Res.,2007,40:1138
10 Wang,Y.;Jiang,W.;Yan,T.;Voth,G.A.Acc.Chem.Res.,2007,40:1193
11 Berg,R.W.Monatshefte Fur Chemie,2007,138:1045
12 Castner,E.W.;Wishart,J.F.;Shirota,H.Acc.Chem.Res.,2007,40:1217
13 Iwata,K.;Okajima,H.;Saha,S.;Hamaguchi,H.O.Acc.Chem.Res.,2007,40:1174
14 Zhai,C.P.;Liu,X.J.;Wang,J.J.Progress in Chemistry,2009,21:1040 [翟翠萍,刘学军,王键吉.化学进展,2009,21:1040]
15 Bankmann,D.;Giernoth,R.Progress in Nuclear Magnetic Resonance Spectroscopy,2007,51:63
16 Dieter,K.M.;Dymek,C.J.;Heimer,N.E.;Rovang,J.W.;Wilkes,J.S.J.Am.Chem.Soc.,1988,110:2722
17 Katsyuba,S.A.;Dyson,P.J.;Vandyukova,E.E.;Chernova,A.V.;Vidis,A.Helvetica Chimica Acta,2004,87:2556
18 Talaty,E.R.;Raja,S.;Storhaug,V.J.;Dolle,A.;Carper,W.R.J.Phys.Chem.B,2004,108:13177
19 Heimer,N.E.;Del Sesto,R.E.;Meng,Z.Z.;Wilkes,J.S.;Carper,W.R.J.Mol.Liquids,2006,124:84
20 Lassègues,J.C.;Grondin,J.;Cavagnat,D.;Johansson,P.J.Phys.Chem.A,2009,113:6419
21 Wulf,A.;Fumino,K.;Ludwig,R.J.Phys.Chem.A,2010,114:685
22 Lassègues,J.C.;Grondin,J.;Cavagnat,D.;Johansson,P.J.Phys.Chem.A,2010,114:687
23 Cammarata,L.;Kazarian,S.G.;Salter,P.A.;Welton,T.Phys.Chem.Chem.Phys.,2001,3:5192
24 Danten,Y.;Cabaco,M.I.;Besnard,M.J.Phys.Chem.A,2009,113:2873
25 Xu,Z.;Li,H.R.;Wang,C.M.ChemPhysChem,2006,7:2460
26 Xu,Z.;Li,H.R.;Wang,C.M.;Pan,H.H.;Han,S.J.J.Chem.Phys.,2006,124:244502
27 Zhang,R.;Li,H.R.;Lei,Y.;Han,S.J.J.Mol.Struct.,2004,693:17
28 Xu,Z.;Li,H.R.;Wang,C.M.;Wu,T.;Han,S.J.Chem.Phys.Lett.,2004,394:405
29 Zhang,L.Q.;Wang,Y.;Xu,Z.;Li,H.R.J.Phys.Chem.B,2009,113:5978
30 Gao,Y.;Zhang,L.Q.;Wang,Y.;Li,H.R.J.Phys.Chem.B,2010,114:2828
31 Wang,N.N.;Zhang,Q.G.;Wu,F.G.;Li,Q.Z.;Yu,Z.W.J.Phys.Chem.B,2010,114:8689
32 Takamuku,T.;Kyoshoin,Y.;Shimomura,T.;Kittaka,S.;Yamaguchi,T.J.Phys.Chem.B,2009,113:10817
33 Zhang,Q.G.;Wang,N.N.;Yu,Z.W.J.Phys.Chem.B,2010,114:4747
34 Kazarian,S.G.;Briscoe,B.J.;Welton,T.Chem.Commun.,2000:2047
35 Sakellarios,N.I.;Kazarian,S.G.J.Chem.Thermodyn.,2005,37:621
36 Andanson,J.M.;Jutz,F.;Baiker,A.J.Phys.Chem.B,2009,113:10249
37 Andanson,J.M.;Jutz,F.;Baiker,A.J.Phys.Chem.B,2010,114:2111
38 Andanson,J.M.;Jutz,F.;Baiker,A.J.Phys.Chem.B,2009,113:114
39 Jeon,Y.;Sung,J.;Kim,D.;Seo,C.;Cheong,H.;Ouchi,Y.;Wawa,R.;Hamaguchi,H.O.J.Phys.Chem.B,2008,112:923
40 Yokozeki,A.;Kasprzak,D.J.;Shiflett,M.B.Phys.Chem.Chem.Phys.,2007,9:5018
41 Koddermann,T.;Wertz,C.;Heintz,A.;Ludwig,R.ChemPhysChem,2006,7:1944
42 Umebayashi,Y.;Jiang,J.C.;Lin,K.H.;Shan,Y.L.;Fujii,K.;Seki,S.;Ishiguro,S.I.;Lin,S.H.;Chang,H.C.J.Chem.Phys.,2009,131:7
43 Chang,H.C.;Jiang,J.C.;Chang,C.Y.;Su,J.C.;Hung,C.H.;Liou,Y.C.;Lin,S.H.J.Phys.Chem.B,2008,112:4351
44 Chang,H.C.;Jiang,J.C.;Tsai,W.C.;Chen,G.C.;Lin,S.H.J.Phys.Chem.B,2006,110:3302
45 Chang,H.C.;Jiang,J.C.;Liou,Y.C.;Hung,C.H.;Lai,T.Y.;Lin,S.H.J.Chem.Phys.,2008,129:044506
46 Umebayashi,Y.;Jiang,J.C.;Shan,Y.L.;Lin,K.H.;Fujii,K.;Seki,S.;Ishiguro,S.I.;Lin,S.H.;Chang,H.C.J.Chem.Phys.,2009,130:124503
47 Chen,H.;Zheng,O.Y.;Cooks,R.G.Angew.Chem.Int.Edit.,2006,45:3656
48 Neto,B.A.D.;Santos,L.S.;Nachtigall,F.M.;Eberlin,M.N.;Dupont,J.Angew.Chem.Int.Edit.,2006,45:7251
49 Leal,J.P.;Esperanca,J.;da Piedade,M.E.M.;Lopes,J.N.C.;Rebelo,L.P.N.;Seddon,K.R.J.Phys.Chem.A,2007,111:6176
50 Akai,N.;Parazs,D.;Kawai,A.;Shibuya,K.J.Phys.Chem.B,2009,113:4756
51 Wang,X.H;Tao,G.H.;Wu,X.M.;Kou,Y.Acta Phys.-Chim.Sin.,2005,21:528 [王晓化,陶国宏,吴晓牧,寇 元.物理化学学报,2005,21:528]
52 Koddermann,T.;Wertz,C.;Heintz,A.;Ludwig,R.Angew.Chem.Int.Edit.,2006,45:3697
53 Katsyuba,S.A.;Zvereva,E.E.;Vidis,A.;Dyson,P.J.J.Phys.Chem.A,2007,111:352
54 Hunt,P.A.J.Phys.Chem.B,2007,111:4844
55 Noda,I.J.Am.Chem.Soc.,1989,111:8116
56 Lopez-Pastor,M.;Ayora-Canada,M.J.;Valcarcel,M.;Lendl,B.J.Phys.Chem.B,2006,110:10896
57 Zhang,L.Q.;Xu,Z.;Wang,Y.;Li,H.R.J.Phys.Chem.B,2008,112:6411
58 Sun,B.J.;Jin,Q.;Tan,L.S.;Wu,P.Y.;Yan,F.J.Phys.Chem.B,2008,112:14251
59 Wu,B.;Zhang,Y.M.;Wang,H.P.J.Phys.Chem.B,2009,113:12332
60 Tran,C.D.;Lacerda,S.H.D.;Oliveira,D.Appl.Spectrosc.,2003,57:152
61 Fumino,K.;Wulf,A.;Ludwig,R.Angew.Chem.Int.Edit.,2008,47:3830
62 Fumino,K.;Wulf,A.;Ludwig,R.Angew.Chem.Int.Edit.,2008,47:8731
63 Fumino,K.;Wulf,A.;Ludwig,R.Phys.Chem.Chem.Phys.,2009,11:8790
64 Fumino,K.;Wulf,A.;Ludwig,R.Angew.Chem.Int.Edit.,2009,48:3184
65 Fumino,K.;Wulf,A.;Verevkin,S.P.;Heintz,A.;Ludwig,R.ChemPhysChem,2010,11:1623
66 Koddermann,T.;Fumino,K.;Ludwig,R.;Lopes,J.N.C.;Padua,A.A.H.ChemPhysChem,2009,10:1181
67 Dominguez-Vidal,A.;Kaun,N.;Ayora-Canada,M.J.;Lendl,B.J.Phys.Chem.B,2007,111:4446
68 Buffeteau,T.;Grondin,J.;Lassegues,J.C.Appl.Spectrosc.,2010,64:112
69 Liu,Y.;Gong,X.D.;Wang,G.X.;Wang,L.J.;Xiao,H.M.Chin.J.Chem.,2010,28:149
70 Kiefer,J.;Obert,K.;Bömann,A.;Seeger,T.;Wasserscheid,P.;Leipertz,A.ChemPhysChem,2008,9:1317
71 Wu,Y.;Zhang,T.T.;Yu,N.Acta Phys.-Chim.Sin.,2009,25:1689 [吴 阳,张甜甜,于 宁.物理化学学报.,2009,25:1689]
72 Wulf,A.;Fumino,K.;Ludwig,R.Angew.Chem.Int.Edit.,2010,49:449
73 Umebayashi,Y.;Mitsugi,T.;Fujii,K.;Seki,S.;Chiba,K.;Yamamoto,H.;Lopes,J.N.C.;Padua,A.A.H.;Takeuchi,M.;Kanzaki,R.;Ishiguro,S.J.Phys.Chem.B,2009,113:4338
74 Katayanagi,H.;Hayashi,S.;Hamaguchi,H.O.;Nishikawa,K.Chem.Phys.Lett.,2004,392:460
75 Holomb,R.;Martinelli,A.;Albinsson,I.;Lassegues,J.C.;Johansson,P.;Jacobsson,P.J.Raman Spectrosc.,2008,39:793
76 Berg,R.W.;Deetlefs,M.;Seddon,K.R.;Shim,I.;Thompson,J.M.J.Phys.Chem.B,2005,109:19018
77 Fujii,K.;Fujimori,T.;Takamuku,T.;Kanzaki,R.;Umebayashi,Y.;Ishiguro,S.I.J.Phys.Chem.B,2006,110:8179
78 Jeon,Y.;Sung,J.;Seo,C.;Lim,H.;Cheong,H.;Kang,M.;Moon,B.;Ouchi,Y.;Kim,D.J.Phys.Chem.B,2008,112:4735
79 Berg,R.W.;Riisager,A.;Van Buu,O.N.;Fehrmann,R.;Harris,P.;Tomaszowska,A.A.;Seddon,K.R.J.Phys.Chem.B,2009,113:8878
80 Herstedt,M.;Smirnov,M.;Johansson,P.;Chami,M.;Grondin,J.;Servant,L.;Lassegues,J.C.J.Raman Spectrosc.,2005,36:762
81 Umebayashi,Y.;Fujimori,T.;Sukizaki,T.;Asada,M.;Fujii,K.;Kanzaki,R.;Ishiguro,S.J.Phys.Chem.A,2005,109:8976
82 Saha,S.;Hamaguchi,H.O.J.Phys.Chem.B,2006,110:2777
83 Berg,R.W.;Riisager,A.;Fehrmann,R.J.Phys.Chem.A,2008,112:8585
84 Fazio,B.;Triolo,A.;Di Marco,G.J.Raman Spectrosc.,2008,39:233
85 (a)Kimura,Y.;Fukuda,M.;Fujisawa,T.;Terazima,M.Chem.Lett.,2005,34:338(b)Fujisawa,T.;Fukuda,M.;Terazima,M.;Kimura,Y.J.Phys.Chem.A,2006,110:6164
86 Iwata,K.;Yoshida,K.;Takada,Y.;Hamaguchi,H.Chem.Lett.,2007,36:504
87 Schafer,T.;Di Paolo,R.E.;Franco,R.;Crespo,J.G.Chem.Commun.,2005:2594
88 Sitze,M.S.;Schreiter,E.R.;Patterson,E.V.;Freeman,R.G.Inorg.Chem.,2001,40:2298
89 Alves,M.B.;Santos,V.O.;Soares,V.C.D.;Suarez,P.A.Z.;Rubim,J.C.J.Raman Spectrosc.,2008,39:1388
90 Hardwick,L.J.;Holzapfel,M.;Wokaun,A.;Novak,P.J.Raman Spectrosc.,2007,38:110
91 Castriota,M.;Caruso,T.;Agostino,R.G.;Cazzanelli,E.;Henderson,W.A.;Passerini,S.J.Phys.Chem.A,2005,109:92
92 Umebayashi,Y.;Mitsugi,T.;Fukuda,S.;Fujimori,T.;Fujii,K.;Kanzaki,R.;Takeuchi,M.;Ishiguro,S.I.J.Phys.Chem.B,2007,111:13028
93 Monteiro,M.J.;Bazito,F.F.C.;Siqueira,L.J.A.;Ribeiro,M.C.C.;Torresi,R.M.J.Phys.Chem.B,2008,112:2102
94 Johansson,P.;Beranger,S.;Armand,M.;Nilsson,H.;Jacobsson,P.Solid State Ionics,2003,156:129
95 Scheers,J.;Johansson,P.;Jacobsson,P.J.Electrochem.Soc.,2008,155:A628
96 Gao,Y.N.;Li,N.;Li,X.W.;Zhang,S.H.;Zheng,L.Q.;Bai,X.T.;Yu,L.J.Phys.Chem.B,2009,113:123
97 Gordon,P.G.;Brouwer,D.H.;Ripmeester,J.A.ChemPhysChem,2010,11:260
98 Lei,S.;Zhang,J.;Huang,J.B.Acta Phys.-Chim.Sin.,2007,23:1657 [雷 声,张 晶,黄建滨.物理化学学报,2007,23:1657]
99 Lungwitz,R.;Spange,S.New J.Chem.,2008,32:392
100 Schroder,U.;Wadhawan,J.D.;Compton,R.G.;Marken,F.;Suarez,P.A.Z.;Consorti,C.S.;de Souza,R.F.;Dupont,J.New J.Chem.,2000,24:1009
101 Strehmel,V.;Laschewsky,A.;Stoesser,R.;Zehl,A.;Herrmann,W.J.Phys.Org.Chem.,2006,19:318
102 Tao,G.H.;Zou,M.;Wang,X.H.;Chen,Z.Y.;Evans,D.G.;Kou,Y.Aust.J.Chem.,2005,58:327
103 Wang,X.L.;Wan,H.;Guan,G.F.Acta Phys.-Chim.Sin.,2008,24:2077 [王小露,万 辉,管国锋.物理化学学报,2008,24:2077]
104 Wu,B.;Liu,Y.;Zhang,Y.M.;Wang,H.P.Chem.Eur.J.,2009,15:6889
105 Wu,Q.;Han,M.H.;Xin,H.L.;Dong,B.Q.;Jin,Y.Spectroscopy and Spectral Analysis,2008,28:282
106 Zou,Y.;Xu,H.J.;Wu,G.Z.;Jiang,Z.;Chen,S.M.;Huang,Y.Y.;Huang,W.;Wei,X.J.J.Phys.Chem.B,2009,113:2066
107 Wang,Y.;Li,H.R.;Han,S.J.J.Chem.Phys.,2005,123:174501
108 Wang,Y.;Li,H.R.;Han,S.J.J.Phys.Chem.B,2006,110:24646
109 Wang,Y.;Wang,C.M.;Zhang,L.Q.;Li,H.R.Phys.Chem.Chem.Phys.,2008,10:5976
110 Nanbu,N.;Sasaki,Y.;Kitamura,F.Electrochem.Commun.,2003,5:383
Progress of Investigations on Structures and Interactions of Ionic Liquids by Infrared Spectroscopy and Raman Spectroscopy
ZHANG Li-Qun LI Hao-Ran*
(Department of Chemistry,Zhejiang University,Hangzhou 310027,P.R.China)
O645
Received:May 26,2010;Revised:August 14,2010;Published on Web:October 8,2010.
*Corresponding author.Email:lihr@zju.edu.cn;Tel:+86-571-87952424.
The project was supported by the National Natural Science Foundation of China(20773109,20806065).
国家自然科学基金(20773109,20806065)资助项目

