鞣花酸对肿瘤细胞增殖抑制和诱导凋亡作用的初步研究
杨洪亮,张翼鷟,王晓芳,于 泳,赵智刚
(天津医科大学 附属肿瘤医院,天津 300000;天津市肿瘤防治重点实验室 血液肿瘤科)
鞣花酸对肿瘤细胞增殖抑制和诱导凋亡作用的初步研究
杨洪亮,张翼鷟,王晓芳,于 泳,赵智刚
(天津医科大学 附属肿瘤医院,天津 300000;天津市肿瘤防治重点实验室 血液肿瘤科)
目的:探讨鞣花酸(ellagic acid)对肿瘤细胞的生长抑制作用及其机制.方法:用鞣花酸处理体外培养的肿瘤细胞,用细胞增殖试验(MTT法)、克隆形成试验研究ELA对肿瘤细胞的增殖抑制作用,Brdu掺入试验、流式细胞术检测ELA对肿瘤细胞DNA合成、凋亡和细胞周期的影响.结果:用ELA处理后,肿瘤细胞增殖活性降低(p<0.05),克隆形成下降(p<0.005),Brdu标记指数降低(p<0.05),细胞周期分布改变,凋亡指数升高(p<0.01),G0/G1期细胞数增加(p<0.01),S期细胞数减少(p<0.01),在一定剂量内对正常细胞无明显影响.结论:ELA对所试肿瘤细胞的增殖有显著地抑制作用,其作用机理可能与抑制肿瘤细胞DNA合成,诱导肿瘤细胞凋亡和细胞周期阻滞有关.
鞣花酸;肿瘤细胞;增殖抑制;凋亡
鞣花酸是从各种坚果,软果及水生植物中提取出来的一种天然多酚[1,6,7,8],它具有天然抗氧化,清除体内自由基,保护低氧缺血所致心脑损伤等作用[2,3].目前研究表明,鞣花酸对前列腺癌有抑制作用[4-8].本研究观察鞣花酸对E M T 6细胞、人肝癌细胞S M M C-7 7 2 1及正常肝细胞L-0 2的作用,通过体内和体外实验观察鞣花酸对肿瘤增殖的抑制作用.
1 材料和方法
1.1 实验材料
1.1.1 受试物
受试物为鞣花酸,鞣花酸购于清华大学生物科学技术系药物药理学研究室.R P M I-1 6 4 0购自G i b c o/B R L公司(I nv i t r o g e nC o r p o r a t i o n,U S A),胎牛血清为华西生物研究所产品(中国,成都),胰酶及D M S O均购自北京华美生物技术公司,噻唑蓝(M T T)、5-溴脱氧尿苷(B r d u)为 S i g m a公司产品,A n t i-B r d u抗体为 Z y m e d公司产品,S-P试剂盒(S P 9 0 0 1)购自北京中杉金桥生物技术有限公司.
1.1.2 细胞及培养
小鼠乳腺癌细胞E M T 6、人肝癌细胞S M M C-7 7 2 1和正常肝细胞L-0 2购自中科院上海细胞生物研究所,用含1 0%胎牛血清、1 0 0 U/m l青霉素、1 0 0 μg/m l链霉素的 R P M I-1 6 4 0完全培养基,5%C O2,3 7℃培养.
1.2 实验方法
1.2.1 细胞增殖试验(M T T法)
用完全培养液调整细胞浓度为1×1 04/m l,接种于9 6孔板,每孔2 0 0 μl,培养过夜使细胞贴壁,次日分别用不同剂量的 E L A(2.5、5.0、1 0、2 0、4 0 u g/m l)分别处理肿瘤细胞和正常细胞,对照组不处理,每个剂量组接种3个复孔,置3 7℃,5%C O2培养,分别于培养 1、2、3、4、5天后,取 1个培养板,每孔加入5 m g/m l M T T试剂1 0 u l,继续培养4小时,再加D MS O 1 0 0 u l,振荡混匀1 5分钟,用酶标仪(λ=5 7 0 n m)测定O D值(O D值与活细胞数成正比),取其平均值.E L A对处理细胞增殖活性的影响表示为:细胞存活率=处理组O D值÷实验组O D值×1 0 0%,实验重复3次.
1.2.2 克隆形成实验
用完全培养液调整细胞浓度,接种于6孔板,每孔细胞数为3 0 0-4 0 0,每一剂量组接种3孔,培养过夜使细胞贴壁,次日分别用不同剂量的E L A(2.5、5.0、1 0 u g/m l)分别处理肿瘤细胞和正常细胞,对照组不处理,置3 7℃,5%C O2培养1 2天,甲醇固定,G i m s a染色,低倍镜下观察克隆形成,以大于5 0个细胞为标准,计数各孔克隆数,取其平均值,实验重复3次.
1.2.3 B r d u掺入试验
分别接种肿瘤细胞和正常细胞置有盖玻片的六孔板内,5×1 05/孔,培养过夜,用5 u g/m l E L A处理细胞,对照组不处理.3 6 h后加入B r d u(2 0 μg/mL),继续培养 1 2 h,固定(甲醇:丙酮=1:1)细胞贴片,2 M H C l处理3 0 m i n,硼酸缓冲液(p H=8.5)中和 5 m i n,P B S洗 3 m i n×3次,加 B r d u抗体(1:1 0 0),置4℃过夜,P B S洗3 m i n×3次,加生物素化二抗,3 7℃孵育3 0 m i n,P B S洗 3 m i n×3次,加 s t r e p t a v i d i n/p e r o x i d a s e,3 7℃孵育3 0 m i n,P B S洗3 m i n×3次,D A B显色,苏木精复染.D A B显色.显微镜下计数三个视野下的阳性和阴性细胞数.计算阳性细胞百分率即阳性细胞百分率=阳性细胞数/(阳性细胞+阴性细胞数)×1 0 0%.
1.2.4 细胞周期检测(流式细胞术)
用5 u g/m l E L A分别处理肿瘤细胞和正常细胞,对照组不处理.4 8小时后收集各组细胞,用7 0%乙醇固定,加1%R N A酶3 7℃孵育3 0分钟,用碘化丙啶(5 0 u g/m l)一步插入法D N A染色,上流式细胞仪检测D N A含量、细胞周期分布及凋亡细胞.
1.2.5 统计学处理
所有实验数据计算均数和标准差,细胞增殖实验资料用方差分析处理,其他实验数据用卡方检验处理,如果P﹤0.0 5,认为差异有显著性.
2 结果
2.1 E L A抑制癌细胞增殖
E L A对小鼠乳腺癌细胞、肝癌细胞和正常肝细胞增殖均有抑制作用,具有剂量和时间效应关系(P<0.0 5).对肿瘤细胞,I C50=5 u g/m l,正常细胞 I C50=1 0 u g/m l,当剂量为2.5 u g/m l时对正常细胞增殖无明显影响(图1).

2.2 E L A抑制癌细胞克隆形成
E L A对肿瘤细胞克隆形成有明显的抑制作用,其抑制作用与E L A剂量成正相关(P<0.0 5)(图2).

2.3 E L A抑制B r d u掺入
对照组小鼠乳腺癌细胞、肝癌细胞及正常肝细胞的B rd u标记指数分别为 6 6.2 5%±1.5%,5 9.2 3%±1.6%和6 6.6 7%±1.1%,用5 u g E L A处理3 6 h后,其标记指数分别为4 0.3 9%±1.3%,3 8.9 2%±1.1%和6 3.7 3%±1.3%.E L A处理使肿瘤细胞标记指数降低(p<0.0 5,图3),对正常细胞无影响(p>0.0 5).

2.4 E L A对细胞周期的影响
用5 u g/m l E L A处理肿瘤细胞4 8 h,凋亡指数和G0/G1期细胞数增加(p<0.0 1),S期细胞数减少(p<0.0 1),对正常细胞无作用(表1).
3 讨论
本实验主要探讨了鞣花酸作为一种酚酸类物质对肿瘤细胞的抑制作用,目前许多实验研究表明植物多酚具有明显的防癌抗癌作用[10].鞣花酸属于黄酮类多酚化合物,对多种肿瘤具有显著的抑制作用.因此,鞣花酸防癌抗癌作用的研究已日益受到重视.
本实验研究结果证实,E L A对小鼠乳腺癌细胞、人肝癌细胞增殖均有显著的抑制作用(P<0.0 5),I C50=5 u g/m l时,并具有剂量、时间效应关系.实验结果证明,E L A对肿瘤细胞增殖具有抑制作用.同时,E L A对正常肝细胞增殖也有一定程度的抑制作用(I C50=1 0 u g/m l).当剂量为 2.5-5 u g/m l时,对正常细胞增殖、凋亡及细胞周期无明显影响.结果提示,E L A的毒性作用不容忽视.
本实验研究结果证实,肿瘤细胞用5 u g/m l E L A处理3 6 h后,B r d u标记细胞显著低于未处理细胞(p<0.0 5,图3),对正常细胞无影响(p>0.0 5),结果提示,E L A抑制了肿瘤细胞D N A合成,使B r d u掺入减少.G l→S转换被认为是细胞周期最重要的调控点,因为它受到许多细胞周期相关蛋白的调控.G1期阻滞是细胞增殖抑制的重要环节,阻滞后细胞不能进入S期,D N A合成无法完成,干扰了蛋白质代谢,从而抑制肿瘤细胞的分裂.已有的研究表明,鞣花酸对细胞周期G1/S转换点的调节具有重要作用.本实验通过流式细胞仪检测进一步证实E L A处理使肿瘤细胞凋亡指数和G0/G1期细胞数增加(p<0.0 1),结果表明,E L A可诱导肿瘤细胞凋亡和G 0/G 1期阻滞.
综上可见,E L A对小鼠乳腺癌细胞和肝癌细胞的增殖有显著的抑制作用,其作用机理可能与抑制肿瘤细胞D N A合成,诱导肿瘤细胞凋亡和细胞周期阻滞有关.但其毒副作用亦不容忽视,值得进一步深入研究.
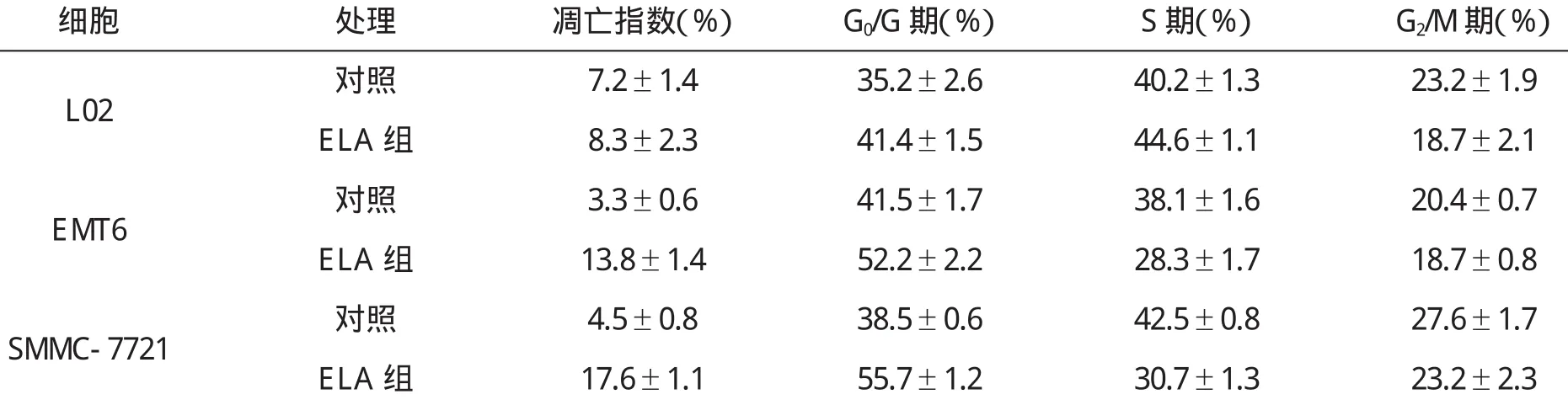
表1 E L A对对人肿瘤细胞和正常细胞细胞周期的影响
〔1〕Seeram NP,Lee R,Heber D.Bioavailahillty of ellagic acid in human plasmama after consumption of ellagitannins from pomegranate(Plata granatumL.)juice[J].Clin Chim Acta.2004,(1—2):63—68.
〔2〕Narayanan BA,Geafroy O,Willingham MC,et a1.p53 /p21(WAF1 /CIP1)expression and its possible role in G1 arrest and apoptosis in ellagic acid treated cancer cells[J].Cancer Lett,1999,(2):215—221.
〔3〕Li TM,Chen GW,Su CC,Lin JG,et a1.Ellagic acid indueed p53/p21 expression,G1 arrest and apoptosis in human bladder cancer T24ce11s[j].Anticancex Res,2005,25(2A):971—979.
〔4〕Narayanan BA,Re GG.IGF 一Ⅱdown regulation associated cell cycle arrest in colon cancer cells exposed|to phenolic antioxidant ellagic acid[J].Anticancer Res,2001,21(1A):359—364.
〔5〕Lin SS,Hung CF,Tyan YS,et al.Ellagic[correction of ellagica]acid inhibits arylamine N—acetyltransferase activity and DNA adduct formation in human bladder tulnor cell lines(T24 and TSGH 8301)[J].Urol Res,2001(6):371—376.
〔6〕ELISABETH M G,DANIELAE,ENIKO I.Allelopathic activity of Ceratophyllum demersumL.and Najas marina ssp.Intermedia (Wolfgang)Casper[J].Hydrobiologia,2003,506-509.
〔7〕ALITTA G,GRECA N D,MONACO D,et al.In vito algal growth inhibition by phytotoxins of Typha latifloia[J].J Chen ECOL,1990,16:2637-2646.
〔8〕COPAL B,GOEL U.Competition and allelopathy in aquatic plant communities[J].The Botanical Review,1993,59(3):155-210.
〔9〕Mukherjee A K,Basu S,Sarkar N,et al.Advances in cancer therapy with plant based natural products.Curr Med Chem,2001,8(12):1467~1486.
〔10〕王修杰,袁淑兰,魏于全 植物多酚的防癌抗癌作用[J].天然产物研究与开发,2005;17(4):508-517.
R 7 3-3 6
A
1673-260X(2010)10-0049-03

